Introduktion
Nitrat är en viktig fastlagrad kvävepool i den globala N-cykeln (Falkowski och Godfrey, 2008; Klotz och Stein, 2008). Nitrat kan reduceras via denitrifikation till dikväveoxid eller dikvävegas, varvid det försvinner från terrestra och akvatiska ekosystem, eller via ammonifikation till ammonium som kan behållas (Brandes et al., 2007; Klotz och Stein, 2008, 2010). I båda dessa processer reduceras nitrat till nitrit. I heterotrofa denitrifierare och ammoniakoxiderare reduceras nitrit ytterligare av NO-bildande nitritreduktas: NirS eller NirK. Nitritreduktionen till ammonium katalyseras av assimilatoriskt (NirB/NirA) eller respiratoriskt (NrfA) ammoniakbildande nitritreduktas (Klotz och Stein, 2008, 2010). Ammoniakoxiderande kemolithotrofer och metanotrofer kan också bilda NO genom oxidation av hydroxylamin, en annan potentiell väg för kväveförlust i terrestra och akvatiska ekosystem (Campbell et al., 2011). Flera Epsilonproteobakterier som kan använda nitrat för andning och/eller som enda kvävekälla för tillväxt kodar inte för homologer av någon av nitritreduktas-typerna, vilket tyder på att dessa organismer har en okänd mekanism för nitritreduktion till ammonium.
Genomannotationen visar att inte bara Nautilia profundicola, utan även flera patogena Campylobacter spp. bland Epsilonproteobakterierna kan utnyttja nitrat som en kvävekälla för tillväxt och/eller som en terminal elektronacceptor. N. profundicola tillhör den djupast förgrenade linjen av Epsilonproteobakterierna (Campbell et al., 2006; Smith et al., 2008) och dess släktingar har endast hittats i djuphavsmiljöer med hydrotermiska skorstenar. Campylobacter spp. är däremot vanligtvis förknippade med djurvärdar och deras närvaro i andra miljöer är dåligt definierad. Även om genomet hos N. profundicola, Campylobacter concisus, C. curvus och C. fetus innehåller gener som kodar för ett periplasmatiskt molybdopterin-guanin-dinukleotid-länkat nitratreduktas-komplex (NAP) finns det inga gener som kodar för vare sig ammonium- eller NO-bildande nitritreduktas. Dessutom identifierades en napC/cycB-gen i genomet hos N. profundicola (Campbell et al., 2009), vilket är ovanligt eftersom NAP-komplexet i Epsilonproteobakterier vanligtvis saknar ett NapC-protein (Kern och Simon, 2009; Klotz och Stein, 2010; Simon och Klotz, 2013). Baserat på genominformerad metabolisk rekonstruktion (Campbell et al., 2009) föreslog vi nyligen en ny väg för nitratassimilation (figur 1) där nitrit reduceras till hydroxylamin av en hydroxylamin:ubikinonredoxmodul (HURM, dvs. ett kinonberoende hydroxylamindehydrogenas), som vi benämner den omvända HURM-vägen. I N. profundicola tros HURM bestå av ett NapC/NrfH-relaterat cytokrom cM552 (cycB, NAMH_0559) som förmedlar elektronöverföring mellan kinonpoolen och ett periplasmatiskt hydroxylaminoxidoreduktas (HAO, NAMH_1280). HURM, som verkar i framåtriktad riktning och består av hydroxylamindehydrogenas (EC:1.7.2.6; HaoA3) som är kopplat till en elektronskyttel av cytokrom c-protein (c554 och/eller cM552 som kodas av cycA respektive cycB), kopplar oxidationen av hydroxylamin till kinonpoolen i aeroba ammoniak-oxiderande bakterier (Klotz och Stein, 2008; Simon och Klotz, 2013). I anaeroba ammoniakoxiderande (anammox) bakterier består redoxmodulen av hydrazinoxidoreduktas och ett ännu oidentifierat cytokrom c (Jetten et al., 2009; Simon och Klotz, 2013). I den omvända HURM-vägen transporteras hydroxylamin som genereras från nitrit i periplasman in i cytoplasman och reduceras till ammonium via ett hydroxylaminreduktas, även känt som hybridklusterprotein (Har/Hcp). De föreslagna elektronaccepterande reaktionerna i den omvända HURM-vägen är således:
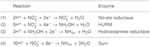
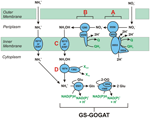
Figur 1. Den omvända HURM-vägen i N. profundicola. Enskilda steg är noterade med stora bokstäver i figuren. Numren i de avbildade proteinerna hänvisar till lokustaggar från AmH-genomet (dvs. 1280 = NAMH_1280 = HaoA). (A) Nitratreduktion genom respiratoriskt periplasmatiskt nitratreduktas (NapABGH, 0556-53), (B) HURM (Hydroxylamin:Ubiquinone Redox Module) bestående av ett omvänt fungerande hydroxylaminoxidoreduktas (HaoA, 1280) som fungerar som ett oktahemsnitritreduktas, som producerar hydroxylamin med hjälp av elektroner som doneras från ett tetrahemscytokrom c i NapC/NrfH/cM552-familjen (CycB, 0559). (C) Transport av hydroxylamin via ammoniaktransportörer som är besläktade med AmtB. (D) Reduktion av hydroxylamin till ammonium av ett hybridklusterprotein/hydroxylaminreduktas (Hcp/Har, 1074) som utnyttjar reduktionsförmågan från ett förutspått Fe-S-innehållande protein (1302) vars elektrondonator (X) för närvarande är okänd. Assimilering av ammonium till biomassa sker via glutaminsyntetas och glutamin:2-oxoglutarataminotransferas (GS-GOGAT).
Genomenen hos N. profundicola, C. concisus, C. curvus, C. curvus, C. fetus och Caminibacter mediatlanticus innehåller var och en gener som kodar för enzymerna i den omvända HURM-vägen, medan genomet hos andra Epsilonproteobakterier kodar för homologer av de klassiska NO-bildande NirS/NirK- och ammoniumbildande assimilatoriska sirohems NirA- eller respiratoriska pentahems NrfA-nitritreduktaserna . Vi antar att den omvända HURM-vägen förbättrar överlevnaden och/eller spridningen av N. profundicola och Campylobacter spp. i ammoniumfattiga värdmiljöer eller miljöer som inte är associerade med värdmiljöer. För att denna hypotes ska stämma måste dock den omvända HURM-vägen tillhandahålla ammonium för biosyntes och/eller underlätta energihushållning i dessa organismer.

Tabell 1. Genförteckningar för kvävemetabolism i genomsekvenserade Epsilonproteobakterier.
Resultat
Energetik för tillväxt i N. profundicola
N. profundicola utnyttjar både format och väte som elektrondonatorer för energimetabolism och odlas vanligen på polysulfid som elektronacceptor (Campbell et al, 2001; Smith et al., 2008). Beräkningar under standardförhållanden (1 M av alla arter, 25 °C, pH = 7) visar att när nitrat reduceras genom reaktionerna i den omvända HURM-vägen är den fria Gibbs-energin (Δ G°) betydligt större än den som är tillgänglig från reduktionen av polysulfid (tabell 2). Till exempel är Δ G° per mol format som oxideras med nitrat 7,4 gånger högre än för polysulfid (-237 kJ mol-1 jämfört med -32 kJ mol-1). Utifrån denna beräkning kan man förutsäga att tillväxten av N. profundicola bör stimuleras i kulturer med nitrat som elektronacceptor i förhållande till polysulfid.
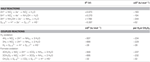
Tabell 2. Beräknade fria reaktionsenergier under standardförhållanden (1 M för alla arter, 25 °C och pH = 7) för halvreaktioner av kväveföreningar och polysulfid som tar emot elektroner och kopplade reaktioner med formiat eller väte som elektrondonator.
Växt av N. profundicola med nitrat
För tidigare karakterisering och tillväxt av N. profundicola användes medier med polysulfid som en kombinerad svavelkälla och elektronacceptor (Campbell et al, 2001, 2009; Smith et al., 2008). För att ytterligare klargöra nitratets roll i energimetabolismen hos N. profundicola odlades stam AmH med sulfid som enda svavelkälla så att nitratet var den enda elektronacceptorn (figur 2). Elektrondonatorn var en blandning av väte och formiat i ett medium utan andra svavel- eller kvävekällor (Campbell et al., 2001). Tillväxthastigheten med nitrat som potentiell elektronacceptor och kvävekälla och sulfid (svavelkälla) eller polysulfid (svavelkälla och potentiell elektronacceptor) var mer än dubbelt så hög som den tillväxthastighet som observerades i kulturer som använde ammonium som enda kvävekälla och polysulfid som elektronacceptor och svavelkälla. Som förväntat kunde negativa kontrollkulturer (ingen elektronacceptor) som fick ammonium som kvävekälla och sulfid som svavelkälla inte växa.
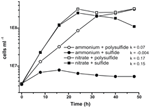
Figur 2. Tillväxt av N. profundicola med angivna elektronacceptorer, kväveföreningar och svavelkällor. Tillväxthastigheterna bestämdes mellan 8 och 24 timmar; k = specifik tillväxthastighetskonstant (h-1). Varje punkt är medelvärdet av 2 eller 3 oberoende biologiska replikat.
Näringsbalans i N. profundicola-kulturer
För att bekräfta att nivån av ammonium som producerades av N. profundicola översteg det biosyntetiska behovet beräknade vi det biosyntetiska kvävebehovet enligt följande. Med utgångspunkt i ett C:N-förhållande på 32:6,4 för exponentiellt växande bakterioplankton (Vrede et al., 2002), 288 fg C μm-3 för exponentiellt växande Escherichia coli (Loferer-Krossbacher et al, 1998) och en cellvolym på 0,021 μm3 beräknad utifrån de rapporterade dimensionerna hos N. profundicola (Smith et al., 2008), krävs det ~120 ng ml-1 N (~9 μM) för att producera 1 × 108 celler ml-1, en siffra som inte skulle förändras oavsett vilken N-källa som används. N. profundicola använde inte en betydande mängd av det ammonium som tillfördes under tillväxten med polysulfid som elektronacceptor (figur 3, öppna cirklar), vilket stämmer överens med det låga N-behov som beräknats för att producera de observerade celltätheterna. Kulturen med ammonium plus sulfid växte inte (figur 2) och förbrukade inte heller ammonium på ett påvisbart sätt (figur 3, slutna cirklar). Däremot var mängden ammonium som producerades av celler som odlades med 5 mM nitrat 4,6 mM med polysulfid och 5,2 mM med sulfid (figur 3, öppna respektive slutna fyrkanter). Om den omvända HURM-vägen i Epsilonproteobakterierna främst tjänar till att producera ammonium för biosyntes skulle vi förvänta oss att låga nivåer av exogent ammonium kraftigt skulle undertrycka HURM-vägens genuttryck och nitratreduktionsaktivitet. Den stökiometriska omvandlingen av nitrat till ammonium utöver det förutspådda N-behovet och den observerade ammoniumförbrukningen i ammonium + polysulfidkulturerna stämmer dock överens med hypotesen att nitrat används som en terminal elektronacceptor av N. profundicola och att nitratammonifiering inte är föremål för repression av ammonium.
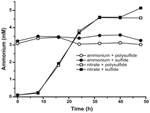
Figur 3. Ammoniumkoncentrationer uppmätta i kulturer av N. profundicola som innehåller de angivna elektronacceptorerna, kväveföreningarna och svavelkällorna. Varje punkt är medelvärdet av 2 eller 3 oberoende biologiska replikat.
15N-NO-3 Inkorporering i biomassa
Potentialen för nitratassimilation bedömdes genom att undersöka inkorporeringen av 15N-märkt ammonium eller nitrat i N. profundicolas biomassa under tillväxt med alla ovanstående kombinationer av elektrondonatorer och potentiella acceptorer. N. profundicola som odlas på 20 Atom% 15N-märkt ammonium med polysulfid producerar biomassa som är berikad till ~10 Atom% 15N efter en omgång av satsvis odling (figur 4), medan den omärkta kontrollen inte var berikad i 15N. Kulturer som odlas med sulfid och 20 Atom% 15N-märkt nitrat gav biomassa som var berikad till 16 Atom% 15N (figur 4). Nitratodlad biomassa innehöll ungefär 5 gånger mer N än ammoniumodlad biomassa (data visas inte), vilket kan förklara den mer omfattande anrikningen av 15N i de nitratodlade proverna.
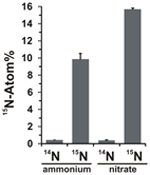
Figur 4. Kväveupptag i N. profundicolas biomassa bestämd efter en omgång batchodling med 5 mM av de angivna kväveföreningarna tillförda i naturlig mängd (14N) eller med 20 Atom% 15N. Värdena är medelvärden av 3 oberoende biologiska replikat ± standardavvikelsen.
Transkription av viktiga vägarbetesgener
Transkriptionens abundans för gener som kodar för enzymer i den föreslagna omvända HURM-vägen i N. profundicola bestämdes genom kvantitativ realtids-PCR i satsvisa kulturer odlade med ammonium eller nitrat. Alla komponenter i den föreslagna vägen uppvisade en stark ökning av transkriptmängden i nitratodlade kulturer (figur 5). mRNA som kodar för en nitratreduktasunderenhet (napA) var 4,6 gånger (P < 0,05, tvåsidigt heteroscedastiskt t-test) rikligare i nitrat + sulfidodlade celler i förhållande till ammonium + polysulfidodlade celler. Transkriptioner av båda komponenterna i HURM, haoA och cycB/napC, ökade med 8,5 respektive 7,1 gånger (P < 0,05 för båda). I överensstämmelse med vår förutsägelse att hydroxylamin som produceras i periplasman av HURM skulle transporteras genom stora facilitatorproteinkanaler, ökade mRNA som kodar för båda homologerna av ammonium/metylammoniumtransportören amtB med 4,5 gånger (amtB-1, NAMH_0397, P < 0,08) och 10,3 gånger (amtB-2, NAMH_0215, P > 0,10). Hydroxylamin är en kraftfull mutagen som måste avgiftas när den kommer in i cytoplasman. Vi föreslår att detta sker genom NADH-beroende Har/Hcp baserat på studier av hcp-genen i genklustret för nitratassimilering hos Rhodobacter capsulatus E1F1 där den krävs för reduktion och assimilering av hydroxylamin som produceras av ett cytoplasmatiskt assimilatoriskt nitratreduktas (Cabello et al., 2004; Pino et al., 2006). I överensstämmelse med detta förslag sågs den största förändringen i transkriptmängd för har, som ökade med 11,7 gånger, men denna förändring var inte signifikant (P > 0,10) på grund av den höga variabiliteten i oberoende mätningar av har transkriptmängd. Ursprungligen hade vi föreslagit att elektrondonatorn till Har var ett NADH-dehydrogenas som kodas av NAMH_0542 (Campbell et al., 2009). Nu anser vi dock att en bättre kandidat för denna funktion är NAMH_1302, ett predikterat 4Fe-4S klusterprotein, baserat på bevarande i andra Epsilonproteobakterier (tabell 1). I överensstämmelse med denna förutsägelse var transkriptioner av NAMH_1302 4,6 gånger vanligare i nitratodlade celler jämfört med ammonium, men förändringen var inte signifikant (P > 0,10).
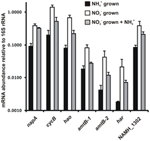
Figur 5. Steady state mRNA-nivåer för nyckelgener som kodar för enzymer i den omvända HURM-vägen i N. profundicola som odlas med ammonium + polysulfid (svarta staplar), nitrat + sulfid (vita staplar) eller nitrat + polysulfid efter tillsats av ammonium. Transkriptmängden bestämdes genom fluorescerande RT-PCR och normaliserades till 16S rRNA-mängden som bestämdes i varje prov. Värdena är medelvärden av tre oberoende biologiska replikat ± standardavvikelsen.
För att testa potentiell ammoniumrepressering av uttrycket av banor tillsattes ammonium till nitrat + sulfid-odlade kulturer och mRNA-flödet kvantifierades för samma gener. Generellt sett minskade ammoniumtillsatsen mRNA-abundansen för de gener som kodar för den omvända HURM-banan från 1,2- till 3,6-faldigt (figur 5, grå staplar), även om denna effekt endast var signifikant (P < 0,10) för haoA- och napC/cycB-transkriptioner som kodar för HURM-underenheterna. Intressant nog minskade uttrycket av napA minst (1,2 gånger), vilket tyder på behovet av nitratrespiration i dessa celler. I inget fall minskade tillsatsen av ammonium transkriptnivåerna till de nivåer som sågs i kulturer som odlades i ammonium + polysulfid.
Bevis för en hydroxylaminintermediär
Direkta mätningar av hydroxylamin i filtrat från N. profundicola-kulturer som odlades med nitrat fann låga, men genomgående detekterbara nivåer av hydroxylamin (5,7 ± 3,5 μM, SD, n = 3). Denna låga nivå är förenlig med en intermediär vars produktions- och konsumtionshastigheter är nära matchade.
För att avgöra om hydroxylamin kan metaboliseras av N. profundicola, inkuberades tvättade suspensioner av nitratodlade celler i nitratfritt tillväxtmedium med vätgas som enda elektrondonator. Hydroxylamin tillsattes som en potentiell elektronacceptor och koncentrationerna av både hydroxylamin och ammonium följdes över tiden. Resultaten av detta experiment visar att nitratodlade celler av N. profundicola snabbt och fullständigt omvandlar hydroxylamin till ammonium (figur 6). Den specifika hastigheten för hydroxylaminomvandlingen i detta experiment var 28,6 μM min-1 108 celler-1. Den ammoniumproduktionshastighet från nitrat som beräknats för exponentiell tillväxt i figur 3 (8-24 timmar) är ~3 μM min-1 (108 celler)-1. Den uppmätta omvandlingshastigheten för hydroxylamin överstiger således vida den ammoniumproduktionshastighet som observerats under tillväxt av N. profundicola med nitrat. En liknande tät koppling mellan hydroxylaminproduktion och avlägsnande rapporterades nyligen för den kemolithotrofa ammoniakoxiderande arkeonen Nitrosopumilus maritimus, där hydroxylaminoxidation är ett viktigt kataboliskt steg (Vajrala et al., 2013).
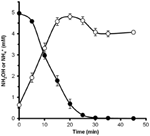
Figur 6. Hydroxylamin omvandlas snabbt till ammonium av N. profundicola. Koncentrationerna av hydroxylamin (slutna cirklar) och ammonium (öppna cirklar) följdes efter tillsats av 5 mM hydroxylamin till en vilande cellsuspension. Punkterna är medelvärden från tre replikat ± standardavvikelsen.
Diskussion
Den data som presenteras här stämmer överens med en ny väg för nitratreduktion i organismer som saknar klassiska NO-bildande (NirS eller NirK) eller ammoniumbildande (NirB/NirA) nitritreduktasar med N. profundicola stam AmH som ett användbart modellsystem. En omvänd HURM-väg har föreslagits där nitrit reduceras till hydroxylamin i periplasman och därefter reduceras till ammonium i cytoplasman (Campbell et al., 2009). Den ursprungliga vägen har modifierats något här för att inkludera en mer trolig kandidat för den proximala elektrondonatorn till Har/Hcp, ett förutspått 4Fe-4S-innehållande protein som kodas av NAMH_1302 (figur 1). Homologer till NAMH_1302 finns bevarade i C. concisus (GenBank accession YP_001466207), C. curvus (YP_001408944), C. fetus (YP_892678) och C. mediatlanticus (ZP_01871213) som har alla andra gener för den omvända HURM-banan. Dessutom uppvisade NAMH_1302 en ökad abundans av transkriptet i N. profundicola-celler som odlades på nitrat i förhållande till ammonium.
Men produktionen av hydroxylamin från nitrat och nitrit både via kemiska (Rollefson och Oldershaw, 1932) och biologiska vägar (Lindsey och Rhines, 1932) är sedan länge känd och ett 3-komplex visades reducera nitrit till hydroxylamin när det förses med reduktionsmedel (Kostera et al, 2010), men förhållandet mellan hydroxylamin- och ammoniumproduktion från nitrit i den omvända HURM-vägen är ännu inte klarlagt. Det är känt att bakterier tar upp extracellulärt hydroxylamin; exogent tillfört hydroxylamin ackumuleras lätt i anammoxosomen hos Kuenenia stuttgartiensis (Lindsay et al., 2001; Schmidt et al., 2004), en avdelning som endast kan nås genom att korsa både cell- och anammoxosomemembranen. Det föreslagna upptaget av det starkt mutagena hydroxylaminet kräver skydd mot DNA-skador, vilket delvis kan förklara det omfattande komplement av DNA-reparationssystem som identifierats i N. profundicola (Campbell et al., 2009). Hydroxylamin har också föreslagits som en intermediär för ammoniumproduktion från nitrit i växter och alger eftersom ferredoxinberoende nitritreduktas uppvisar hög reaktivitet och specificitet för detta substrat (Kuznetsova et al., 2004; Hirasawa et al, 2010).
I motsats till HURM:s kinonreduktasfunktion i ammoniakoxidatorer (Klotz och Stein, 2008; Simon och Klotz, 2013) föreslår vi att HURM i N. profundicola fungerar, i likhet med NrfAH, som ett periplasmatiskt kinoloxidassystem som skickar elektroner från kinolpoolen för att reducera nitrit till hydroxylamin. Det är troligt att den omvända HURM-vägen har utvecklats från en gemensam förfader till NrfAH- och ONR-ammonifieringsmodulen i anammoxbakterier. Vi antar att detta skedde innan HURM – inklusive ett kovalent bundet trimeriskt HaoA-komplex som kan disproportionera hydroxylamin – användes som en katabolisk modul i både anaeroba och aeroba ammoniakoxiderande bakterier (Jetten et al., 2009; Klotz och Stein, 2010; Campbell et al., 2011; Kern et al., 2011; Simon och Klotz, 2013). En liknande omvänd funktion från reducerande till oxiderande aktivitet som sker genom kovalent bindningsriktad komplexbildning har diskuterats för det NO-reducerande cytokromet c’-beta (cytS) och det NO-oxiderande cytokromet P460 (cytL) (Elmore et al., 2007). Gener som kodar för NrfAH- och reverse-HURM-modulerna samexisterar i endast en bakteriell genomsekvens, C. fetus 82-40 (tabell 1). Det visades nyligen att oktahemscytokrom c hydroxylamindehydrogenas utvecklats som en medlem av en superfamilj av multihemscytokrom c-protein med funktioner i kväve- och svavelcyklerna och att cytokrom cM552 (CycB), NrfH och NapC är medlemmar av en annan cytokrom c-superfamilj (Bergmann et al., 2005; Klotz och Stein, 2008; Kern et al., 2011; Simon och Klotz, 2013). Det är också känt att NAP-komplex i Epsilonproteobakterier i allmänhet inte innehåller NapC-underenhetsproteiner (Klotz et al., 2006; Sievert et al., 2008; Kern och Simon, 2009; Klotz och Stein, 2010; Simon och Klotz, 2013). Den föreslagna omvända funktionen hos ett n-cM552 (CycB/NapC)-komplex som ett nitritreduktas-quinoloxidaskomplex är möjlig med tanke på närvaron av båda transkriptionerna och frånvaron av den kritiska tyrosinproteinliganden i N. profundicola HaoA (Campbell et al, 2009), vilket skiljer de N-oxidreducerande NrfA och ONR från de N-oxidoxiderande HAO-komplexen (Bergmann et al., 2005; Klotz och Stein, 2008; Kern et al., 2011; Simon och Klotz, 2013).
Data om 15N-assimilering fastställde att N. profundicola införlivar nitratkväve i biomassan under tillväxten när det tillhandahålls som enda kvävekälla. Den stora överproduktionen av ammonium från nitrat jämfört med de beräknade kraven för biosyntesen får oss dock att dra slutsatsen att den primära funktionen av nitratreduktion till ammonium hos N. profundicola är att vara en effektiv respiratorisk elektronacceptor. Denna slutsats stöds av den ökade tillväxten och avkastningen i N. profundicola-odlingar med nitrat som enda elektronacceptor. Dessutom stämmer genuttrycksdata överens med vårt förslag (Campbell et al., 2009) att detta sker via en samverkande funktion av Nap, HURM (3 och cM552) och Har/Hcp som en ny N-assimilering och energihushållningsväg: den omvända HURM-vägen. Slutligen visar uppgifterna att N. profundicola har förmågan att snabbt reducera hydroxylamin till ammonium, vilket överensstämmer med förslaget om fritt hydroxylamin som en intermediär i den omvända HURM-vägen. Den höga hastigheten för hydroxylaminupptag som observerats förklarar sannolikt varför den inte observeras konsekvent under tillväxt av kulturer på nitrat. Preliminära mätningar av ammoniumproduktion från nitrat eller nitrit i vilande celler liknar den hastighet på 3 μM min-1 (108 celler)-1 som beräknats från kulturer, vilket är ~10 gånger lägre än den observerade hydroxylaminförbrukningshastigheten. Med tanke på dessa hastigheter bör hydroxylamin förbrukas omedelbart efter produktionen i kulturer som växer på nitrat. Eftersom hydroxylamin är mutagent, antar vi att detta återspeglar tidigare selektivt tryck för att upprätthålla låga hydroxylaminnivåer under tillväxten.
Märkning av biomassa har försökts med 15N-NH2OH i batchkulturer av N. profundicola, men det har ännu inte lyckats (data visas inte). Med tanke på att hydroxylamin i batchkultur måste tillföras i låga koncentrationer i förhållande till det omärkta nitratet för att undvika toxicitet och att den stora majoriteten av N från hydroxylamin bör omvandlas till ammonium (>90 % baserat på figur 3), är detta resultat inte förvånande. Kortsiktiga märkningsexperiment med mycket högre koncentrationer av märkt hydroxylamin som enda N-källa kan slutgiltigt fastställa denna punkt.
Sammanfattningsvis är de data som presenteras här förenliga med en modell där N. profundicola reducerar nitrat via en fri hydroxylaminintermediär. Dessa experiment utesluter ännu inte helt möjligheten att den omvända HURM-aktivitet som föreslås i N. profundicola fungerar som ett ammoniumbildande nitritreduktas som överför 6 elektroner utan att frigöra en N-oxidintermediär. Opublicerade resultat tyder på att några punktmutationer i nrfA-genen kan göra pentahems cytokrom c nitritreduktas till ett läckande enzym som släpper ut N-oxidintermediärer och misslyckas med att omvandla nitrit stökiometriskt till ammonium (Jörg Simon, pers. kommunic.). Med tanke på det evolutionära förhållandet mellan nrfA och haoA (Bergmann et al., 2005; Simon och Klotz, 2013) kan den omvända HURM-modulen i N. profundicola naturligt fungera som ett ammonium- och hydroxylaminproducerande enzymkomplex medan det existerande NrfA fungerar ”läckagefritt” som ett ammoniumproducerande nitritreduktas. Ytterligare experiment där man använder hämmare av Har/Hcp med nitrat eller nitrit som substrat i hela celler och/eller biokemiska studier av det omvända HURM-komplexet för att bestämma in vitro-produkten bör ge ytterligare direkta tester av denna hypotes. Oavsett den specifika mekanismen tyder N. profundicolas omfattande produktion av ammonium långt utöver biosyntetiska behov på att den och besläktade Epsilonproteobakterier kan spela en ekologisk roll som ammoniumkälla i nitratrika, ammoniumfattiga, hypoxiska miljöer där de är vanligt förekommande.
Material och metoder
Beräkningar av fri energi
Gibbs fria energier (tabell 2) beräknades från standardredoxpotentialer för halvreaktionerna med hjälp av Nernst-ekvationen (Δ G0 = -nFE0) eller genom summering av fria energier för halvreaktioner som samlats in från litteraturen (Thauer et al, 1977; van der Star et al., 2008). Alla beräkningar utfördes vid standardförhållanden (1 M alla arter, 25°C, pH = 7).
Kulturering och analys av kväveföreningar
N. profundicola stam AmH (ATCC BAA-1463) odlades och cellerna räknades som tidigare beskrivits (Smith et al., 2008; Campbell et al., 2009). Ammonium i kultursupernatanten kvantifierades efter derivatisering med dansylklorid och separation genom HPLC med fluorescensdetektion (Shakila et al., 2001). Nitrat kvantifierades genom HPLC med UV/Vis-detektion. Hydroxylaminkoncentrationer bestämdes i kulturfiltrat (0,2 μm) enligt beskrivning av Frear och Burrell (1955).
15N-märkningsprocedurer
Stocklösningar av 20 Atom% 15N-nitrat och 15N-ammonium framställdes genom att blanda >99 Atom% och salter med naturlig abundans för att bereda medium med en slutkoncentration på 5 mM nitrat eller ammonium efter behov. Cellerna skördades från 15N-märkta kulturer genom centrifugering och cellpelletsen tvättades tre gånger med nanoprent vatten för att avlägsna salter. Cellsuspensionen torkades i tennkapslar som skickades till laboratoriet för stabila isotoper vid University of California-Davis där 15N Atom % bestämdes med hjälp av masspektrometri av isotopförhållandet. Kontrollproverna visade att ingen isotopkontaminering hade skett under provbehandlingen (data visas inte).
Kvantitativ PCR
Gen-specifika primers (tabell 3) användes för att kvantifiera mRNA-abundansen i totalt RNA som extraherats från N. profundicola enligt tidigare beskrivning (Campbell et al, 2009).

Tabell 3. Primers och villkor för Q-RT-PCR-kvantifiering av specifika gener i totala RNA-prover som extraherats från N. profundicola.
Hydroxylaminupptag
N. profundicola odlades på H2 och formiat som elektrondonatorer och nitrat som enda elektronacceptor till sen exponentiell fas. Cellerna skördades genom centrifugering. Alla överföringar och celltvättar utfördes i en anaerob kammare från Coy Laboratories. Cellerna återuppsattes med nitratfritt tillväxtmedium till en slutkoncentration av ~109 celler ml-1 och inkuberades vid 45 °C i 2 timmar i en atmosfär av 80 % H2 + 20 % CO2 innan hydroxylamin (5 mM slutkoncentration) tillsattes från en anaerobt framställd stamlösning. Alikvots av cellsuspensionen filtrerades och analyserades för hydroxylamin enligt ovan och för ammonium genom HPLC efter derivatisering med dietyletoximetylenemalonat (Gómez-Alonso et al, 2007).
Författarbidrag
Thomas E. Hanson, Barbara J. Campbell och Martin G. Klotz utformade experiment i samarbete och tolkade resultaten, Thomas E. Hanson utförde alla analyser av kväveföreningar och förberedde proverna för masspektrometri, Barbara J. Campbell odlade alla kulturer och utförde kvantitativ PCR, Katie M. Kalis utförde upptagsexperiment med hydroxylamin, Mark A. Campbell identifierade NAMH_1302 som en relevant gen. Thomas E. Hanson utarbetade artikeln, som därefter reviderades av Thomas E. Hanson, Barbara J. Campbell och Martin G. Klotz.
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Författarna vill tacka Lisa Y. Stein (Univ. Alberta-Edmonton), Jenn Macalady (Penn State Univ.), David Kirchman och Matt Cottrell (Univ. Delaware) för kritiska genomläsningar av manuskriptutkast, Jennifer Biddle för tillgång till en anaerob kammare och Kathy Coyne för tillgång till en HPLC. Detta projekt stöddes av bidrag från National Science Foundation till Barbara J. Campbell och S. Craig Cary (EF-0333203), till Barbara J. Campbell (DEB-0640414), till Barbara J. Campbell och Thomas E. Hanson (MCB-0950691) och till Martin G. Klotz (MCB-0948202/1202648), genom ett EPSCoR RII-2-bidrag till University of Delaware (EPS-0814251) och genom stimulansmedel från University of North Carolina till Martin G. Klotz.
Kern, M., och Simon, J. (2009). Elektrontransportkedjor och bioenergetik för respiratorisk kvävemetabolism i Wolinella succinogenes och andra Epsilonproteobakterier. Biochim. Biophys. Acta 1787, 646-656. doi: 10.1016/j.bbabio.2008.12.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lindsey, G. A., and Rhines, C. M. (1932). Produktion av hydroxylamin genom reduktion av nitrater och nitriter av olika renkulturer av bakterier. J. Bacteriol. 24, 489-492.
Pubmed Abstract | Pubmed Full Text
Loferer-Krossbacher, M., Klima, J. och Psenner, R. (1998). Bestämning av bakteriecellens torrmassa genom transmissionselektronmikroskopi och densitometrisk bildanalys. Appl. Environ. Microbiol. 64, 688-694.
Pubmed Abstract | Pubmed Full Text