Introduction
A nitrát a globális N-ciklus egyik legfontosabb kötött nitrogénkészlete (Falkowski és Godfrey, 2008; Klotz és Stein, 2008). A nitrát denitrifikáció útján dinitrogén-oxiddá vagy dinitrogéngázzá redukálódhat, aminek következtében elveszik a szárazföldi és vízi ökoszisztémákból, vagy ammonifikáció útján ammóniummá, amely visszatartható (Brandes et al., 2007; Klotz és Stein, 2008, 2010). Mindkét útvonal során a nitrát nitritté redukálódik. A heterotróf denitrifikátorokban és ammóniaoxidálókban a nitritet NO-képző nitritreduktázok redukálják tovább: NirS vagy NirK. A nitrit ammóniává történő redukcióját asszimilációs (NirB/NirA) vagy respirációs (NrfA) ammóniaképző nitrit-reduktáz katalizálja (Klotz és Stein, 2008, 2010). Az ammóniát oxidáló kemolitotrófok és metanotrófok hidroxilamin oxidációjával is képezhetnek NO-t, ami a nitrogénveszteség másik lehetséges útja a szárazföldi és vízi ökoszisztémákban (Campbell et al., 2011). Számos olyan Epsilonproteobaktérium, amely képes a nitrátot légzésre és/vagy a növekedés kizárólagos nitrogénforrásaként felhasználni, nem kódolja egyik nitritreduktáz típus homológját sem, ami arra utal, hogy ezek az organizmusok rendelkeznek a nitrit ammóniumra történő redukciójának fel nem ismert mechanizmusával.
A genom annotációja azt jelzi, hogy nemcsak a Nautilia profundicola, hanem az Epsilonproteobaktériumok közül számos patogén Campylobacter spp. is használhatja a nitrátot a növekedés nitrogénforrásaként és/vagy terminális elektronakceptorként. A N. profundicola az Epsilonproteobaktériumok legmélyebben elágazó vonalának tagja (Campbell et al., 2006; Smith et al., 2008), és rokonait eddig csak mélytengeri hidrotermikus ventilációs környezetben találták meg. Ezzel szemben a Campylobacter spp. jellemzően állati gazdaszervezetekhez társul, és jelenlétük más környezetekben nem jól meghatározott. Míg a N. profundicola, a Campylobacter concisus, a C. curvus és a C. fetus genomja tartalmaz periplazmatikus molibdopterin guanin-dinukleotiddal kapcsolt nitrátreduktáz-komplexet (NAP) kódoló géneket, addig sem ammónium-, sem NO-képző nitritreduktázokat kódoló gének nincsenek. Emellett a N. profundicola genomjában azonosítottak egy napC/cycB gént (Campbell és mtsai., 2009), ami szokatlan, mivel az Epsilonproteobaktériumok NAP komplexéből általában hiányzik a NapC fehérje (Kern és Simon, 2009; Klotz és Stein, 2010; Simon és Klotz, 2013). A genom-informált metabolikus rekonstrukció alapján (Campbell és mtsai., 2009) nemrégiben javasoltunk egy új nitrátasszimilációs útvonalat (1. ábra), amelyben a nitritet egy hidroxilamin:ubikinon redox modul (HURM, azaz egy kinon-függő hidroxilamin-dehidrogenáz) redukálja hidroxilaminná, amit mi fordított-HURM útvonalnak nevezünk. A N. profundicola-ban a HURM feltételezhetően egy NapC/NrfH-hez kapcsolódó citokróm cM552-ből (cycB, NAMH_0559) áll, amely közvetíti az elektrontranszfert a kinon-pool és egy periplazmatikus hidroxilamin-oxidoreduktáz (HAO, NAMH_1280) között. Az aerob ammóniaoxidáló baktériumokban a hidroxilamin-dehidrogenázból (EC:1.7.2.6; HaoA3) álló, előrefelé működő HURM, amely egy citokróm c fehérje elektronsiklóhoz (c554 és/vagy cM552, amelyet a cycA, illetve a cycB kódol) kapcsolódik, összekapcsolja a hidroxilamin oxidációját a kinon-medencével (Klotz és Stein, 2008; Simon és Klotz, 2013). Az anaerob ammónia-oxidáló (anammox) baktériumokban a redoxmodul hidrazin-oxidoreduktázból és egy még nem azonosított citokróm c-ből áll (Jetten és mtsai., 2009; Simon és Klotz, 2013). A fordított HURM-útvonalban a periplazmában a nitritből keletkező hidroxilamin a citoplazmába kerül, és egy hidroxilamin-reduktáz, más néven hibrid klaszterfehérje (Har/Hcp) segítségével ammóniumra redukálódik. A fordított-HURM útvonal javasolt elektronelfogadó reakciói tehát a következők:
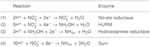
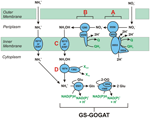
1. ábra. A fordított HURM útvonal a N. profundicola-ban. Az egyes lépéseket nagybetűkkel jelöljük az ábrán. Az ábrázolt fehérjékben szereplő számok az AmH genomból származó lókuszcímkékre utalnak (pl. 1280 = NAMH_1280 = HaoA). (A) Nitrátredukció a légzőszervi periplazmatikus nitrátreduktáz (NapABGH, 0556-53) által, (B) HURM (Hydroxylamine:Ubiquinone Redox Module), amely egy fordított irányú hidroxilamin-oxidoreduktázból (HaoA, 1280) áll, amely ocatahem nitrit-reduktázként működik, és a NapC/NrfH/cM552 családba tartozó tetrahem citokróm c (CycB, 0559) által leadott elektronok felhasználásával hidroxilamint állít elő. (C) A hidroxilamin szállítása az AmtB-vel rokon ammóniatranszportereken keresztül. (D) A hidroxilamin redukciója ammóniumra egy hibrid klaszterfehérje/hidroxilamin-reduktáz (Hcp/Har, 1074) által, amely egy előre jelzett Fe-S-tartalmú fehérje (1302) redukáló erejét használja, amelynek elektrondonora (X) jelenleg ismeretlen. Az ammónium asszimilációja a biomasszába glutamin-szintetáz és glutamin:2-oxoglutarát aminotranszferáz (GS-GOGAT) segítségével történik.
A N. profundicola, C. concisus, C. curvus, C. curvus, C. fetus és a Caminibacter mediatlanticus mindegyike tartalmazza a reverz-HURM útvonal enzimjeit kódoló géneket, míg más Epsilonproteobaktériumok genomjai a klasszikus NO-képző NirS/NirK és az ammóniumképző asszimiláló siroheme NirA, illetve a légző pentaheme NrfA nitritreduktázok homológjait kódolják . Feltételezzük, hogy a fordított HURM útvonal javítja a N. profundicola és a Campylobacter spp. túlélését és/vagy terjedését ammóniumhiányos gazdaszervezetben vagy nem gazdaszervezethez kapcsolódó környezetben. Ahhoz azonban, hogy ez a hipotézis igaz legyen, a reverz-HURM útvonalnak ammóniumot kell biztosítania a bioszintézishez és/vagy elő kell segítenie az energia megőrzését ezekben a szervezetekben.

Táblázat 1. A nitrogénanyagcsere-génleltárak a genom-szekvenált Epsilonproteobaktériumokban.
Eredmények
A növekedés energetikája a N. profundicola-ban
A N. profundicola mind a formátot, mind a hidrogént elektrondonorként használja az energiaanyagcseréhez, és jellemzően poliszulfidon mint elektronakceptoron tenyésztik (Campbell et al., 2001; Smith et al., 2008). A standard körülmények között végzett számítások (1 M minden fajból, 25°C, pH = 7) azt mutatják, hogy amikor a nitrátot a fordított HURM-útvonal reakciói redukálják, a Gibbs-féle szabad energia (Δ G°) lényegesen nagyobb, mint a poliszulfid redukciójából elérhető energia (2. táblázat). Például a nitráttal oxidált formiát mólonkénti Δ G°-ja 7,4-szer nagyobb, mint a poliszulfidé (-237 kJ mol-1 vs. -32 kJ mol-1). Ebből a számításból megjósolható, hogy a N. profundicola növekedését a nitrátot elektronakceptorként használó kultúrákban a poliszulfidhoz képest serkenteni kell.
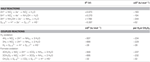
Táblázat. A reakció kiszámított szabad energiái standard körülmények között (1 M minden faj, 25°C és pH = 7) a nitrogénvegyületek és a poliszulfid elektronakceptor félreakcióira, valamint a csatolt reakciókra, amelyekben a formiát vagy a hidrogén az elektrondonor.
N. profundicola növekedése nitráttal
A N. profundicola korábbi jellemzése és növekedése olyan közeget használt, amely poliszulfidot kombinált kénforrásként és elektronakceptorként tartalmazott (Campbell et al., 2001, 2009; Smith et al., 2008). A nitrátnak a N. profundicola energiaanyagcseréjében betöltött szerepének további tisztázása érdekében az AmH törzset szulfiddal mint egyedüli kénforrással termesztettük, így a nitrát volt az egyedüli elektronakceptor (2. ábra). Az elektrondonor hidrogén és formiát keveréke volt olyan közegben, amelyben nem volt más kén- vagy nitrogénforrás (Campbell és mtsai., 2001). A nitrátot potenciális elektronakceptorként és nitrogénforrásként, valamint szulfidot (kénforrás) vagy poliszulfidot (kénforrás és potenciális elektronakceptor) tartalmazó táptalajon a növekedési sebesség több mint kétszerese volt az ammóniumot egyedüli nitrogénforrásként és poliszulfidot elektronakceptorként és kénforrásként használó kultúrákban megfigyelt növekedési sebességnek. A várakozásoknak megfelelően az ammóniummal mint nitrogénforrással és szulfiddal mint kénforrással ellátott negatív kontroll (elektronakceptor nélküli) kultúrák nem tudtak növekedni.
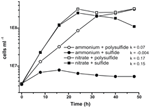
2. ábra. A N. profundicola növekedése a jelzett elektronakceptorokkal, nitrogénvegyületekkel és kénforrásokkal. A növekedési sebességeket 8 és 24 óra között határoztuk meg; k = fajlagos növekedési sebességállandó (h-1). Minden pont 2 vagy 3 független biológiai ismétlés átlaga.
Nitrogénegyensúly a N. profundicola kultúrákban
Az N. profundicola által termelt ammónium szintjének a bioszintetikus szükségletet meghaladó voltának megerősítésére a bioszintetikus nitrogénigényt a következőképpen számoltuk ki. Feltételezve, hogy az exponenciálisan növekvő bakterioplankton C:N aránya 32:6,4 (Vrede et al., 2002), 288 fg C μm-3 az exponenciálisan növekvő Escherichia coli esetében (Loferer-Krossbacher et al., 1998), és a N. profundicola jelentett méreteiből számított 0,021 μm3 sejttérfogat (Smith et al., 2008), 1 × 108 sejt ml-1 termelése ~120 ng ml-1 N-t igényel (~9 μM), ami a felhasznált N-forrástól függetlenül nem változik. A N. profundicola nem hasznosította a poliszulfiddal mint elektronakceptorral történő növekedés során biztosított ammónium jelentős részét (3. ábra, nyitott körök), ami összhangban van a megfigyelt sejtsűrűségek előállításához számított alacsony N-szükséglettel. Az ammónium plusz szulfid kultúra nem növekedett (2. ábra), és nem is fogyasztott kimutathatóan ammóniumot (3. ábra, zárt körök). Ezzel szemben az 5 mM nitráton nevelt sejtek által termelt ammónium mennyisége poliszulfiddal 4,6 mM, szulfiddal 5,2 mM volt (3. ábra, nyitott és zárt négyzetek). Ha az Epsilonproteobaktériumokban a fordított HURM-útvonal elsősorban a bioszintézishez szükséges ammónium előállítására szolgál, akkor azt várnánk, hogy az alacsony exogén ammóniumszintek erősen elnyomják a HURM-útvonal génexpresszióját és a nitrátredukciós aktivitást. Azonban a nitrátnak a megjósolt N-szükségletet meghaladó sztöchiometrikus átalakulása ammóniává és az ammónium + poliszulfid kultúrákban megfigyelt ammóniumfogyasztás összhangban van azzal a hipotézissel, hogy a nitrátot terminális elektronakceptorként használja a N. profundicola, és a nitrátammonifikációt nem nyomja el az ammónium.
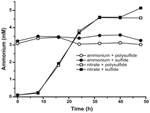
3. ábra. A jelzett elektronakceptorokat, nitrogénvegyületeket és kénforrásokat tartalmazó N. profundicola-kultúrákban mért ammóniumkoncentrációk. Minden pont 2 vagy 3 független biológiai ismétlés átlaga.
15N-NO-3 beépülése a biomasszába
A nitrátasszimilációs potenciált úgy értékeltük, hogy vizsgáltuk a 15N-jelölt ammónium vagy nitrát beépülését a N. profundicola biomasszába az elektrondonorok és potenciális akceptorok minden fenti kombinációjával történő növekedés során. A 20 Atom% 15N-jelölt ammóniummal és poliszulfiddal növesztett N. profundicola egy szakaszos tenyésztési kör után ~10 Atom% 15N-ra feldúsult biomasszát termelt (4. ábra), míg a jelöletlen kontroll nem volt 15N-ban feldúsulva. A szulfiddal és 20 Atom% 15N-jelölt nitráttal termesztett kultúrák 16 Atom% 15N-ra dúsított biomasszát eredményeztek (4. ábra). A nitráton termesztett biomassza körülbelül 5-ször több N-t tartalmazott, mint az ammóniumon termesztett biomassza (az adatok nem láthatóak), ami megmagyarázhatja a nitráton termesztett mintákban a 15N nagyobb mértékű feldúsulását.
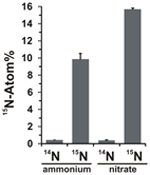
4. ábra. A N. profundicola biomasszába történő nitrogénfelvétel meghatározása egy szakaszos tenyésztési forduló után a jelzett nitrogénvegyületek 5 mM-nyi természetes mennyiségben (14N) vagy 20 Atom% 15N-mal adagolva. Az értékek 3 független biológiai ismétlés átlagai ± a standard eltérés.
A kulcsfontosságú útvonal génjeinek átírása
A N. profundicola javasolt reverz-HURM útvonalának enzimjeit kódoló gének átírási mennyiségét mennyiségi valós idejű PCR segítségével határoztuk meg ammóniummal vagy nitráttal termesztett szakaszos kultúrákban. A javasolt útvonal minden komponense erősen megnövekedett transzkriptbőséget mutatott a nitrátos tenyészetekben (5. ábra). A nitrát-reduktáz alegységet (napA) kódoló mRNS-ek 4,6-szor (P < 0,05, kétfarkú heteroszkedasztikus t-próba) nagyobb mennyiségben voltak jelen a nitrát + szulfiddal tenyésztett sejtekben az ammónium + poliszulfiddal tenyésztett sejtekhez képest. A HURM mindkét komponensének, a haoA és a cycB/napC transzkriptje 8,5-, illetve 7,1-szeresére nőtt (P < 0,05 mindkét esetben). Összhangban azzal az előrejelzésünkkel, hogy a HURM által a periplazmában termelt hidroxilamint a fő facilitátor fehérje csatornákon keresztül szállítják, az ammónium/metil-ammónium transzporter amtB mindkét homológját kódoló mRNS-ek 4,5-szeresére (amtB-1, NAMH_0397, P < 0,08) és 10,3-szorosára (amtB-2, NAMH_0215, P > 0,10) nőttek. A hidroxilamin erős mutagén, amelyet a citoplazmába jutva detoxifikálni kell. Azt javasoljuk, hogy ezt a NADH-függő Har/Hcp végzi, a Rhodobacter capsulatus E1F1 nitrátasszimilációs génklaszterében található hcp gén vizsgálatai alapján, ahol a citoplazmatikus asszimilációs nitrátreduktáz által termelt hidroxilamin redukciójához és asszimilációjához szükséges (Cabello és mtsai., 2004; Pino és mtsai., 2006). Ezzel a javaslattal összhangban a legnagyobb transzkriptabőség-változást a har esetében tapasztaltuk, amely 11,7-szeresére nőtt, de ez a változás nem volt szignifikáns (P > 0,10) a har transzkriptabőség független méréseinek nagyfokú változékonysága miatt. Eredetileg azt javasoltuk, hogy a har elektrondonorja egy NADH-dehidrogenáz, amelyet a NAMH_0542 kódol (Campbell et al., 2009). Most azonban úgy gondoljuk, hogy más Epsilonproteobaktériumokban való konzerváltság alapján jobb jelölt erre a funkcióra a NAMH_1302, egy előre jelzett 4Fe-4S klaszterfehérje (1. táblázat). Ezzel a predikcióval összhangban a NAMH_1302 transzkriptumai 4,6-szor nagyobb mennyiségben fordultak elő nitrátos sejtekben az ammóniumhoz képest, de a változás nem volt szignifikáns (P > 0,10).
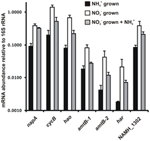
5. ábra. A reverz-HURM útvonal enzimjeit kódoló kulcsgének stabil állapotú mRNS-szintjei ammónium + poliszulfiddal (fekete sávok), nitrát + szulfiddal (fehér sávok) vagy nitrát + poliszulfiddal termesztett N. profundicola-ban ammónium hozzáadása után. A transzkriptek mennyiségét fluoreszcens RT-PCR segítségével határoztuk meg, és az egyes mintákban meghatározott 16S rRNS mennyiségére normalizáltuk. Az értékek 3 független biológiai ismétlés átlagai ± a standard eltérés.
Az útvonal expressziójának esetleges ammónium-repressziójának vizsgálatához ammóniumot adtunk nitrát + szulfiddal növesztett kultúrákhoz, és ugyanezen gének mRNS-mennyiségét számszerűsítettük. Általánosságban elmondható, hogy az ammónium hozzáadása 1,2- és 3,6-szeresére csökkentette a reverz HURM-útvonalat kódoló gének mRNS-bőségét (5. ábra, szürke sávok), bár ez a hatás csak a HURM alegységeket kódoló haoA és napC/cycB transzkriptumok esetében volt szignifikáns (P < 0,10). Érdekes módon a napA expressziója csökkent a legkevésbé (1,2-szeresére), ami a nitrátlégzés szükségességét jelzi ezekben a sejtekben. Az ammónium hozzáadása egyetlen esetben sem csökkentette a transzkriptumok szintjét az ammónium + poliszulfidban nevelt kultúrákban tapasztalt szintre.
bizonyíték egy hidroxilamin intermedierre
A hidroxilamin közvetlen mérései nitráttal nevelt N. profundicola kultúrák szűrletében alacsony, de következetesen kimutatható hidroxilamin-szintet találtak (5,7 ± 3,5 μM, SD, n = 3). Ez az alacsony szint összhangban van egy olyan köztitermékkel, amelynek termelési és fogyasztási sebessége szorosan illeszkedik egymáshoz.
Az N. profundicola által metabolizálható-e a hidroxilamin, nitrátban nevelt sejtek mosott szuszpenzióit nitrátmentes táptalajban inkubáltuk, ahol a hidrogén volt az egyetlen elektrondonor. Potenciális elektronakceptorként hidroxilamint adtunk hozzá, és mind a hidroxilamin, mind az ammónium koncentrációját idővel követtük. A kísérlet eredményei azt mutatják, hogy a N. profundicola nitrátban nevelt sejtjei a hidroxilamint gyorsan és teljesen átalakítják ammóniává (6. ábra). A hidroxilamin átalakulásának fajlagos sebessége ebben a kísérletben 28,6 μM min-1 108 sejt-1 volt. A 3. ábrán látható exponenciális növekedésre (8-24 óra) számított nitrátból történő ammóniumtermelés sebessége ~3 μM min-1 (108 sejt)-1. Így a mért hidroxil-amin konverziós ráta messze meghaladja a N. profundicola nitráttal történő növekedése során megfigyelt ammóniumtermelés mértékét. Hasonlóan szoros kapcsolatról számoltak be a hidroxil-amin termelés és eltávolítás között a közelmúltban a kemolitotróf ammónia-oxidáló archeon, a Nitrosopumilus maritimus esetében, ahol a hidroxil-amin oxidáció egy lényeges katabolikus lépés (Vajrala et al., 2013).
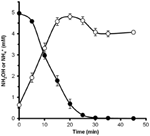
6. ábra. A hidroxilamint a N. profundicola gyorsan átalakítja ammóniummá. A hidroxilamin (zárt körök) és az ammónium (nyitott körök) koncentrációját követtük, miután 5 mM hidroxilamint adtunk nyugalmi sejtszuszpenzióhoz. A pontok három ismétlés átlagértékei ± a standard eltérés.
Diszkusszió
Az itt bemutatott adatok összhangban vannak a nitrátredukció egy új útvonalával olyan szervezetekben, amelyekből hiányoznak a klasszikus NO-képző (NirS vagy NirK) vagy ammóniumképző (NirB/NirA) nitritreduktázok, a N. profundicola törzs AmH mint hasznos modellrendszer. Egy fordított HURM útvonalat javasoltak, amelynek során a nitrit a periplazmában hidroxilaminná redukálódik, majd a citoplazmában ammóniumra redukálódik (Campbell és mtsai., 2009). Az eredeti útvonalat itt kissé módosítottuk, hogy a Har/Hcp proximális elektrondonorának egy valószínűbb jelöltjét, a NAMH_1302 által kódolt, 4Fe-4S-t tartalmazó fehérjét (1. ábra) bevegyük. A NAMH_1302 homológjai konzerválódtak a C. concisusban (GenBank hozzáférés: YP_001466207), a C. curvusban (YP_001408944), a C. fetusban (YP_892678) és a C. mediatlanticusban (ZP_01871213), amelyek rendelkeznek a reverz-HURM útvonal minden más génjével. Ezen kívül a NAMH_1302 transzkriptumbőség növekedést mutatott a nitráton termesztett N. profundicola sejtekben az ammóniumhoz képest.
Míg a hidroxilamin előállítása nitrátból és nitritből mind kémiai (Rollefson és Oldershaw, 1932), mind biológiai úton (Lindsey és Rhines, 1932) régóta ismert, és egy 3 komplexről kimutatták, hogy redukálószerrel ellátva a nitritet hidroxilaminná redukálja (Kostera et al., 2010), a hidroxilamin vs. nitritből történő ammóniumtermelés aránya a fordított HURM-útvonalban még nem tisztázott. Az extracelluláris hidroxilamin baktériumok általi felvétele ismert; az exogén módon adagolt hidroxilamin könnyen felhalmozódik a Kuenenia stuttgartiensis anammoxoszómájában (Lindsay et al., 2001; Schmidt et al., 2004), amely kompartment csak a sejt- és az anammoxoszómamembránon való átjutással érhető el. Az erősen mutagén hidroxilamin javasolt felvétele szükségessé teszi a DNS-léziók elleni védelmet, ami részben magyarázatot adhat a N. profundicola-ban azonosított DNS-javító rendszerek kiterjedt komplementerére (Campbell és mtsai., 2009). A hidroxil-amint a növényekben és algákban a nitritből történő ammóniumtermelés intermedierjeként is javasolták, mivel a ferredoxin-függő nitrit-reduktáz nagy reaktivitást és specificitást mutat erre a szubsztrátra (Kuznetsova et al., 2004; Hirasawa et al., 2010).
A HURM ammónia-oxidálókban lévő kinon-reduktáz funkciójától eltérően (Klotz és Stein, 2008; Simon és Klotz, 2013), azt javasoljuk, hogy a HURM a N. profundicolában az NrfAH-hoz hasonlóan periplazmatikus kinol-oxidáz rendszerként működik, amely elektronokat szállít a kinol-poolból a nitrit hidroxilaminná történő redukciójához. Valószínű, hogy a fordított HURM-útvonal az NrfAH és az ONR ammonifikációs modul közös őséből fejlődött ki az anammox baktériumokban. Feltételezésünk szerint ez még azelőtt történt, hogy a HURM – beleértve egy kovalensen kötött trimer HaoA komplexet, amely képes a hidroxilamin disproporciójára – katabolikus modulként működött volna mind az anaerob, mind az aerob ammónia-oxidáló baktériumokban (Jetten és mtsai., 2009; Klotz és Stein, 2010; Campbell és mtsai., 2011; Kern és mtsai., 2011; Simon és Klotz, 2013). Az NO-redukáló citokróm c’-béta (cytS) és az NO-oxidáló citokróm P460 (cytL) esetében is hasonló, kovalens kötésvezérelt komplexképzéssel megvalósuló funkcióváltást tárgyaltak a redukáló aktivitásról az oxidálóra (Elmore és mtsai., 2007). Az NrfAH és a reverz-HURM modulokat kódoló gének csak egyetlen bakteriális genomszekvenciában, a C. fetus 82-40-ben léteznek együtt (1. táblázat). A közelmúltban kimutatták, hogy az oktahem citokróm c hidroxilamin-dehidrogenáz egy többhemes citokróm c fehérje szupercsalád tagjaként fejlődött ki, amelynek funkciói a nitrogén- és kénciklusban vannak, és hogy a citokróm cM552 (CycB), NrfH és NapC egy másik citokróm c szupercsalád tagjai (Bergmann et al., 2005; Klotz és Stein, 2008; Kern et al., 2011; Simon és Klotz, 2013). Az is ismert, hogy az Epsilonproteobaktériumok NAP-komplexei általában nem tartalmaznak NapC alegység fehérjéket (Klotz és mtsai., 2006; Sievert és mtsai., 2008; Kern és Simon, 2009; Klotz és Stein, 2010; Simon és Klotz, 2013). Az n-cM552 (CycB/NapC) komplex javasolt fordított funkciója nitrit-reduktáz-kinol-oxidáz komplexként megvalósítható, tekintettel mindkét transzkriptum jelenlétére és a N. profundicola HaoA kritikus tirozin fehérje ligandumának hiányára (Campbell et al., 2009), amelyek elválasztják az N-oxid redukáló NrfA és ONR komplexeket az N-oxid oxidáló HAO komplexektől (Bergmann és mtsai., 2005; Klotz és Stein, 2008; Kern és mtsai., 2011; Simon és Klotz, 2013).
A 15N asszimilációs adatok megállapították, hogy a N. profundicola a növekedés során nitrát-nitrogént épít be a biomasszába, ha azt egyedüli nitrogénforrásként biztosítják. Ugyanakkor a nitrátból származó ammóniumnak a bioszintézis számított igényeit meghaladó hatalmas többlettermelése arra enged következtetni, hogy a nitrát ammóniumra történő redukciójának elsődleges funkciója a N. profundicola számára a hatékony légzési elektronakceptor funkciója. Ezt a következtetést alátámasztja a nitrátot egyedüli elektronakceptorként használó N. profundicola-kultúrák megnövekedett növekedési rátája és hozama. Továbbá a génexpressziós adatok megegyeznek azzal a javaslatunkkal (Campbell et al., 2009), hogy ez a Nap, a HURM (3 és cM552) és a Har/Hcp összehangolt működésén keresztül történik, mint egy új N-asszimilációs és energiatakarékossági útvonal: a fordított HURM útvonal. Végül az adatok azt mutatják, hogy a N. profundicola képes a hidroxilamint gyorsan ammóniumra redukálni, ami összhangban van a szabad hidroxilaminra mint a fordított-HURM útvonal köztes termékére vonatkozó javaslattal. A hidroxilamin felvételének megfigyelt magas sebessége valószínűleg megmagyarázza, hogy miért nem figyelhető meg következetesen a nitráton történő tenyészetek növekedése során. A nyugalmi sejtekben nitrátból vagy nitritből történő ammóniumtermelés előzetes mérései hasonlóak a tenyészetekből számított 3 μM min-1 (108 sejt)-1 sebességhez, ami ~10-szer alacsonyabb, mint a megfigyelt hidroxilamin-fogyasztási sebesség. Ezeket az arányokat figyelembe véve a hidroxilaminnak a nitráton növő tenyészetekben a termelés után azonnal el kell fogynia. Mivel a hidroxilamin mutagén, feltételezzük, hogy ez azt a korábbi szelekciós nyomást tükrözi, hogy a növekedés során alacsony hidroxilamin-szintet tartsanak fenn.
Míg a biomassza 15N-NH2OH-val történő jelölését megkísérelték N. profundicola tételes tenyészetekben, ez még nem volt sikeres (az adatok nem láthatóak). Tekintettel arra, hogy a hidroxilamint a tételes tenyészetben a toxicitás elkerülése érdekében a nem jelölt nitráthoz képest alacsony koncentrációban kell adagolni, és hogy a hidroxilaminból származó N túlnyomó többségének ammóniává kell átalakulnia (>90% a 3. ábra alapján), ez az eredmény nem meglepő. Rövid távú címkézési kísérletek sokkal nagyobb koncentrációjú címkézett hidroxilaminnal mint egyedüli N-forrással véglegesen megállapíthatják ezt a pontot.
Végeredményben az itt bemutatott adatok összhangban vannak egy olyan modellel, amelyben a N. profundicola a nitrátot egy szabad hidroxilamin intermedier segítségével redukálja. Ezek a kísérletek még nem zárják ki teljesen annak lehetőségét, hogy a N. profundicolában javasolt reverz-HURM aktivitás egy ammóniumképző nitrit reduktázként működik, amely 6 elektront ad át N-oxid intermedier felszabadítása nélkül. Nem publikált eredmények azt mutatják, hogy az nrfA gén néhány pontmutációja a pentahem citokróm c nitrit reduktázt egy szivárgó enzimmé teheti, amely N-oxid intermediereket szabadít fel, és nem alakítja át a nitritet sztöchiometrikusan ammóniumra (Jörg Simon, pers. communi.). Tekintettel az nrfA és a haoA közötti evolúciós kapcsolatra (Bergmann és mtsai., 2005; Simon és Klotz, 2013), a N. profundicola fordított HURM modulja természetes módon ammóniumot és hidroxilamint termelő enzimkomplexként működhet, míg az extant NrfA “szivárgásmentesen”, ammóniumot termelő nitritreduktázként működik. A Har/Hcp nitrátot vagy nitritet mint szubsztrátot tartalmazó inhibitorokkal végzett további kísérletek egész sejtekben és/vagy a fordított-HURM komplex biokémiai vizsgálatai az in vitro termék meghatározására további közvetlen teszteket fognak biztosítani erre a hipotézisre. Függetlenül a konkrét mechanizmustól, a N. profundicola bioszintetikus szükségleteit messze meghaladó mértékű ammóniumtermelése arra utal, hogy ez és a rokon Epsilonproteobaktériumok ökológiai szerepet tölthetnek be ammóniumforrásként a nitrátban gazdag, ammóniumhiányos, hipoxiás környezetben, ahol gyakran előfordulnak.
Anyagok és módszerek
Szabadenergia-számítások
A Gibbs-féle szabad energiákat (2. táblázat) a félreakciók standard redoxpotenciáljaiból a Nernst-egyenlet (Δ G0 = -nFE0) vagy az irodalomból gyűjtött félreakciós szabad energiák összegzésével számoltuk (Thauer et al, 1977; van der Star et al., 2008). Minden számítást standard körülmények között végeztünk (1 M minden faj, 25°C, pH = 7).
Kultiválás és nitrogénvegyületek elemzése
A N. profundicola törzs AmH (ATCC BAA-1463) tenyésztése és a sejtek számolása a korábban leírtak szerint történt (Smith et al., 2008; Campbell et al., 2009). A tenyésztési felülúszókban lévő ammóniumot danzil-kloriddal történő deriválás és fluoreszcens detektálással ellátott HPLC-vel történő elválasztás után számszerűsítettük (Shakila és mtsai., 2001). A nitrát mennyiségi meghatározása HPLC-vel történt UV/Vis detektálással. A hidroxilamin-koncentrációkat a tenyésztési szűrletekben (0,2 μm) határoztuk meg Frear és Burrell (1955) leírása szerint.
15N jelölési eljárások
A 20 Atom%-os 15N-nitrát és 15N-ammónium törzsoldatokat >99 Atom%-os és természetes bőségű sók keverésével készítettük el, hogy szükség szerint 5 mM nitrát vagy ammónium végkoncentrációjú táptalajt készítsünk. A 15N-jelölt tenyészetekből a sejteket centrifugálással szedtük ki, és a sejtpelletet háromszor mostuk át nanotiszta vízzel a sók eltávolítása érdekében. A sejtszuszpenziót ónkapszulákban szárítottuk, amelyeket a University of California-Davis stabil izotóp laboratóriumába küldtünk, ahol izotóparányos tömegspektrometriával határoztuk meg a 15N atom%-ot. A kontrollminták azt mutatták, hogy a minta feldolgozása során nem történt izotópszennyeződés (az adatok nem láthatóak).
Kvantitatív PCR
Génspecifikus primereket (3. táblázat) használtunk a N. profundicolából kivont teljes RNS mRNS mennyiségének számszerűsítésére a korábban leírtak szerint (Campbell et al, 2009).

3. táblázat. Primerek és feltételek specifikus gének Q-RT-PCR kvantitatív meghatározásához N. profundicolából kivont teljes RNS mintákban.
Hidroxilamin felvétel
A N. profundicola-t H2 és formiát mint elektrondonorokon és nitráton mint egyedüli elektronakceptoron növesztettük a késői exponenciális fázisig. A sejteket centrifugálással szedtük le. Minden transzfert és sejtmosást a Coy Laboratories anaerob kamrájában végeztünk. A sejteket nitrátmentes táptalajjal reszuszpendáltuk ~109 sejt ml-1 végkoncentrációig, és 45°C-on inkubáltuk 2 órán át 80% H2 + 20% CO2 atmoszférában, mielőtt anaerob módon készített törzsoldatból hidroxilamint (5 mM végkoncentráció) adtunk hozzá. A sejtszuszpenzió aliquotjait megszűrtük, és a fent leírtak szerint vizsgáltuk hidroxilaminra, valamint dietil-etoxi-metilén-emalonáttal történő deriválás után HPLC-vel ammóniumra (Gómez-Alonso et al, 2007).
Autor Contributions
Thomas E. Hanson, Barbara J. Campbell és Martin G. Klotz közösen tervezték meg a kísérleteket és értelmezték az eredményeket, Thomas E. Hanson végezte az összes nitrogénvegyület-elemzést és készítette elő a mintákat a tömegspektrometriához, Barbara J. Campbell tenyésztette az összes kultúrát és végezte a mennyiségi PCR-t, Katie M. Kalis végezte a hidroxilamin-felvételi kísérleteket, Mark A. Campbell azonosította a NAMH_1302-t mint releváns gént. Thomas E. Hanson fogalmazta meg a cikket, amelyet ezt követően Thomas E. Hanson, Barbara J. Campbell és Martin G. Klotz átdolgozott.
Enyilatkozat az érdekellentétről
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális érdekellentétként értelmezhetők.
Köszönet
A szerzők köszönetet mondanak Lisa Y. Stein (Univ. Alberta-Edmonton), Jenn Macalady (Penn State Univ.), David Kirchman és Matt Cottrell (Univ. Delaware) a kéziratvázlatok kritikus olvasásáért, Jennifer Biddle-nek az anaerob kamrához való hozzáférésért és Kathy Coyne-nak a HPLC-hez való hozzáférésért. Ezt a projektet a Nemzeti Tudományos Alapítvány Barbara J. Campbell és S. Craig Cary (EF-0333203), Barbara J. Campbell (DEB-0640414), Barbara J. Campbell és Thomas E. Hanson (MCB-0950691), valamint Martin G. Klotznak (MCB-0948202/1202648), a Delaware-i Egyetemnek nyújtott EPSCoR RII-2 támogatásból (EPS-0814251), valamint az Észak-Karolinai Egyetem által Martin G. Klotznak nyújtott ösztönző pénzeszközökből.
Kern, M, és Simon, J. (2009). A Wolinella succinogenes és más Epsilonproteobaktériumok légző nitrogénanyagcseréjének elektrontranszportláncai és bioenergetikája. Biochim. Biophys. Acta 1787, 646-656. doi: 10.1016/j.bbabio.2008.12.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lindsey, G. A., and Rhines, C. M. (1932). A hidroxilamin termelése nitrátok és nitritek redukciójával különböző tiszta baktériumtenyészetek által. J. Bacteriol. 24, 489-492.
Pubmed Abstract | Pubmed Full Text
Loferer-Krossbacher, M., Klima, J., and Psenner, R. (1998). A baktériumsejtek száraz tömegének meghatározása transzmissziós elektronmikroszkópiával és denzitometrikus képelemzéssel. Appl. Environ. Microbiol. 64, 688-694.
Pubmed Abstract | Pubmed Full Text