Introduction
Nitraatti on tärkeä kiinteä typpivarasto maailmanlaajuisessa N-kierrossa (Falkowski ja Godfrey, 2008; Klotz ja Stein, 2008). Nitraatti voi pelkistyä denitrifikaation kautta dityppioksidiksi tai dityppikaasuksi, jolloin se häviää maa- ja vesiekosysteemeistä, tai ammonifikaation kautta ammoniumiksi, joka voidaan pidättää (Brandes et al., 2007; Klotz ja Stein, 2008, 2010). Molemmissa reiteissä nitraatti pelkistyy nitriitiksi. Heterotrofisissa denitrifioijissa ja ammoniakin hapettimissa nitriitti pelkistyy edelleen NO:ta muodostavien nitriittireduktaasien avulla: NirS tai NirK. Nitriitin pelkistymistä ammoniumiksi katalysoi assimilatorinen (NirB/NirA) tai respiratorinen (NrfA) ammoniakkia muodostava nitriittireduktaasi (Klotz ja Stein, 2008, 2010). Ammoniakkia hapettavat kemolithotrofit ja metanotrofit voivat muodostaa NO:ta myös hapettamalla hydroksyyliamiinia, joka on toinen mahdollinen typen häviämisreitti maa- ja vesiekosysteemeissä (Campbell et al., 2011). Useat Epsilonproteobakteerit, jotka pystyvät käyttämään nitraattia hengitykseen ja/tai kasvun ainoana typenlähteenä, eivät koodaa kummankaan nitriittireduktaasityypin homologeja, mikä viittaa siihen, että näillä organismeilla on tunnistamaton mekanismi nitriitin pelkistämiseksi ammoniumiksi.
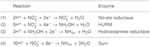
Genomin annotointi osoittaa, että Epsilonproteobakteereihin kuuluvien Nautilia profundicolan lisäksi useat patogeeniset Campylobacter spp. voivat käyttää nitraattia kasvun typenlähteenä ja/tai terminaalisena elektronin akseptorina. N. profundicola kuuluu Epsilonproteobakteerien syvimpään haarautuvaan sukulinjaan (Campbell et al., 2006; Smith et al., 2008), ja sen sukulaisia on löydetty vain syvänmeren hydrotermisistä venttiileistä. Campylobacter spp. sen sijaan liittyy tyypillisesti eläinisäntiin, ja niiden esiintyminen muissa ympäristöissä on puutteellisesti määritelty. Vaikka N. profundicola-, Campylobacter concisus-, C. curvus- ja C. fetus -bakteerien genomit sisältävät geenejä, jotka koodaavat periplasmiseen molybdopteriiniguaniinidinukleotidiin kytkeytyvää nitraattireduktaasikompleksia (NAP), periplasmisesta molybdopteriiniguaniinidinukleotidiin kytkeytynyttä nitraattireduktaasikompleksia (NAP) koodaavia geenejä ei ole. Lisäksi N. profundicolan genomista tunnistettiin napC/cycB-geeni (Campbell ym., 2009), mikä on epätavallista, sillä Epsilonproteobakteerien NAP-kompleksista puuttuu yleensä NapC-proteiini (Kern ja Simon, 2009; Klotz ja Stein, 2010; Simon ja Klotz, 2013). Genomiin perustuvan metabolisen rekonstruktion (Campbell ym., 2009) perusteella ehdotimme hiljattain uutta nitraatin assimilaatioreittiä (kuva 1), jossa nitriitti pelkistyy hydroksyyliamiiniksi hydroksyyliamiini:ubikinoni-redox-moduulin (HURM, eli kinoniriippuvaisen hydroksyyliamiinidehydrogenaasin) avulla, jota kutsumme käänteiseksi HURM-reitiksi. N. profundicolassa HURM:n uskotaan koostuvan NapC/NrfH:hen liittyvästä sytokromi cM552:sta (cycB, NAMH_0559), joka välittää elektroninsiirtoa kinonialtaan ja periplasmisen hydroksyyliamiinioksidoreduktaasin (HAO, NAMH_1280) välillä. HURM, joka toimii eteenpäin ja koostuu hydroksyyliamiinidehydrogenaasista (EC:1.7.2.6; HaoA3), joka on yhdistetty sytokromi c -proteiinin elektronisukkulaan (c554 ja/tai cM552, jota koodaavat vastaavasti cycA ja cycB), yhdistää hydroksyyliamiinin hapettumisen kinonialtaaseen aerobisissa ammoniakkia hapettavissa bakteereissa (Klotz ja Stein, 2008; Simon ja Klotz, 2013). Anaerobisissa ammoniakkia hapettavissa (anammox) bakteereissa redox-moduuli koostuu hydratsiinioksidoreduktaasista ja toistaiseksi tunnistamattomasta sytokromi c:stä (Jetten ym., 2009; Simon ja Klotz, 2013). Käänteisessä HURM-reitissä periplasmassa nitriitistä syntyvä hydroksyyliamiini kuljetetaan sytoplasmaan ja pelkistetään ammoniumiksi hydroksyyliamiinireduktaasin, joka tunnetaan myös hybridiklusteriproteiinina (Har/Hcp). Näin ollen käänteisen HURM-reitin ehdotetut elektronia hyväksyvät reaktiot ovat:
KUVIO 1
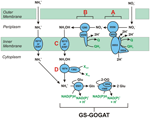
KUVIO 1. HURM-reitin elektronia hyväksyvät reaktiot. Käänteinen HURM-reitti N. profundicolassa. Yksittäiset vaiheet on merkitty kuvassa isoilla kirjaimilla. Kuvattujen proteiinien numerot viittaavat AmH-genomin lokustunnisteisiin (esim. 1280 = NAMH_1280 = HaoA). (A) Nitraatin pelkistäminen hengitysperiplasmisen nitraattireduktaasin (NapABGH, 0556-53) avulla, (B) HURM (Hydroxylamine:Ubiquinone Redox Module), joka koostuu käänteisesti toimivasta hydroksyyliamiinin oksidoreduktaasista (HaoA, 1280), joka toimii okataemi-nitriittireduktaasina ja tuottaa hydroksyyliamiinia NapC/NrfH/cM552-perheen (CycB, 0559) tetrahemi-sytokromi c:n luovuttamien elektronien avulla. (C) Hydroksyyliamiinin kuljetus AmtB:hen liittyvien ammoniakkikuljettajien kautta. (D) Hydroksyyliamiinin pelkistyminen ammoniumiksi hybridi-klusteriproteiini/hydroksyyliamiinireduktaasin (Hcp/Har, 1074) avulla, joka käyttää pelkistävää voimaa ennustetusta Fe-S:ää sisältävästä proteiinista (1302), jonka elektronin luovuttaja (X) on toistaiseksi tuntematon. Ammoniumin assimilaatio biomassaan tapahtuu glutamiinisyntetaasin ja glutamiini:2-oksoglutaraattiaminotransferaasin (GS-GOGAT) välityksellä.
N. profundicolan, C. concisusin, C. curvusin, C. fetus ja Caminibacter mediatlanticus sisältävät kukin geenit, jotka koodaavat käänteisen HURM-reitin entsyymejä, kun taas muiden Epsilonproteobakteerien genomit koodaavat klassisen NO:ta muodostavan NirS/NirK:n ja ammoniumia muodostavan assimilaatiokykyisen sirohemin NirA:n tai respiratorisen pentahemin NrfA:n nitriittireduktaasien homologeja . Oletamme, että käänteinen HURM-reitti parantaa N. profundicola- ja Campylobacter spp. -bakteerien selviytymistä ja/tai leviämistä ammoniumpuutteisessa isäntäympäristössä tai muussa kuin isäntään liittyvässä ympäristössä. Jotta tämä hypoteesi pitäisi paikkansa, käänteisen HURM-reitin on kuitenkin tarjottava ammoniumia biosynteesiä varten ja/tai helpotettava energiansäästöä näissä organismeissa.

TAULUKKO 1. 2001; Smith et al., 2008). Laskelmat vakio-olosuhteissa (1 M kaikkia lajeja, 25 °C, pH = 7) osoittavat, että kun nitraatti pelkistyy käänteisen HURM-reitin reaktioilla, Gibbsin vapaa energia (Δ G°) on huomattavasti suurempi kuin polysulfidin pelkistymisestä saatava energia (taulukko 2). Esimerkiksi Δ G° nitraatilla hapetettua formiaatti-moolia kohti on 7,4-kertainen verrattuna polysulfidiin (-237 kJ mol-1 vs. -32 kJ mol-1). Tämän laskelman perusteella voidaan ennustaa, että N. profundicolan kasvun pitäisi stimuloitua viljelmissä, joissa elektroniakseptorina on nitraatti verrattuna polysulfidiin.
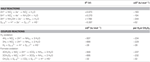
Table 2. Lasketut vapaat reaktioenergiat vakio-olosuhteissa (1 M kaikki lajit, 25 °C ja pH = 7) typpiyhdisteiden ja polysulfidin elektroniakseptoiville puolireaktioille ja kytketyille reaktioille, joissa elektronin luovuttajana on formiaatti tai vety.
N. profundicolan kasvu nitraatilla
N. profundicolan aiempi karakterisointi ja kasvu hyödynsivät väliaineita, joissa oli polysulfidia yhdistettynä rikkilähteenä ja elektroniakseptorina (Campbell et al., 2001, 2009; Smith et al., 2008). Nitraatin roolin selvittämiseksi tarkemmin N. profundicolan energia-aineenvaihdunnassa kantaa AmH kasvatettiin sulfidilla ainoana rikkilähteenä siten, että nitraatti oli ainoa elektronin akseptori (kuva 2). Elektronin luovuttajana oli vedyn ja formiaatin seos väliaineessa, jossa ei ollut muita rikin tai typen lähteitä (Campbell et al., 2001). Kasvunopeudet, joissa nitraatti oli potentiaalinen elektroniakseptori ja typpilähde ja sulfidi (rikkilähde) tai polysulfidi (rikkilähde ja potentiaalinen elektroniakseptori), olivat yli kaksinkertaiset verrattuna kasvunopeuksiin, joita havaittiin viljelmissä, joissa käytettiin ammoniumia ainoana typpilähteenä ja polysulfidia elektroniakseptorina ja rikin lähteenä. Odotetusti negatiiviset kontrolliviljelmät (ei elektroniakseptoria), joille annettiin ammoniumia typen lähteenä ja sulfidia rikin lähteenä, eivät pystyneet kasvamaan.
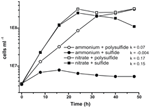
Kuvio 2. Viljelmät, joille annettiin ammoniumia typen lähteenä ja sulfidia rikin lähteenä. N. profundicolan kasvu ilmoitetuilla elektroniakseptoreilla, typpiyhdisteillä ja rikkilähteillä. Kasvunopeudet määritettiin 8 ja 24 tunnin välillä; k = spesifinen kasvunopeusvakio (h-1). Kukin piste on 2 tai 3 riippumattoman biologisen toiston keskiarvo.
Typpitasapaino N. profundicola -viljelmissä
Vahvistaaksemme, että N. profundicolan tuottaman ammoniumin määrä ylitti biosynteettisen tarpeen, laskimme biosynteettisen typen tarpeen seuraavasti. Olettaen, että eksponentiaalisesti kasvavan bakteeriplanktonin C:N-suhde on 32:6,4 (Vrede et al., 2002), eksponentiaalisesti kasvavan Escherichia colin 288 fg C μm-3 (Loferer-Krossbacher et al.., 1998) ja N. profundicola -bakteerin raportoitujen mittojen perusteella laskettu solutilavuus 0,021 μm3 (Smith et al., 2008), 1 × 108 solun ml-1 tuottaminen vaatii ~120 ng ml-1 N:ää (~9 μM), mikä luku ei muuttuisi käytetystä N-lähteestä riippumatta. N. profundicola ei käyttänyt merkittävää määrää ammoniumista, jota annettiin kasvun aikana, kun elektroniakseptorina oli polysulfidi (kuva 3, avoimet ympyrät), mikä vastaa havaittujen solutiheyksien tuottamiseksi laskettua pientä N-tarvetta. Ammonium plus sulfidi -viljelmä ei kasvanut (kuva 2) eikä myöskään käyttänyt havaittavasti ammoniumia (kuva 3, suljetut ympyrät). Sen sijaan 5 mM nitraatilla kasvatettujen solujen tuottama ammoniummäärä oli 4,6 mM polysulfidin kanssa ja 5,2 mM sulfidin kanssa (kuva 3, avoimet ja suljetut neliöt). Jos Epsilonproteobakteerien käänteinen HURM-reitti palvelee ensisijaisesti ammoniumin tuottamista biosynteesiä varten, odottaisimme, että alhaiset eksogeenisen ammoniumin määrät tukahduttaisivat voimakkaasti HURM-reitin geeniekspressiota ja nitraatin pelkistysaktiivisuutta. Nitraatin stoikiometrinen muuntuminen ammoniumiksi yli ennustetun N-tarpeen ja havaittu ammoniumin kulutus ammonium + polysulfidiviljelmissä on kuitenkin sopusoinnussa sen hypoteesin kanssa, että N. profundicola käyttää nitraattia terminaalisena elektronin akseptorina ja että nitraattiammonifikaatio ei repressioidu ammoniumin vaikutuksesta.
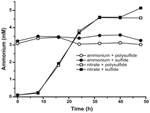
KUVA3. Ammoniumpitoisuudet mitattuna N. profundicola -viljelmissä, jotka sisältävät ilmoitettuja elektroniakseptoreita, typpiyhdisteitä ja rikinlähteitä. Kukin piste on kahden tai kolmen riippumattoman biologisen toistokerran keskiarvo.
15N-NO-3:n liittyminen biomassaan
Nitraatin assimilaatiopotentiaalia arvioitiin tarkastelemalla 15N-merkityn ammoniumin tai nitraatin liittymistä N. profundicola -biomassaan kaikkien edellä mainittujen elektroninluovuttajien ja potentiaalisten akseptoreiden kaikkien yllämainittujen elektroninluovuttaja- ja potentiaalisten akseptorikombinaatioiden kanssa tapahtuvan kasvun aikana. N. profundicola, jota kasvatettiin 20 Atom-% 15N-merkityllä ammoniumilla ja polysulfidilla, tuotti biomassaa, joka oli rikastunut ~10 Atom-% 15N:iin yhden eräkasvatuskierroksen jälkeen (kuva 4), kun taas merkitsemätön kontrolli ei ollut rikastunut 15N:n suhteen. Sulfidilla ja 20 Atom-% 15N-merkityllä nitraatilla kasvatetut viljelmät tuottivat biomassaa, joka oli rikastunut 16 Atom-% 15N:ään (kuva 4). Nitraatilla kasvatettu biomassa sisälsi noin 5-kertaisesti enemmän N:ää kuin ammoniumilla kasvatettu biomassa (tietoja ei ole esitetty), mikä saattaa selittää 15N:n laajemman rikastumisen nitraatilla kasvatetuissa näytteissä.
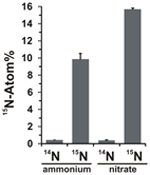
KUVIO 4. Nitraatilla kasvatettu biomassa. Typen otto N. profundicola -biomassaan määritettynä yhden eräkasvatuskierroksen jälkeen, kun 5 mM ilmoitettuja typpiyhdisteitä annettiin luonnollisena runsautena (14N) tai 20 Atom-% 15N:nä. Arvot ovat kolmen riippumattoman biologisen toistokerran keskiarvoja ± keskihajonta.
Keskeisten reittigeenien transkriptio
N. profundicolan ehdotetun käänteisen HURM-reitin entsyymejä koodaavien geenien transkriptioiden runsaus määritettiin kvantitatiivisella reaaliaikaisella PCR:llä eräviljelmissä, joita kasvatettiin ammoniumin tai nitraatin kanssa. Kaikkien ehdotetun reitin komponenttien transkriptioiden runsaus lisääntyi voimakkaasti nitraatilla kasvatetuissa viljelmissä (kuva 5). mRNA:t, jotka koodaavat nitraattireduktaasin alayksikköä (napA), olivat 4,6-kertaisesti (P < 0,05, kahden hännän heteroskedastinen t-testi) yleisempiä nitraatti + sulfidi -viljelmällä kasvatetuissa soluissa kuin ammonium + polysulfidi -viljelmällä. HURM:n molempien komponenttien, haoA:n ja cycB/napC:n, transkriptiot lisääntyivät vastaavasti 8,5- ja 7,1-kertaisiksi (P < 0,05 molemmille). Yhdenmukaisesti ennusteemme kanssa, jonka mukaan HURM:n periplasmassa tuottama hydroksyyliamiini kuljetettaisiin suurten fasilitaattoriproteiinikanavien kautta, mRNA:t, jotka koodaavat ammonium/methylammoniumkuljettajan amtB:n molempia homologeja, lisääntyivät 4,5-kertaisiksi (amtB-1, NAMH_0397, P < 0,08) ja 10,3-kertaisiksi (amtB-2, NAMH_0215, P > 0,10). Hydroksyyliamiini on voimakas mutageeni, joka on detoksifioitava sen saapuessa sytoplasmaan. Ehdotamme, että tämä tapahtuu NADH-riippuvaisen Har/Hcp:n avulla, mikä perustuu Rhodobacter capsulatus E1F1:n nitraattiassimilaation geeniryhmään kuuluvan hcp-geenin tutkimuksiin, joissa sitä tarvitaan sytoplasman assimilatorisen nitraattireduktaasin tuottaman hydroksyyliamiinin pelkistämiseen ja assimilaatioon (Cabello et al., 2004; Pino et al., 2006). Tämän ehdotuksen mukaisesti suurin muutos transkriptien määrässä havaittiin har:n kohdalla, joka kasvoi 11,7-kertaiseksi, mutta tämä muutos ei ollut merkitsevä (P > 0,10), koska har:n transkriptien määrän riippumattomien mittausten välinen vaihtelu oli suurta. Alun perin olimme ehdottaneet, että harin elektronin luovuttaja olisi NADH-dehydrogenaasi, jota koodaa NAMH_0542 (Campbell et al., 2009). Nyt kuitenkin uskomme, että parempi ehdokas tähän tehtävään on NAMH_1302, ennustettu 4Fe-4S-klusterin proteiini, joka perustuu konservoitumiseen muissa Epsilonproteobakteereissa (taulukko 1). Tämän ennusteen mukaisesti NAMH_1302:n transkriptiot olivat 4,6-kertaisesti runsaampia nitraattikasvatetuissa soluissa verrattuna ammoniumiin, mutta muutos ei ollut merkitsevä (P > 0,10).
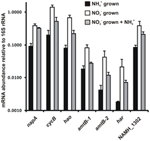
KUVA 5. NAMH_1302:n transkriptiot olivat 4,6-kertaisesti runsaampia nitraattikasvatetuissa soluissa verrattuna ammoniumiin. Käänteisen HURM-reitin entsyymejä koodaavien keskeisten geenien mRNA-tasot vakiintuneessa tilassa N. profundicolassa, jota kasvatettiin ammoniumilla + polysulfidilla (mustat pylväät), nitraatilla + sulfidilla (valkoiset pylväät) tai nitraatilla + polysulfidilla ammoniumin lisäämisen jälkeen. Transkriptien runsaus määritettiin fluoresoivalla RT-PCR:llä ja normalisoitiin kussakin näytteessä määritettyyn 16S rRNA:n määrään. Arvot ovat kolmen riippumattoman biologisen toiston keskiarvoja ± keskihajonta.
Testaamaan polun ilmentymisen mahdollista ammoniumrepressiota lisättiin ammoniumia nitraatti + sulfidi -kasvatettuihin viljelmiin ja mRNA:n runsaus kvantifioitiin samoille geeneille. Yleisesti ottaen ammoniumin lisääminen vähensi käänteistä HURM-reittiä koodaavien geenien mRNA-runsauksia 1,2- 3,6-kertaisesti (kuva 5, harmaat palkit), joskin tämä vaikutus oli merkitsevä (P < 0,10) vain HURM-alayksiköitä koodaavien haoA:n ja napC/cycB:n transkriptien osalta. Mielenkiintoista on, että napA:n ilmentyminen väheni vähiten (1,2-kertaisesti), mikä osoittaa nitraattihengityksen tarvetta näissä soluissa. Ammoniumin lisääminen ei missään tapauksessa alentanut transkriptiotasoja samalle tasolle kuin ammonium + polysulfidissa kasvatetuissa viljelmissä.
Todisteet hydroksyyliamiinin välituotteesta
Suorissa hydroksyyliamiinimittauksissa nitraatilla kasvatettujen N. profundicola -viljelmien filtraateissa havaittiin alhaisia, mutta johdonmukaisesti havaittavissa olevia hydroksyyliamiinipitoisuuksia (5,7 ± 3,5 μM, SD, n = 3). Tämä alhainen taso on yhdenmukainen sellaisen välituotteen kanssa, jonka tuotanto- ja kulutusnopeudet ovat hyvin lähellä toisiaan.
Mutta sen määrittämiseksi, voisiko N. profundicola metaboloida hydroksyyliamiinia, nitraatilla kasvatettujen solujen pestyjä suspensioita inkuboitiin nitraatittomassa kasvualustassa, jossa vety oli ainoa elektroninluovuttaja. Hydroksyyliamiinia lisättiin potentiaaliseksi elektroniakseptoriksi, ja sekä hydroksyyliamiinin että ammoniumin pitoisuuksia seurattiin ajan mittaan. Tämän kokeen tulokset osoittavat, että N. profundicolan nitraattikasvatetut solut muuttavat hydroksyyliamiinin nopeasti ja kokonaan ammoniumiksi (kuva 6). Hydroksyyliamiinin spesifinen muuntumisnopeus tässä kokeessa oli 28,6 μM min-1 108 solua-1. Ammoniumin tuotantonopeus nitraatista laskettuna kuvan 3 eksponentiaaliselle kasvulle (8-24 h) on ~3 μM min-1 (108 solua)-1. Näin ollen mitattu hydroksyyliamiinin muuntumisnopeus ylittää reilusti N. profundicolan kasvaessa nitraatin kanssa havaitun ammoniumin tuotantonopeuden. Samanlainen tiukka kytkentä hydroksyyliamiinin tuotannon ja poiston välillä raportoitiin hiljattain kemolithotrofisesta ammoniakkia hapettavasta arkeonista Nitrosopumilus maritimus, jossa hydroksyyliamiinin hapettuminen on olennainen katabolinen vaihe (Vajrala ym., 2013).
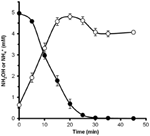
Kuvio 6. Hydroksyyliamiinin hapettuminen. N. profundicola muuttaa hydroksyyliamiinin nopeasti ammoniumiksi. Hydroksyyliamiinin (suljetut ympyrät) ja ammoniumin (avoimet ympyrät) pitoisuuksia seurattiin sen jälkeen, kun levossa olevaan solususpensioon oli lisätty 5 mM hydroksyyliamiinia. On ehdotettu käänteistä HURM-reittiä, jossa nitriitti pelkistyy hydroksyyliamiiniksi periplasmassa ja sen jälkeen pelkistyy ammoniumiksi sytoplasmassa (Campbell et al., 2009). Alkuperäistä reittiä on hieman muutettu tässä yhteydessä siten, että se sisältää todennäköisemmän ehdokkaan Har/Hcp:n proksimaaliseksi elektroninluovuttajaksi, ennustetun 4Fe-4S:ää sisältävän proteiinin, jota koodaa NAMH_1302 (kuva 1). NAMH_1302:n homologit ovat konservoituneet C. concisuksessa (GenBank-tunniste YP_001466207), C. curvuksessa (YP_001408944), C. fetusissa (YP_892678) ja C. mediatlanticusissa (ZP_01871213), joilla on kaikki muut käänteisen HURM-reitin geenit. Lisäksi NAMH_1302:n transkriptioiden runsaus lisääntyi N. profundicola -soluissa, joita kasvatettiin nitraatilla suhteessa ammoniumiin.
Hydroksyyliamiinin tuotanto nitraatista ja nitriitistä sekä kemiallista (Rollefson ja Oldershaw, 1932) että biologista reittiä (Lindsey ja Rhines, 1932) pitkin on tunnettu jo pitkään, ja 3-kompleksin osoitettiin pelkistävän nitriittiä hydroksyyliamiiniksi, kun sitä syötetään pelkistysaineella (Kostera et al., 2010), hydroksyyliamiinin ja ammoniumin tuotannon suhde nitriitistä käänteisessä HURM-reitissä ei ole vielä selvillä. Solunulkoisen hydroksyyliamiinin otto bakteereihin tunnetaan; eksogeenisesti annettu hydroksyyliamiini kerääntyy helposti Kuenenia stuttgartiensis -bakteerin anammoksosomiin (Lindsay et al., 2001; Schmidt et al., 2004), johon pääsee vain ylittämällä sekä solu- että anammoksosomikalvot. Voimakkaasti mutageenisen hydroksyyliamiinin ehdotettu hyväksikäyttö edellyttää suojautumista DNA-vaurioilta, mikä saattaa osittain selittää N. profundicolassa havaittujen DNA:n korjausjärjestelmien laajan valikoiman (Campbell et al., 2009). Hydroksyyliamiinia on ehdotettu myös nitriitistä tapahtuvan ammoniumtuotannon välituotteeksi kasveissa ja levissä, koska ferredoksiini-riippuvaisella nitriittireduktaasilla on korkea reaktiivisuus ja spesifisyys tälle substraatille (Kuznetsova ym., 2004; Hirasawa ym., 2004), 2010).
Toisin kuin HURM:n kinonireduktaasifunktio ammoniakkihapettimissa (Klotz ja Stein, 2008; Simon ja Klotz, 2013), ehdotamme, että N. profundicolassa HURM toimii NrfAH:n tavoin periplasmisena kinolioksidaasijärjestelmänä, joka sukkuloi elektroneja kinolipoolista pelkistääkseen nitriitin hydroksyyliamiiniksi. On todennäköistä, että käänteinen HURM-reitti on kehittynyt anammox-bakteerien NrfAH- ja ONR-ammonifikaatiomoduulin yhteisestä esi-isästä. Oletamme, että tämä tapahtui ennen kuin HURM – mukaan lukien kovalenttisesti sitoutunut trimeerinen HaoA-kompleksi, joka kykenee hydroksyyliamiinin disproportionointiin – käytettiin katabolisena moduulina sekä anaerobisissa että aerobisissa ammoniakkia hapettavissa bakteereissa (Jetten ym., 2009; Klotz ja Stein, 2010; Campbell ym., 2011; Kern ym., 2011; Simon ja Klotz, 2013). Samanlaista kovalenttisten sidosten ohjaaman kompleksinmuodostuksen aikaansaamaa toiminnan kääntymistä pelkistävästä aktiivisuudesta hapettavaan aktiivisuuteen on käsitelty NO:ta pelkistävän sytokromi c’-beetan (cytS) ja NO:ta hapettavan sytokromi P460:n (cytL) osalta (Elmore et al., 2007). NrfAH- ja käänteis-HURM-moduulia koodaavia geenejä esiintyy rinnakkain vain yhdessä bakteerigenomisekvenssissä, C. fetus 82-40:ssä (taulukko 1). Hiljattain osoitettiin, että oktaemi-sytokromi c -hydroksyyliamiinidehydrogenaasi on kehittynyt moniheeminen sytokromi c -proteiinien superperheen jäseneksi, jolla on toimintoja typpi- ja rikkikierrossa, ja että sytokromi cM552 (CycB), NrfH ja NapC ovat toisen sytokromi c -superperheen jäseniä (Bergmann ym., 2005; Klotz ja Stein, 2008; Kern ym., 2011; Simon ja Klotz, 2013). Tiedetään myös, että Epsilonproteobakteerien NAP-kompleksit eivät yleensä sisällä NapC-alayksikön proteiineja (Klotz et al., 2006; Sievert et al., 2008; Kern ja Simon, 2009; Klotz ja Stein, 2010; Simon ja Klotz, 2013). Ehdotettu n-cM552 (CycB / NapC) -kompleksin käänteinen toiminta nitriittireduktaasi-kinolioksidaasikompleksina on toteutettavissa, kun otetaan huomioon molempien transkriptien läsnäolo ja kriittisen tyrosiiniproteiiniligandin puuttuminen N. profundicola HaoA:ssa (Campbell et ai., 2009), jotka erottavat N-oksidia pelkistävät NrfA ja ONR N-oksidia hapettavat HAO-kompleksit N-oksidia hapettavista HAO-komplekseista (Bergmann ym., 2005; Klotz ja Stein, 2008; Kern ym., 2011; Simon ja Klotz, 2013).
15N-assimilaatiotiedoissa todettiin, että N. profundicola sisällyttää nitraattityppeä biomassaan kasvun aikana silloin, kun nitraattityppeä tarjotaan ainoana typenlähteenä. Nitraatista tuotetun ammoniumin valtava ylituotanto biosynteesin laskettuihin tarpeisiin nähden johtaa kuitenkin siihen, että N. profundicolan ensisijainen tehtävä nitraatin pelkistämisessä ammoniumiksi on toimia tehokkaana hengityselektronien akseptorina. Tätä johtopäätöstä tukee N. profundicola -viljelmien kasvuvauhdin ja sadon kasvu, kun nitraatti on ainoa elektronin akseptori. Lisäksi geeniekspressiotiedot vastaavat ehdotustamme (Campbell et al., 2009), jonka mukaan tämä tapahtuu Napin, HURM:n (3 ja cM552) ja Har/Hcp:n yhteistoiminnan kautta uutena N-assimilaatio- ja energiansäästöreittinä: käänteisenä HURM-reittinä. Lopuksi tiedot osoittavat, että N. profundicola kykenee nopeasti pelkistämään hydroksyyliamiinia ammoniumiksi, mikä vastaa ehdotusta, jonka mukaan vapaa hydroksyyliamiini on käänteisen HURM-reitin välituote. Havaittu suuri hydroksyyliamiinin ottonopeus selittää todennäköisesti sen, miksi sitä ei havaita johdonmukaisesti nitraattiviljelmien kasvun aikana. Alustavat mittaukset ammoniumin tuotannosta nitraatista tai nitriitistä lepotilassa olevissa soluissa vastaavat viljelmistä laskettua 3 μM min-1 (108 solua)-1 -nopeutta, joka on ~10-kertaisesti pienempi kuin havaittu hydroksyyliamiinin kulutusnopeus. Kun otetaan huomioon nämä nopeudet, hydroksyyliamiini pitäisi kuluttaa välittömästi tuotannon jälkeen nitraatilla kasvavissa viljelmissä. Koska hydroksyyliamiini on mutageeninen, oletamme, että tämä heijastaa aiempaa valikoivaa painetta ylläpitää alhaisia hydroksyyliamiinipitoisuuksia kasvun aikana.
Biomassan merkitsemistä 15N-NH2OH:lla on yritetty tehdä N. profundicola -eräkasvattamoissa, mutta se ei ole vielä onnistunut (tietoja ei ole esitetty). Kun otetaan huomioon, että eräkasvatuksessa hydroksyyliamiinia on syötettävä alhaisina pitoisuuksina suhteessa leimaamattomaan nitraattiin myrkyllisyyden välttämiseksi ja että suurin osa hydroksyyliamiinista peräisin olevasta N:stä pitäisi muuntaa ammoniumiksi (>90 % kuvan 3 perusteella), tämä tulos ei ole yllättävä. Lyhytaikaiset leimauskokeet, joissa käytetään paljon suurempia pitoisuuksia leimattua hydroksyyliamiinia ainoana N-lähteenä, voivat lopullisesti vahvistaa tämän seikan.
Johtopäätöksenä voidaan todeta, että tässä esitetyt tiedot ovat sopusoinnussa mallin kanssa, jossa N. profundicola pelkistää nitraattia vapaan hydroksyyliamiinin välituotteen kautta. Nämä kokeet eivät vielä sulje täysin pois sitä mahdollisuutta, että N. profundicolalle ehdotettu käänteinen HURM-aktiivisuus toimii ammoniumia muodostavana nitriittireduktaasina, joka siirtää 6 elektronia vapauttamatta N-oksidi-väliainetta. Julkaisemattomat tulokset viittaavat siihen, että muutama pistemutaatio nrfA-geenissä voi tehdä pentameenisytokromi-c-nitriittireduktaasista vuotavan entsyymin, joka vapauttaa N-oksidivälituotteita eikä pysty muuttamaan nitriittiä stoikiometrisesti ammoniumiksi (Jörg Simon, pers. communi.). Kun otetaan huomioon nrfA:n ja haoA:n välinen evolutiivinen suhde (Bergmann ym., 2005; Simon ja Klotz, 2013), N. profundicolan käänteinen HURM-moduuli saattaa luonnostaan toimia ammoniumia ja hydroksyyliamiinia tuottavana entsyymikompleksina, kun taas olemassa oleva NrfA toimii ”vuotamattomana” ammoniumia tuottavana nitriittireduktaasina. Lisäkokeet, joissa käytetään Har/Hcp:n estäjiä nitraatin tai nitriitin kanssa substraattina kokonaisissa soluissa ja/tai käänteisen HURM-kompleksin biokemiallisia tutkimuksia in vitro -tuotteen määrittämiseksi, tarjoavat lisää suoria testejä tälle hypoteesille. Konkreettisesta mekanismista riippumatta N. profundicolan laaja ammoniumin tuotanto, joka ylittää biosynteettiset tarpeet huomattavasti, viittaa siihen, että sillä ja siihen liittyvillä Epsilonproteobakteereilla voi olla ekologinen rooli ammoniumin lähteenä nitraattirikkaissa, ammoniumin puutteessa olevissa hypoksisissa ympäristöissä, joissa niitä esiintyy yleisesti.
Materiaalit ja menetelmät
Vapaan energian laskelmat
Gibbsin vapaat energiat (taulukko 2) laskettiin puolireaktioiden vakioiduista redox-potentiaaleista Nernstin yhtälön avulla (Δ G0 = -nFE0) tai kirjallisuudesta kerättyjen puolireaktioiden vapaiden energioiden yhteenlaskun avulla (Thauer ym, 1977; van der Star et al., 2008). Kaikki laskelmat tehtiin vakio-olosuhteissa (1 M kaikki lajit, 25 °C, pH = 7).
Viljely ja typpiyhdisteiden analysointi
N. profundicola -kanta AmH (ATCC BAA-1463) kasvatettiin ja solut laskettiin aiemmin kuvatulla tavalla (Smith et al., 2008; Campbell et al., 2009). Viljelyn supernatanttien ammonium kvantifioitiin sen jälkeen, kun se oli johdettu dansyylikloridilla ja erotettu HPLC:llä, jossa oli fluoresenssidetektori (Shakila et al., 2001). Nitraatti kvantifioitiin HPLC:llä käyttäen UV/Vis-detektoria. Hydroksyyliamiinipitoisuudet määritettiin viljelmien suodoksista (0,2 μm) Frearin ja Burrellin (1955) kuvaamalla tavalla.
15N-merkintämenetelmät
Varastoliuokset 20 Atom-%:n 15N-nitraattia ja 15N-ammoniumia valmistettiin sekoittamalla >99 Atom-%:n ja luonnollisen runsauden suoloja väliaineen valmistamiseksi loppupitoisuutena 5 mM:n pitoisuuksina nitraatista tai ammoniumista tarpeen mukaan. Solut kerättiin 15N-merkityistä viljelmistä sentrifugoimalla ja solupelletti pestiin kolme kertaa nanopuhtaalla vedellä suolojen poistamiseksi. Solususpensio kuivattiin tinakapseleissa, jotka lähetettiin Kalifornian Davisin yliopiston stabiilien isotooppien laboratorioon, jossa 15N-atomiprosentti määritettiin isotooppisuhdemassaspektrometrisesti. Kontrollinäytteet osoittivat, että näytteenkäsittelyn aikana ei ollut tapahtunut isotooppikontaminaatiota (tietoja ei ole esitetty).
Kvantitatiivinen PCR
Geenispesifisiä alukkeita (taulukko 3) käytettiin mRNA:n määrän kvantifioimiseksi N. profundicola -bakteerista uutetusta RNA:n kokonaismassasta aiemmin kuvatulla tavalla (Campbell et al., 2009).

TAULUKKO 3. Alukkeet ja olosuhteet spesifisten geenien Q-RT-PCR-kvantifiointia varten N. profundicolasta uutetuissa RNA:n kokonaisnäytteissä.
Hydroksyyliamiinin otto
N. profundicolaa kasvatettiin H2:lla ja formiaatilla elektronien luovuttajina ja nitraatilla ainoana elektronien akseptorina myöhäisempään eksponentiaalivaiheeseen asti. Solut kerättiin sentrifugoimalla. Kaikki siirrot ja solujen pesut tehtiin Coy Laboratoriesin anaerobikammiossa. Solut resuspendoitiin nitraatittomalla kasvualustalla loppupitoisuuteen ~109 solua ml-1 ja inkuboitiin 45 °C:ssa 2 tuntia ilmakehässä, jossa oli 80 % H2 + 20 % CO2, ennen hydroksyyliamiinin (5 mM:n loppupitoisuus) lisäämistä anaerobisesti valmistetusta kantaliuoksesta. Solususpension aliquotit suodatettiin ja määritettiin hydroksyyliamiinin osalta edellä kuvatulla tavalla ja ammoniumin osalta HPLC:llä sen jälkeen, kun ne oli derivatisoitu dietyylietoksimetyylimetyleenimalonaatilla (Gómez-Alonso et al., 2007).
Tekijöiden panos
Thomas E. Hanson, Barbara J. Campbell ja Martin G. Klotz suunnittelivat yhdessä kokeet ja tulkitsivat tulokset, Thomas E. Hanson suoritti kaikki typpiyhdisteiden analyysit ja valmisteli näytteet massaspektrometriaa varten, Barbara J. Campbell kasvatti kaikki viljelmät ja suoritti kvantitatiivisen PCR:n, Katie M. Kalis suoritti hydroksyyliamiinin hyväksikäyttökokeet, Mark A. Campbell yksilöi merkityksellisenä geenin NAMH_1302. Thomas E. Hanson laati artikkelin, jonka Thomas E. Hanson, Barbara J. Campbell ja Martin G. Klotz tarkistivat sen jälkeen.
Conflict of Interest Statement
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Tekijät haluavat kiittää Lisa Y. Steinia (Univ. Alberta-Edmonton), Jenn Macaladya (Penn State Univ.), David Kirchmania ja Matt Cottrellia (Univ. Delaware) käsikirjoitusluonnosten kriittisestä lukemisesta, Jennifer Biddleä anaerobikammion saatavuudesta ja Kathy Coynea HPLC:n saatavuudesta. Tätä hanketta on tuettu National Science Foundationin apurahoilla Barbara J. Campbellille ja S. Craig Carylle (EF-0333203), Barbara J. Campbellille (DEB-0640414), Barbara J. Campbellille ja Thomas E. Hansonille (MCB-0950691) sekä Martin G. Klotzille (MCB-0948202/1202648), Delawaren yliopistolle myönnetyllä EPSCoR RII-2 -apurahalla (EPS-0814251) ja Pohjois-Carolinan yliopiston Martin G. Klotzille myöntämillä kannustinvaroilla.
Kern, M., ja Simon, J. (2009). Wolinella succinogenesin ja muiden Epsilonproteobakteerien hengitystyppiaineenvaihdunnan elektroninkuljetusketjut ja bioenergetiikka. Biochim. Biophys. Acta 1787, 646-656. doi: 10.1016/j.bbabio.2008.12.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lindsey, G. A., ja Rhines, C. M. (1932). Hydroksyyliamiinin tuotanto nitraattien ja nitriittien pelkistämisellä eri puhtaiden bakteeriviljelmien toimesta. J. Bacteriol. 24, 489-492.
Pubmed Abstract | Pubmed Full Text
Loferer-Krossbacher, M., Klima, J., and Psenner, R. (1998). Bakteerisolujen kuivamassan määrittäminen läpäisyelektronimikroskopialla ja densitometrisellä kuva-analyysillä. Appl. Environ. Microbiol. 64, 688-694.
Pubmed Abstract | Pubmed Full Text