Introducere
Nitratul este un bazin major de azot fixat în ciclul global al N (Falkowski și Godfrey, 2008; Klotz și Stein, 2008). Nitratul poate fi redus prin denitrificare în protoxid de azot sau în gaz dinitrogen, prin care se pierde din ecosistemele terestre și acvatice, sau prin amonificare în amoniu care poate fi reținut (Brandes et al., 2007; Klotz și Stein, 2008, 2010). În ambele căi, nitratul este redus la nitriți. În denitrificatorii heterotrofi și în cei care oxidează amoniacul, nitriții sunt reduși în continuare de nitriții reductaze care formează NO: NirS sau NirK. Reducerea nitriților la amoniu este catalizată de o nitrit reductază asimilatoare (NirB/NirA) sau respiratorie (NrfA) care formează amoniac (Klotz și Stein, 2008, 2010). Chemolitotrofii și metanotrofii care oxidează amoniacul pot forma, de asemenea, NO prin oxidarea hidroxilaminei, o altă cale potențială de pierdere a azotului în ecosistemele terestre și acvatice (Campbell et al., 2011). Mai multe Epsilonproteobacterii care sunt capabile să utilizeze nitratul pentru respirație și/sau ca sursă unică de azot pentru creștere nu codifică omologi ai niciunui tip de nitrit reductază, ceea ce sugerează că aceste organisme posedă un mecanism nerecunoscut de reducere a nitriților la amoniu.
Anotarea genomului indică faptul că nu numai Nautilia profundicola, ci și mai multe Campylobacter spp. patogene dintre Epsilonproteobacteria pot utiliza nitratul ca sursă de azot pentru creștere și/sau ca acceptor terminal de electroni. N. profundicola este membră a celei mai profunde linii de ramificare a Epsilonproteobacteriilor (Campbell et al., 2006; Smith et al., 2008), iar rudele sale au fost găsite numai în mediile de ventilație hidrotermală din adâncuri. În schimb, Campylobacter spp. sunt de obicei asociate cu gazde animale, iar prezența lor în alte medii este prost definită. În timp ce genomurile lui N. profundicola, Campylobacter concisus, C. curvus și C. fetus conțin gene care codifică un complex de nitrat reductază (NAP) legat de molibdopterină guanină dinucleotidă periplasmatică (NAP), nu există gene care să codifice reductaze ale nitriților care formează amoniu sau NO. În plus, în genomul lui N. profundicola a fost identificată o genă napC/cycB (Campbell et al., 2009), ceea ce este neobișnuit, deoarece complexul NAP din Epsilonproteobacteria nu are, de obicei, o proteină NapC (Kern și Simon, 2009; Klotz și Stein, 2010; Simon și Klotz, 2013). Pe baza reconstrucției metabolice informate de genom (Campbell et al., 2009), am propus recent o nouă cale de asimilare a nitraților (figura 1), prin care nitriții sunt reduși la hidroxilamină de către un modul redox hidroxilamină:ubichinonă (HURM, adică o hidroxilamină dehidrogenază dependentă de chinonă), pe care noi o numim calea inversă-HURM. La N. profundicola, se crede că HURM este alcătuit dintr-un citocrom cM552 (cycB, NAMH_0559) legat de NapC/NrfH, care mediază transferul de electroni între rezerva de chinonă și o hidroxilamină oxidoreductază periplasmatică (HAO, NAMH_1280). HURM, care funcționează în direcția înainte și constă în hidroxilamină dehidrogenază (EC:1.7.2.6; HaoA3) conectată la un transfer de electroni al proteinei citocrom c (c554 și/sau cM552 codificate de cycA și, respectiv, cycB), face legătura între oxidarea hidroxilaminei și bazinul de chinonă în bacteriile aerobe care oxidează amoniacul (Klotz și Stein, 2008; Simon și Klotz, 2013). La bacteriile anaerobe care oxidează amoniacul (anammox), modulul redox este format din hidrazină oxidoreductază și un citocrom c încă neidentificat (Jetten et al., 2009; Simon și Klotz, 2013). În calea inversă-HURM, hidroxilamina generată de nitriții din periplasmă este transportată în citoplasmă și redusă la amoniu prin intermediul unei hidroxilamină reductaze, cunoscută și sub numele de proteina clusterului hibrid (Har/Hcp). Astfel, reacțiile de acceptare a electronilor propuse pentru calea inversă-HURM sunt:
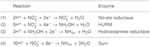
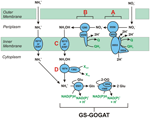
Figura 1. Calea inversă-HURM în N. profundicola. Etapele individuale sunt notate cu litere majuscule în figură. Numerele din proteinele reprezentate se referă la etichete de locus din genomul AmH (de exemplu, 1280 = NAMH_1280 = HaoA). (A) Reducerea nitratului de către nitrat reductaza respiratorie periplasmică (NapABGH, 0556-53), (B) HURM (hidroxilamină:Ubiquinone Redox Module) compus dintr-o hidroxilamină oxidoreductază cu funcționare inversă (HaoA, 1280) care funcționează ca o nitrit reductază ocataheme, care produce hidroxilamină utilizând electroni donați de un citocrom c tetra-heme din familia NapC/NrfH/cM552 (CycB, 0559). (C) Transportul hidroxilaminei prin intermediul transportatorilor de amoniac înrudiți cu AmtB. (D) Reducerea hidroxilaminei la amoniu de către o proteină hibridă cluster/hidroxilamină reductază (Hcp/Har, 1074) care utilizează puterea de reducere a unei proteine Fe-S prezise care conține Fe-S (1302) al cărei donator de electroni (X) este în prezent necunoscut. Asimilarea amoniului în biomasă are loc prin intermediul glutaminei sintetazei și a glutaminei:2-oxoglutarat aminotransferazei (GS-GOGAT).
Genomii de N. profundicola, C. concisus, C. curvus, C. curvus, C. fetus și Caminibacter mediatlanticus conțin fiecare gene care codifică enzimele din calea inversă-HURM, în timp ce genomurile altor Epsilonproteobacterii codifică omologii enzimelor NirS/NirK de formare a NO clasic și NirS/NirK și NirA de asimilare a amoniului, siroheme NirA sau pentaheme respiratorie NrfA reductaze de nitriți . Formulăm ipoteza conform căreia calea inversă-HURM îmbunătățește supraviețuirea și/sau dispersia lui N. profundicola și Campylobacter spp. în mediile gazdă cu deficit de amoniu sau în mediile neasociate cu gazda. Cu toate acestea, pentru ca această ipoteză să fie adevărată, calea inversă-HURM trebuie să furnizeze amoniu pentru biosinteză și/sau să faciliteze conservarea energiei la aceste organisme.

Tabel 1. Inventarul genelor metabolismului azotului la Epsilonproteobacteriile Epsilon secvențiate genetic.
Rezultate
Energetica creșterii la N. profundicola
N. profundicola utilizează atât formiatul cât și hidrogenul ca donatori de electroni pentru metabolismul energetic și este crescută de obicei pe polisulfură ca acceptor de electroni (Campbell et al., 2001; Smith et al., 2008). Calculele efectuate în condiții standard (1 M de toate speciile, 25°C, pH = 7) indică faptul că, atunci când nitratul este redus prin reacțiile din calea inversă-HURM, energia liberă Gibbs (Δ G°) este substanțial mai mare decât cea disponibilă prin reducerea polisulfurii (tabelul 2). De exemplu, Δ G° pe mol de formiat oxidat cu nitrat este de 7,4 ori mai mare decât cea a polisulfurii (-237 kJ mol-1 față de -32 kJ mol-1). Din acest calcul, se poate prezice că creșterea lui N. profundicola ar trebui să fie stimulată în culturile cu nitrat ca acceptor de electroni în raport cu polisulfura.
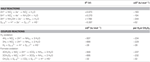
Tabel 2. Energiile libere de reacție calculate în condiții standard (1 M toate speciile, 25°C și pH = 7) pentru reacțiile de înjumătățire acceptantă de electroni a compușilor de azot și a polisulfurii și reacțiile cuplate cu formiatul sau hidrogenul ca donator de electroni.
Creșterea N. profundicola cu nitrat
Caracterizarea și creșterea anterioară a N. profundicola a utilizat medii cu polisulfură ca sursă combinată de sulf și acceptor de electroni (Campbell et al., 2001, 2009; Smith et al., 2008). Pentru a clarifica și mai mult rolul nitratului în metabolismul energetic al N. profundicola, tulpina AmH a fost cultivată cu sulfură ca unică sursă de sulf, astfel încât nitratul să fie singurul acceptor de electroni (figura 2). Donatorul de electroni a fost un amestec de hidrogen și formiat într-un mediu fără alte surse de sulf sau azot (Campbell et al., 2001). Ratele de creștere cu nitrat ca potențial acceptor de electroni și sursă de azot și sulfură (sursă de sulf) sau polisulfură (sursă de sulf și potențial acceptor de electroni) au fost mai mult decât duble față de ratele de creștere observate în culturile care utilizează amoniu ca unică sursă de azot și polisulfură ca acceptor de electroni și sursă de sulf. Așa cum era de așteptat, culturile de control negativ (fără acceptor de electroni) furnizate cu amoniu ca sursă de azot și sulfură ca sursă de sulf nu au putut crește.
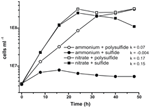
Figura 2. Creșterea lui N. profundicola cu acceptorii de electroni, compușii de azot și sursele de sulf indicate. Ratele de creștere au fost determinate între 8 și 24 h; k = constanta specifică a ratei de creștere (h-1). Fiecare punct reprezintă media a 2 sau 3 replici biologice independente.
Bilanțul de azot în culturile de N. profundicola
Pentru a confirma că nivelul de amoniu produs de N. profundicola a fost în exces față de nevoile biosintetice, am calculat cererea de azot biosintetic după cum urmează. Presupunând un raport C:N de 32:6,4 pentru bacterioplanctonul cu creștere exponențială (Vrede et al., 2002), 288 fg de C μm-3 pentru Escherichia coli cu creștere exponențială (Loferer-Krossbacher et al., 1998) și un volum celular de 0,021 μm3 calculat pe baza dimensiunilor raportate pentru N. profundicola (Smith et al., 2008), producția de 1 × 108 celule ml-1 necesită ~120 ng ml-1 de N (~9 μM), o cifră care nu s-ar schimba indiferent de sursa de N utilizată. N. profundicola nu a utilizat o cantitate semnificativă de amoniu furnizat în timpul creșterii cu polisulfură ca acceptor de electroni (figura 3, cercuri deschise), ceea ce este în concordanță cu necesarul scăzut de N calculat pentru a produce densitățile celulare observate. Cultura cu amoniu plus sulfură nu a crescut (figura 2) și, de asemenea, nu a consumat amoniu în mod detectabil (figura 3, cercuri închise). În schimb, cantitatea de amoniu produsă de celulele cultivate cu 5 mM de nitrat a fost de 4,6 mM cu polisulfură și de 5,2 mM cu sulfură (figura 3, pătrate deschise și, respectiv, închise). În cazul în care calea inversă HURM din Epsilonproteobacteria servește în primul rând pentru a produce amoniu pentru biosinteză, ne-am aștepta ca nivelurile scăzute de amoniu exogen să reprime puternic expresia genei căii HURM și activitatea de reducere a nitraților. Cu toate acestea, conversia stoichiometrică a nitratului în amoniu în exces față de necesarul de N prezis și consumul de amoniu observat în culturile cu amoniu + polisulfură este în concordanță cu ipoteza că N. profundicola utilizează nitratul ca acceptor terminal de electroni și că amonificarea nitratului nu este supusă represiunii de către amoniu.
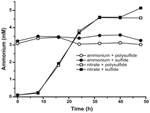
Figura 3. Concentrațiile de amoniu măsurate în culturile de N. profundicola-conținând acceptorii de electroni, compușii de azot și sursele de sulf indicate. Fiecare punct reprezintă media a 2 sau 3 replici biologice independente.
Încorporarea 15N-NO-3 în biomasă
Potențialul de asimilare a nitraților a fost evaluat prin examinarea încorporării amoniului sau nitratului marcat cu 15N în biomasa de N. profundicola în timpul creșterii cu toate combinațiile de donatori de electroni și acceptori potențiali de mai sus. N. profundicola cultivată cu amoniu marcat cu 20 Atom% 15N cu polisulfură a produs biomasă îmbogățită cu ~10 Atom% 15N după o rundă de cultură discontinuă (figura 4), în timp ce martorul neetichetat nu a fost îmbogățit în 15N. Culturile cultivate cu sulfură și nitrat marcat cu 20 Atom% 15N au produs biomasă îmbogățită la 16 Atom% 15N (figura 4). Biomasa cultivată cu nitrați conținea de aproximativ 5 ori mai mult N decât biomasa cultivată cu amoniu (datele nu sunt prezentate), ceea ce poate explica îmbogățirea mai extinsă a 15N în probele cultivate cu nitrați.
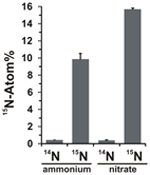
Figura 4. Absorbția de azot în biomasa de N. profundicola determinată în urma unei runde de cultură discontinuă cu 5 mM din compușii de azot indicați furnizați la abundența naturală (14N) sau la 20 Atom% 15N. Valorile reprezintă mediile a 3 replici biologice independente ± abaterea standard.
Transcrierea genelor din calea cheie
Abundanța transcripției genelor care codifică enzimele din calea inversă-HURM propusă la N. profundicola a fost determinată prin PCR cantitativă în timp real în culturi discontinue crescute cu amoniu sau nitrat. Toate componentele căii propuse au prezentat o creștere puternică a abundenței transcriptelor în culturile cultivate cu nitrat (figura 5). ARNm care codifică o subunitate de nitrat reductază (napA) au fost de 4,6 ori mai abundente (P < 0,05, test t heteroscedastic cu două cozi) în celulele cultivate cu nitrat + sulfură față de cele cultivate cu amoniu + polisulfură. Transcriptele ambelor componente ale HURM, haoA și cycB/napC, au fost crescute de 8,5 și, respectiv, de 7,1 ori (P < 0,05 pentru ambele). În concordanță cu predicția noastră conform căreia hidroxilamina produsă în periplasmă de către HURM ar fi transportată prin canalele proteinei facilitatoare majore, ARNm care codifică ambii omologi ai transportatorului de amoniu/metilamoniu amtB au crescut de 4,5 ori (amtB-1, NAMH_0397, P < 0,08) și de 10,3 ori (amtB-2, NAMH_0215, P > 0,10). Hidroxilamina este un mutagen puternic care trebuie să fie detoxificat pe măsură ce ajunge în citoplasmă. Propunem ca acest lucru să fie realizat de Har/Hcp dependentă de NADH, pe baza studiilor asupra genei hcp din grupul de gene de asimilare a nitraților din Rhodobacter capsulatus E1F1, unde este necesară pentru reducerea și asimilarea hidroxilaminei produse de o nitrat reductază asimilatoare citoplasmatică (Cabello et al., 2004; Pino et al., 2006). În concordanță cu această propunere, cea mai mare modificare a abundenței transcriptelor a fost observată pentru har, care a crescut de 11,7 ori, dar această modificare nu a fost semnificativă (P > 0,10) din cauza variabilității ridicate a măsurătorilor independente ale abundenței transcriptelor har. Inițial, am propus ca donatorul de electroni pentru Har să fie o dehidrogenază NADH codificată de NAMH_0542 (Campbell et al., 2009). Cu toate acestea, credem acum că un candidat mai bun pentru această funcție este NAMH_1302, o proteină de cluster 4Fe-4S prezisă, pe baza conservării în alte Epsilonproteobacterii (tabelul 1). În concordanță cu această predicție, transcripțiile NAMH_1302 au fost de 4,6 ori mai abundente în celulele cultivate cu nitrat în comparație cu cele cultivate cu amoniu, dar schimbarea nu a fost semnificativă (P > 0,10).
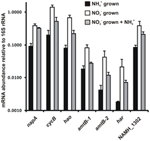
Figura 5. Nivelurile de ARNm în stare de echilibru pentru genele cheie care codifică enzimele căii inverse-HURM în N. profundicola cultivată cu amoniu + polisulfură (bare negre), nitrat + sulfură (bare albe) sau nitrat + polisulfură după adăugarea de amoniu. Abundența transcripțiilor a fost determinată prin RT-PCR fluorescentă și normalizată la abundența ARNr 16S determinată în fiecare probă. Valorile reprezintă mediile a 3 replici biologice independente ± deviația standard.
Pentru a testa reprimarea potențială a amoniului în expresia căilor de expresie, amoniul a fost adăugat la culturile cultivate cu nitrat + sulfură și abundența ARNm a fost cuantificată pentru aceleași gene. În general, adăugarea de amoniu a scăzut abundența ARNm a genelor care codifică calea inversă HURM de la 1,2 până la 3,6 ori (figura 5, bare gri), deși acest efect a fost semnificativ (P < 0,10) doar pentru transcriptele haoA și napC/cycB care codifică subunitățile HURM. În mod interesant, expresia lui napA a scăzut cel mai puțin (de 1,2 ori), indicând nevoia de respirație a nitraților în aceste celule. În niciun caz, adaosul de amoniu nu a redus nivelurile de transcripție la cele observate în culturile cultivate în amoniu + polisulfură.
Evidență pentru un intermediar de hidroxilamină
Măsurătorile directe ale hidroxilaminei în filtratele culturilor de N. profundicola cultivate cu nitrat au găsit niveluri scăzute, dar constant detectabile de hidroxilamină (5,7 ± 3,5 μM, SD, n = 3). Acest nivel scăzut este în concordanță cu un intermediar ale cărui rate de producere și consum sunt foarte apropiate.
Pentru a determina dacă hidroxilamina ar putea fi metabolizată de N. profundicola, suspensii spălate de celule cultivate cu nitrat au fost incubate în mediu de creștere fără nitrat cu hidrogen ca unic donor de electroni. S-a adăugat hidroxilamină ca potențial acceptor de electroni și s-au urmărit în timp atât concentrațiile de hidroxilamină, cât și cele de amoniu. Rezultatele acestui experiment indică faptul că celulele de N. profundicola cultivate cu nitrați transformă rapid și complet hidroxilamina în amoniu (figura 6). Rata specifică de conversie a hidroxilaminei în acest experiment a fost de 28,6 μM min-1 108 celule-1. Rata de producere a amoniului din nitrat calculată pentru creșterea exponențială din figura 3 (8-24 h) este de ~3 μM min-1 (108 celule)-1. Astfel, rata de conversie a hidroxilaminei măsurată este cu mult mai mare decât rata de producție de amoniu observată în timpul creșterii N. profundicola cu nitrat. O cuplare la fel de strânsă între producția și eliminarea hidroxilaminei a fost raportată recent pentru arheonul chemolithotrofic care oxidează amoniacul, Nitrosopumilus maritimus, unde oxidarea hidroxilaminei este o etapă catabolică esențială (Vajrala et al., 2013).
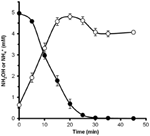
Figura 6. Hidroxilamina este transformată rapid în amoniu de către N. profundicola. Concentrațiile de hidroxilamină (cercuri închise) și amoniu (cercuri deschise) au fost urmărite după adăugarea a 5 mM de hidroxilamină la o suspensie celulară în repaus. Punctele reprezintă valorile medii din trei repetiții ± abaterea standard.
Discuție
Datele prezentate aici sunt în concordanță cu o nouă cale de reducere a nitraților în organismele care nu au nitriți reductaze clasice de formare a NO (NirS sau NirK) sau de formare a amoniului (NirB/NirA), cu tulpina AmH de N. profundicola ca sistem model util. A fost propusă o cale inversă-HURM prin care nitritul este redus la hidroxilamină în periplasmă și ulterior redus la amoniu în citoplasmă (Campbell et al., 2009). Calea originală a fost ușor modificată aici pentru a include un candidat mai probabil pentru donatorul de electroni proximal la Har/Hcp, o proteină 4Fe-4S codificată de NAMH_1302 (figura 1). Homologii lui NAMH_1302 sunt conservați în C. concisus (accesarea GenBank YP_001466207), C. curvus (YP_001408944), C. fetus (YP_892678) și C. mediatlanticus (ZP_01871213), care posedă toate celelalte gene pentru calea inversă-HURM. În plus, NAMH_1302 a prezentat o creștere a abundenței transcripției în celulele de N. profundicola cultivate cu nitrat față de cele cu amoniu.
În timp ce producția de hidroxilamină din nitrat și nitrit atât pe cale chimică (Rollefson și Oldershaw, 1932), cât și biologică (Lindsey și Rhines, 1932) este cunoscută de mult timp și s-a demonstrat că un complex 3 reduce nitritul la hidroxilamină atunci când este alimentat cu un reductor (Kostera et al., 2010), raportul dintre producția de hidroxilamină și cea de amoniu din nitriți pe calea inversă a HURM nu este încă clar. Absorbția hidroxilaminei extracelulare de către bacterii este cunoscută; hidroxilamina furnizată în mod exogen se acumulează cu ușurință în anammoxosomul lui Kuenenia stuttgartiensis (Lindsay et al., 2001; Schmidt et al., 2004), un compartiment la care se poate ajunge numai prin traversarea membranelor celulei și a anammoxosomului. Absorbția propusă a hidroxilaminei extrem de mutagene necesită o protecție împotriva leziunilor ADN, ceea ce poate explica parțial complementul extins de sisteme de reparare a ADN-ului identificat la N. profundicola (Campbell et al., 2009). Hidroxilamina a fost, de asemenea, propusă ca intermediar al producției de amoniu din nitriți în plante și alge, deoarece nitrit reductaza dependentă de ferredoxină prezintă o mare reactivitate și specificitate pentru acest substrat (Kuznetsova et al., 2004; Hirasawa et al, 2010).
În mod diferit de funcția de chinon-reductază a HURM în amoniac-oxidanți (Klotz și Stein, 2008; Simon și Klotz, 2013), propunem ca HURM în N. profundicola să acționeze, similar cu NrfAH, ca un sistem periplasmic de chinol-oxidază care transferă electroni din rezerva de chinol pentru a reduce nitritul la hidroxilamină. Este probabil ca calea inversă-HURM să fi evoluat de la un strămoș comun al modulului de amonificare NrfAH și ONR din bacteriile anammox. Presupunem că acest lucru a avut loc înainte ca HURM – inclusiv un complex trimeric HaoA legat covalent, capabil de disproporționarea hidroxilaminei – să fie utilizat ca modul catabolic atât în bacteriile anaerobe, cât și în cele aerobe care oxidează amoniacul (Jetten et al., 2009; Klotz și Stein, 2010; Campbell et al., 2011; Kern et al., 2011; Simon și Klotz, 2013). O inversare similară a funcției, de la activitatea de reducere la cea de oxidare, efectuată prin formarea de complexe dirijate de legături covalente, a fost discutată pentru citocromul c’-beta (cytS), care reduce NO, și pentru citocromul P460 (cytL), care oxidează NO (Elmore et al., 2007). Genele care codifică modulele NrfAH și reverse-HURM coexistă într-o singură secvență de genom bacterian, C. fetus 82-40 (tabelul 1). S-a demonstrat recent că octahemul citocrom c hidroxilamină dehidrogenază a evoluat ca membru al unei superfamilii de proteine de citocrom c multiheme cu funcții în ciclurile azotului și sulfului și că citocromul cM552 (CycB), NrfH și NapC sunt membri ai unei alte superfamilii de citocrom c (Bergmann et al., 2005; Klotz și Stein, 2008; Kern et al., 2011; Simon și Klotz, 2013). Se știe, de asemenea, că complexele NAP din Epsilonproteobacteria nu conțin, în general, proteine de subunitate NapC (Klotz et al., 2006; Sievert et al., 2008; Kern și Simon, 2009; Klotz și Stein, 2010; Simon și Klotz, 2013). Funcția inversă propusă a unui complex n-cM552 (CycB/NapC) ca un complex nitrit reductază-quinol oxidază este fezabilă, având în vedere prezența ambelor transcripte și absența ligandului proteic critic de tirozină în N. profundicola HaoA (Campbell et al, 2009), care separă complexele NrfA și ONR reducătoare de N-oxid și ONR de complexele HAO oxidante de N-oxid (Bergmann et al., 2005; Klotz și Stein, 2008; Kern et al., 2011; Simon și Klotz, 2013).
Datele de asimilare a 15N au stabilit că N. profundicola încorporează azotul nitrat în biomasă în timpul creșterii atunci când acesta este furnizat ca sursă unică de azot. Cu toate acestea, excesul vast de producție de amoniu din nitrați față de cerințele calculate pentru biosinteză ne determină să concluzionăm că funcția principală a reducerii nitraților în amoniu de către N. profundicola este aceea de acceptor eficient de electroni respiratori. Această concluzie este susținută de creșterea ratelor de creștere și a randamentelor în culturile de N. profundicola cu nitrat ca unic acceptor de electroni. În plus, datele privind expresia genelor sunt în concordanță cu propunerea noastră (Campbell et al., 2009) conform căreia acest lucru are loc prin intermediul funcției concertate a Nap, HURM (3 și cM552) și Har/Hcp ca o nouă cale de asimilare a N și de conservare a energiei: calea inversă a HURM. În cele din urmă, datele indică faptul că N. profundicola are capacitatea de a reduce rapid hidroxilamina la amoniu, în concordanță cu propunerea hidroxilaminei libere ca intermediar în calea inversă-HURM. Rata ridicată de absorbție a hidroxilaminei observată explică probabil de ce aceasta nu este observată în mod constant în timpul creșterii culturilor pe nitrat. Măsurătorile preliminare ale producției de amoniu din nitrat sau nitrit în celulele în repaus sunt similare cu rata de 3 μM min-1 (108 celule)-1 calculată din culturi, de ~10 ori mai mică decât rata de consum de hidroxilamină observată. Având în vedere aceste rate, hidroxilamina ar trebui să fie consumată imediat după producție în culturile care cresc pe nitrat. Deoarece hidroxilamina este mutagena, presupunem că acest lucru reflectă presiunea selectivă anterioară pentru a menține niveluri scăzute de hidroxilamină în timpul creșterii.
Deși s-a încercat marcarea biomasei cu 15N-NH2OH în culturi discontinue de N. profundicola, aceasta nu a avut încă succes (datele nu sunt prezentate). Având în vedere că hidroxilamina în cultura discontinuă trebuie să fie furnizată la concentrații scăzute în raport cu nitratul neetichetat pentru a evita toxicitatea și că marea majoritate a N din hidroxilamină ar trebui să fie transformată în amoniu (>90% pe baza figurii 3), acest rezultat nu este surprinzător. Experimentele de marcare pe termen scurt cu concentrații mult mai mari de hidroxilamină marcată ca unică sursă de N pot stabili definitiv acest aspect.
În concluzie, datele prezentate aici sunt în concordanță cu un model în care N. profundicola reduce nitratul prin intermediul unui intermediar hidroxilamină liberă. Aceste experimente nu exclud încă complet posibilitatea ca activitatea inversă-HURM propusă la N. profundicola să funcționeze ca o nitrit reductază de formare de amoniu care transferă 6 electroni fără a elibera un intermediar N-oxid. Rezultatele nepublicate indică faptul că câteva mutații punctiforme în gena nrfA pot transforma pentaheme citocrom c nitrit reductaza într-o enzimă cu scurgeri care eliberează intermediari de oxid de N și nu reușește să transforme nitritul în mod stoichiometric în amoniu (Jörg Simon, comunicări personale). Având în vedere relația evolutivă dintre nrfA și haoA (Bergmann et al., 2005; Simon și Klotz, 2013), modulul invers-HURM din N. profundicola ar putea funcționa în mod natural ca un complex enzimatic producător de amoniu și hidroxilamină, în timp ce NrfA existentă funcționează „fără scurgeri” ca o nitrit reductază producătoare de amoniu. Experimentele ulterioare care utilizează inhibitori ai Har/Hcp cu nitrat sau nitrit ca substrat în celule întregi și/sau studiile biochimice ale complexului invers-HURM pentru a determina produsul in vitro ar trebui să ofere teste directe suplimentare ale acestei ipoteze. Indiferent de mecanismul specific, producția extensivă de amoniu cu mult peste necesitățile biosintetice de către N. profundicola sugerează că aceasta și Epsilonproteobacteriile înrudite pot avea un rol ecologic ca sursă de amoniu în mediile hipoxice, bogate în nitrați și lipsite de amoniu, în care sunt frecvent întâlnite.
Materiale și metode
Calcule de energie liberă
Energii libere Gibbs (tabelul 2) au fost calculate din potențialele redox standard ale jumătăților de reacție prin ecuația Nernst (Δ G0 = -nFE0) sau prin însumarea energiilor libere ale jumătăților de reacție colectate din literatura de specialitate (Thauer et al, 1977; van der Star et al., 2008). Toate calculele au fost efectuate în condiții standard (1 M toate speciile, 25°C, pH = 7).
Cultură și analiză a compușilor de azot
N. profundicola tulpina AmH (ATCC BAA-1463) a fost cultivată și celulele au fost numărate așa cum a fost descris anterior (Smith et al., 2008; Campbell et al., 2009). Amoniul din supranaturile de cultură a fost cuantificat după derivatizarea cu clorură de dansil și separarea prin HPLC cu detectare prin fluorescență (Shakila et al., 2001). Nitratul a fost cuantificat prin HPLC cu detecție UV/Vis. Concentrațiile de hidroxilamină au fost determinate în filtratele de cultură (0,2 μm) așa cum au fost descrise de Frear și Burrell (1955).
Proceduri de marcare cu 15N
Soluțiile stoc de 20 Atom% 15N-nitrat și 15N-amoniu au fost preparate prin amestecarea >99 Atom% și a sărurilor de abundență naturală pentru a pregăti mediul la o concentrație finală de 5 mM de nitrat sau amoniu, după cum este necesar. Celulele au fost recoltate din culturile marcate cu 15N prin centrifugare, iar peletul celular a fost spălat de trei ori cu apă nanopură pentru a elimina sărurile. Suspensia celulară a fost uscată în capsule de staniu, care au fost trimise la laboratorul de izotopi stabili al Universității California-Davis, unde procentul atomic de 15N a fost determinat prin spectrometrie de masă cu raport izotopic. Probele de control au indicat că nu a avut loc nicio contaminare izotopică în timpul prelucrării probelor (datele nu sunt prezentate).
PCR cantitativă
Amorsorii specifici pentru fiecare gen (tabelul 3) au fost utilizați pentru a cuantifica abundența ARNm în ARN total extras din N. profundicola, așa cum a fost descris anterior (Campbell et al., 2009).

Tabel 3. Primeri și condiții pentru cuantificarea Q-RT-PCR a genelor specifice în probele de ARN total extrase de la N. profundicola.
Asimilarea hidroxilaminei
N. profundicola a fost cultivată pe H2 și formiat ca donatori de electroni și nitrat ca unic acceptor de electroni până la faza exponențială târzie. Celulele au fost recoltate prin centrifugare. Toate transferurile și spălările de celule au fost efectuate într-o cameră anaerobă Coy Laboratories. Celulele au fost resuspendate cu mediu de creștere fără nitrați până la o concentrație finală de ~109 celule ml-1 și au fost incubate la 45°C timp de 2 ore într-o atmosferă de 80% H2 + 20% CO2 înainte de adăugarea de hidroxilamină (concentrație finală de 5 mM) dintr-o soluție stoc preparată în condiții anaerobe. S-au filtrat alicote din suspensia celulară și au fost analizate pentru hidroxilamină, așa cum s-a descris mai sus, și pentru amoniu prin HPLC după derivatizarea cu dietil-etoximetilenemalonat (Gómez-Alonso et al., 2007).
Contribuții ale autorilor
Thomas E. Hanson, Barbara J. Campbell și Martin G. Klotz au conceput în colaborare experimentele și au interpretat rezultatele, Thomas E. Hanson a efectuat toate analizele compușilor de azot și a pregătit probele pentru spectrometria de masă, Barbara J. Campbell a cultivat toate culturile și a efectuat PCR cantitativ, Katie M. Kalis a efectuat experimentele de absorbție a hidroxilaminei, Mark A. Campbell a identificat NAMH_1302 ca o genă relevantă. Thomas E. Hanson a redactat lucrarea, care a fost revizuită ulterior de Thomas E. Hanson, Barbara J. Campbell și Martin G. Klotz.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Autorii ar dori să mulțumească Lisa Y. Stein (Univ. Alberta-Edmonton), Jenn Macalady (Penn State Univ.), David Kirchman și Matt Cottrell (Univ. Delaware) pentru lecturi critice ale proiectelor de manuscris, Jennifer Biddle pentru accesul la o cameră anaerobă și Kathy Coyne pentru accesul la un HPLC. Acest proiect a fost finanțat prin granturi de la National Science Foundation pentru Barbara J. Campbell și S. Craig Cary (EF-0333203), pentru Barbara J. Campbell (DEB-0640414), pentru Barbara J. Campbell și Thomas E. Hanson (MCB-0950691) și pentru Martin G. Campbell și Thomas E. Hanson (MCB-0950691). Klotz (MCB-0948202/1202648), printr-un grant EPSCoR RII-2 acordat Universității din Delaware (EPS-0814251) și prin fonduri de stimulare oferite de Universitatea din Carolina de Nord lui Martin G. Klotz.
Kern, M., și Simon, J. (2009). Lanțuri de transport de electroni și bioenergetica metabolismului respirator al azotului în Wolinella succinogenes și alte Epsilonproteobacterii. Biochim. Biophys. Acta 1787, 646-656. doi: 10.1016/j.bbabio.2008.12.010
Pubmed Abstract | Pubmed Full Text | Pubmed Full Cross |Ref Full Text
Lindsey, G. A., and Rhines, C. M. (1932). Producerea de hidroxilamină prin reducerea nitraților și nitriților de către diferite culturi pure de bacterii. J. Bacteriol. 24, 489-492.
Pubmed Abstract | Pubmed Full Text
Loferer-Krossbacher, M., Klima, J., și Psenner, R. (1998). Determinarea masei uscate a celulelor bacteriene prin microscopie electronică de transmisie și analiza densitometrică a imaginii. Appl. Environ. Microbiol. 64, 688-694.
Pubmed Abstract | Pubmed Full Text
.