Introduction
Dusičnany jsou hlavní zásobárnou fixovaného dusíku v globálním N-cyklu (Falkowski a Godfrey, 2008; Klotz a Stein, 2008). Dusičnany mohou být redukovány prostřednictvím denitrifikace na oxid dusný nebo plynný dinitrogen, čímž se ztrácejí ze suchozemských a vodních ekosystémů, nebo prostřednictvím amonifikace na amonium, které může být zadrženo (Brandes et al., 2007; Klotz a Stein, 2008, 2010). Při obou cestách se dusičnany redukují na dusitany. U heterotrofních denitrifikátorů a oxidátorů amoniaku se dusitany dále redukují pomocí dusitanových reduktáz tvořících NO: NirS nebo NirK. Redukce dusitanů na amonium je katalyzována asimilační (NirB/NirA) nebo respirační (NrfA) amoniakotvornou dusitanovou reduktázou (Klotz a Stein, 2008, 2010). Chemolithotrofové a methanotrofové oxidující amoniak mohou také tvořit NO oxidací hydroxylaminu, což je další potenciální cesta ztráty dusíku v suchozemských a vodních ekosystémech (Campbell a kol., 2011). Několik Epsilonproteobakterií, které jsou schopny využívat dusičnany k dýchání a/nebo jako jediný zdroj dusíku pro růst, nekóduje homology žádného z typů nitritreduktázy, což naznačuje, že tyto organismy mají nerozpoznaný mechanismus redukce dusitanů na amonium.
Anotace genomu naznačuje, že nejen Nautilia profundicola, ale i několik patogenních Campylobacter spp. mezi Epsilonproteobakteriemi mohou využívat dusičnany jako zdroj dusíku pro růst a/nebo jako terminální akceptor elektronů. N. profundicola je členem nejhlouběji se větvící linie Epsilonproteobakterií (Campbell et al., 2006; Smith et al., 2008) a její příbuzní byli nalezeni pouze v prostředí hlubokomořských hydrotermálních průduchů. Naproti tomu Campylobacter spp. jsou obvykle spojeny se zvířecími hostiteli a jejich výskyt v jiných prostředích je špatně definován. Zatímco genomy N. profundicola, Campylobacter concisus, C. curvus a C. fetus obsahují geny kódující periplazmatický komplex nitrátreduktázy (NAP) vázaný na molybdopterin guanin dinukleotid, neexistují geny kódující ani amoniakální, ani NO tvořící nitritreduktázy. Kromě toho byl v genomu N. profundicola identifikován gen napC/cycB (Campbell et al., 2009), což je neobvyklé, protože komplex NAP u Epsilonproteobakterií obvykle postrádá protein NapC (Kern a Simon, 2009; Klotz a Stein, 2010; Simon a Klotz, 2013). Na základě genomově informované metabolické rekonstrukce (Campbell a kol., 2009) jsme nedávno navrhli novou cestu asimilace dusičnanů (obr. 1), při níž je dusitan redukován na hydroxylamin pomocí hydroxylamin:ubichinonového redoxního modulu (HURM, tj. chinon-dependentní hydroxylamindehydrogenázy), kterou označujeme jako reverzní-HURM cestu. U N. profundicola se předpokládá, že HURM se skládá z cytochromu cM552 (cycB, NAMH_0559) příbuzného NapC/NrfH, který zprostředkovává přenos elektronů mezi chinonovým poolem a periplazmatickou hydroxylamin oxidoreduktázou (HAO, NAMH_1280). HURM, která funguje v přímém směru a skládá se z hydroxylamindehydrogenázy (EC:1.7.2.6; HaoA3) připojené k elektronovému člunu proteinu cytochromu c (c554 a/nebo cM552 kódované cycA, resp. cycB), spojuje oxidaci hydroxylaminu s chinonovým poolem u aerobních bakterií oxidujících amoniak (Klotz a Stein, 2008; Simon a Klotz, 2013). U anaerobních bakterií oxidujících amoniak (anammox) se redoxní modul skládá z hydrazinoxidoreduktázy a dosud neidentifikovaného cytochromu c (Jetten et al., 2009; Simon a Klotz, 2013). V reverzní-HURM dráze je hydroxylamin vzniklý z dusitanů v periplazmě transportován do cytoplazmy a redukován na amonium prostřednictvím hydroxylaminreduktázy, známé také jako hybridní klastrový protein (Har/Hcp). Navrhované reakce přijímající elektrony v rámci reverzní dráhy HURM jsou tedy:
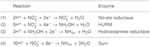
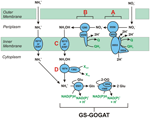
Obrázek 1. Reverzní dráha HURM u N. profundicola. Jednotlivé kroky jsou na obrázku označeny velkými písmeny. Čísla u zobrazených proteinů odkazují na značky lokusů z genomu AmH (tj. 1280 = NAMH_1280 = HaoA). (A) Redukce dusičnanů pomocí respirační periplasmatické nitrátreduktázy (NapABGH, 0556-53), (B) HURM (hydroxylamin:Ubiquinone Redox Module) sestávající z reverzně působící hydroxylamin oxidoreduktázy (HaoA, 1280) fungující jako oktahemová nitritreduktáza, která produkuje hydroxylamin s využitím elektronů darovaných z tetrahemového cytochromu c z rodiny NapC/NrfH/cM552 (CycB, 0559). (C) Transport hydroxylaminu prostřednictvím přenašečů amoniaku příbuzných s AmtB. (D) Redukce hydroxylaminu na amonium hybridním klastrovým proteinem/hydroxylaminreduktázou (Hcp/Har, 1074) využívajícím redukční sílu z předpokládaného proteinu obsahujícího Fe-S (1302), jehož donor elektronů (X) není v současné době znám. Asimilace amonia do biomasy probíhá prostřednictvím glutamin syntetázy a glutamin:2-oxoglutarát aminotransferázy (GS-GOGAT).
Genomy N. profundicola, C. concisus, C. curvus, C. fetus a Caminibacter mediatlanticus obsahují geny kódující enzymy reverzní dráhy HURM, zatímco genomy ostatních Epsilonproteobakterií kódují homology klasických NO-formujících NirS/NirK a amonium-formujících asimilačních sirohemů NirA nebo respiračních pentahemů NrfA nitritreduktáz . Předpokládáme, že reverzní dráha HURM zlepšuje přežívání a/nebo šíření N. profundicola a Campylobacter spp. v prostředí s nedostatkem amoniaku v hostitelském nebo nehostitelském prostředí. Aby však tato hypotéza byla pravdivá, musí reverzní dráha HURM poskytovat amoniak pro biosyntézu a/nebo usnadňovat zachování energie u těchto organismů.

Tabulka 1. Soupis genů pro metabolismus dusíku u genomově sekvenovaných Epsilonproteobakterií.
Výsledky
Energetika růstu u N. profundicola
N. profundicola využívá mravenčan i vodík jako donory elektronů pro energetický metabolismus a obvykle roste na polysulfidu jako akceptoru elektronů (Campbell et al., 2001; Smith et al., 2008). Výpočty za standardních podmínek (1 M všech druhů, 25 °C, pH = 7) ukazují, že při redukci dusičnanů reakcemi reverzní cesty HURM je Gibbsova volná energie (Δ G°) podstatně vyšší než energie dostupná při redukci polysulfidu (tabulka 2). Například Δ G° na mol mravenčanu oxidovaného dusičnanem je 7,4krát vyšší než u polysulfidu (-237 kJ mol-1 oproti -32 kJ mol-1). Z tohoto výpočtu lze předpovědět, že růst N. profundicola by měl být stimulován v kulturách s dusičnanem jako akceptorem elektronů oproti polysulfidu.
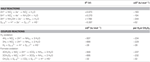
Tabulka 2. Vypočtené volné energie reakcí za standardních podmínek (1 M všech druhů, 25 °C a pH = 7) pro elektron akceptující poloreakce dusíkatých sloučenin a polysulfidu a sdružené reakce s mravenčanem nebo vodíkem jako donorem elektronů.
Růst N. profundicola s dusičnany
Předchozí charakterizace a růst N. profundicola využívaly média s polysulfidem jako kombinovaným zdrojem síry a akceptorem elektronů (Campbell et al., 2001, 2009; Smith et al., 2008). Pro další objasnění úlohy dusičnanů v energetickém metabolismu N. profundicola byl kmen AmH pěstován se sulfidem jako jediným zdrojem síry, takže jediným akceptorem elektronů byly dusičnany (obr. 2). Donorem elektronů byla směs vodíku a mravenčanu v médiu bez dalších zdrojů síry nebo dusíku (Campbell et al., 2001). Růstové rychlosti s dusičnanem jako potenciálním akceptorem elektronů a zdrojem dusíku a sulfidem (zdrojem síry) nebo polysulfidem (zdrojem síry a potenciálním akceptorem elektronů) byly více než dvojnásobné oproti růstovým rychlostem pozorovaným u kultur používajících amonium jako jediný zdroj dusíku a polysulfid jako akceptor elektronů a zdroj síry. Jak se očekávalo, negativní kontrolní kultury (bez akceptoru elektronů), kterým byl jako zdroj dusíku poskytnut amoniak a sulfid jako zdroj síry, nebyly schopny růstu.
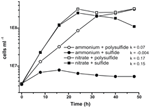
Figure 2. Růst N. profundicola s uvedenými akceptory elektronů, sloučeninami dusíku a zdroji síry. Rychlost růstu byla stanovena mezi 8 a 24 hodinami; k = specifická konstanta rychlosti růstu (h-1). Každý bod je průměrem 2 nebo 3 nezávislých biologických opakování.
Bilance dusíku v kulturách N. profundicola
Abychom potvrdili, že úroveň amoniaku produkovaného N. profundicola převyšuje biosyntetické potřeby, vypočítali jsme biosyntetickou potřebu dusíku následovně. Za předpokladu poměru C:N 32:6,4 pro exponenciálně rostoucí bakterioplankton (Vrede et al., 2002), 288 fg C μm-3 pro exponenciálně rostoucí Escherichia coli (Loferer-Krossbacher et al., 1998) a buněčný objem 0,021 μm3 vypočtený z uváděných rozměrů N. profundicola (Smith et al., 2008), vyžaduje produkce 1 × 108 buněk ml-1 ~120 ng ml-1 N (~9 μM), což je hodnota, která by se nezměnila bez ohledu na použitý zdroj dusíku. N. profundicola nevyužila významné množství amoniaku dodaného během růstu s polysulfidem jako akceptorem elektronů (obr. 3, otevřené kruhy), což souhlasí s nízkou potřebou N vypočtenou pro produkci pozorovaných hustot buněk. Kultura s amoniakem a sulfidem nerostla (obrázek 2) a také nezjistitelně nespotřebovávala amoniak (obrázek 3, uzavřené kruhy). Naproti tomu množství amoniaku vyprodukované buňkami pěstovanými s 5 mM dusičnanů bylo 4,6 mM s polysulfidem a 5,2 mM se sulfidem (obrázek 3, otevřené a uzavřené čtverce). Pokud reverzní dráha HURM u Epsilonproteobakterií slouží primárně k produkci amoniaku pro biosyntézu, očekávali bychom, že nízké hladiny exogenního amoniaku budou silně potlačovat expresi genů dráhy HURM a redukční aktivitu dusičnanů. Nicméně stechiometrická přeměna dusičnanů na amonium přesahující předpokládanou potřebu N a pozorovaná spotřeba amonia v kulturách amonium + polysulfid je v souladu s hypotézou, že N. profundicola využívá dusičnany jako terminální akceptor elektronů a že amonizace dusičnanů nepodléhá represi amoniem.
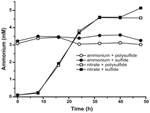
Figure 3. Koncentrace amoniaku naměřené v kulturách N. profundicola obsahujících uvedené akceptory elektronů, sloučeniny dusíku a zdroje síry. Každý bod je průměrem 2 nebo 3 nezávislých biologických opakování.
Inkorporace 15N-NO-3 do biomasy
Potenciál asimilace dusičnanů byl hodnocen zkoumáním inkorporace 15N značeného amonia nebo dusičnanů do biomasy N. profundicola během růstu se všemi výše uvedenými kombinacemi donorů elektronů a potenciálních akceptorů. N. profundicola pěstovaná na 20 atomů 15N značeného amonia s polysulfidem vytvářela po jednom kole dávkové kultivace biomasu obohacenou na ~10 atomů 15N (obr. 4), zatímco neznačená kontrola nebyla obohacena o 15N. Kultury pěstované se sulfidem a dusičnanem značeným 20 atomy 15N produkovaly biomasu obohacenou na 16 atomů 15N (obrázek 4). Biomasa pěstovaná na dusičnanech obsahovala přibližně 5krát více N než biomasa pěstovaná na amoniaku (údaje nejsou uvedeny), což může vysvětlovat rozsáhlejší obohacení 15N ve vzorcích pěstovaných na dusičnanech.
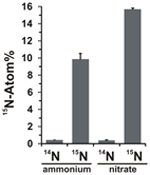
Obrázek 4. Příjem dusíku do biomasy N. profundicola stanovený po jednom kole dávkové kultivace s 5 mM uvedených sloučenin dusíku dodaných v přirozeném množství (14N) nebo s 20 atomovými % 15N. Hodnoty jsou průměry ze 3 nezávislých biologických opakování ± směrodatná odchylka.
Přepis genů klíčové dráhy
Přepis množství genů, které kódují enzymy navrhované reverzní dráhy HURM u N. profundicola, byl stanoven pomocí kvantitativní PCR v reálném čase ve vsádkových kulturách pěstovaných s amoniem nebo dusičnany. Všechny složky navrhované dráhy vykazovaly silný nárůst množství transkriptů v kulturách pěstovaných na dusičnanech (obr. 5). mRNA kódující podjednotku nitrátreduktázy (napA) byly 4,6krát (P < 0,05, dvouvýběrový heteroskedastický t-test) hojnější v buňkách pěstovaných na dusičnanech + sulfidech oproti buňkám pěstovaným na amoniaku + polysulfidech. Transkripty obou složek HURM, haoA a cycB/napC, byly zvýšeny 8,5krát a 7,1krát (P < 0,05 pro obě). V souladu s naším předpokladem, že hydroxylamin produkovaný v periplazmě HURM bude transportován přes hlavní kanály facilitátorových proteinů, byly mRNA kódující oba homology amoniového/methylamoniového transportéru amtB zvýšeny 4,5krát (amtB-1, NAMH_0397, P < 0,08) a 10,3krát (amtB-2, NAMH_0215, P > 0,10). Hydroxylamin je silný mutagen, který musí být detoxikován, jakmile se dostane do cytoplazmy. Na základě studií genu hcp v genovém klastru pro asimilaci nitrátů bakterie Rhodobacter capsulatus E1F1, kde je vyžadován pro redukci a asimilaci hydroxylaminu produkovaného cytoplazmatickou asimilační nitrátreduktázou (Cabello et al., 2004; Pino et al., 2006), předpokládáme, že se tak děje pomocí NADH-dependentního genu Har/Hcp. V souladu s tímto návrhem byla největší změna v množství transkriptů pozorována u har, které se zvýšilo 11,7krát, ale tato změna nebyla významná (P > 0,10) kvůli vysoké variabilitě nezávislých měření množství transkriptů har. Původně jsme navrhovali, že donorem elektronů pro Har je NADH dehydrogenáza kódovaná NAMH_0542 (Campbell et al., 2009). Nyní se však domníváme, že lepším kandidátem na tuto funkci je NAMH_1302, předpokládaný protein 4Fe-4S klastru, a to na základě zachování u jiných Epsilonproteobakterií (tabulka 1). V souladu s touto předpovědí byly transkripty NAMH_1302 4,6krát hojnější v buňkách pěstovaných na dusičnanech v porovnání s buňkami pěstovanými na amoniaku, ale tato změna nebyla významná (P > 0,10).
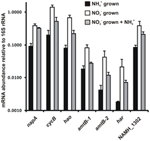
Figure 5. Hladiny mRNA v ustáleném stavu pro klíčové geny kódující enzymy reverzní dráhy HURM u N. profundicola pěstované s amoniakem + polysulfidem (černé sloupce), nitrátem + sulfidem (bílé sloupce) nebo nitrátem + polysulfidem po přídavku amoniaku. Množství transkriptů bylo stanoveno pomocí fluorescenční RT-PCR a normalizováno na množství 16S rRNA stanovené v každém vzorku. Hodnoty jsou průměry ze 3 nezávislých biologických opakování ± směrodatná odchylka.
Pro testování potenciální represe exprese dráhy amoniakem bylo ke kulturám pěstovaným na dusičnanech + sulfidech přidáno amonium a kvantifikováno množství mRNA pro stejné geny. Obecně přídavek amoniaku snížil množství mRNA genů kódujících reverzní dráhu HURM 1,2- až 3,6násobně (obr. 5, šedé sloupce), ačkoli tento účinek byl významný (P < 0,10) pouze pro transkripty haoA a napC/cycB, které kódují podjednotky HURM. Zajímavé je, že exprese napA se snížila nejméně (1,2krát), což ukazuje na potřebu nitrátové respirace v těchto buňkách. Přídavek amoniaku v žádném případě nesnížil hladiny transkriptů na úroveň pozorovanou u kultur pěstovaných v prostředí amoniak + polysulfid.
Důkaz pro hydroxylaminový meziprodukt
Přímé měření hydroxylaminu ve filtrátech kultur N. profundicola pěstovaných s dusičnany zjistilo nízké, ale trvale detekovatelné hladiny hydroxylaminu (5,7 ± 3,5 μM, SD, n = 3). Tato nízká hladina odpovídá meziproduktu, jehož rychlost produkce a spotřeby je v těsném souladu.
Pro zjištění, zda může být hydroxylamin metabolizován N. profundicola, byly promyté suspenze buněk pěstovaných na dusičnanech inkubovány v růstovém médiu bez dusičnanů s vodíkem jako jediným donorem elektronů. Hydroxylamin byl přidán jako potenciální akceptor elektronů a koncentrace hydroxylaminu i amoniaku byly sledovány v čase. Výsledky tohoto pokusu ukazují, že buňky N. profundicola pěstované na dusičnanech rychle a úplně přeměňují hydroxylamin na amonium (obrázek 6). Specifická rychlost přeměny hydroxylaminu v tomto experimentu byla 28,6 μM min-1 108 buněk-1. Rychlost produkce amoniaku z dusičnanů vypočtená pro exponenciální růst na obrázku 3 (8-24 h) je ~3 μM min-1 (108 buněk)-1. Naměřená rychlost přeměny hydroxylaminu tedy značně převyšuje rychlost produkce amoniaku pozorovanou během růstu N. profundicola s dusičnany. Podobně těsná vazba mezi produkcí a odstraňováním hydroxylaminu byla nedávno zaznamenána u chemolitotrofního amoniak-oxidujícího archeonu Nitrosopumilus maritimus, kde je oxidace hydroxylaminu zásadním katabolickým krokem (Vajrala et al., 2013).
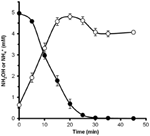
Figure 6. Hydroxylamin je N. profundicola rychle přeměňován na amonium. Po přidání 5 mM hydroxylaminu do klidové buněčné suspenze byly sledovány koncentrace hydroxylaminu (uzavřené kroužky) a amonia (otevřené kroužky). Body jsou průměrné hodnoty ze tří opakování ± směrodatná odchylka.
Diskuse
Předložené údaje jsou v souladu s novou cestou redukce dusičnanů u organismů, které postrádají klasické nitritreduktázy tvořící NO (NirS nebo NirK) nebo amonium (NirB/NirA), přičemž užitečným modelovým systémem je kmen N. profundicola AmH. Byla navržena reverzní cesta HURM, při níž je nitrit redukován na hydroxylamin v periplazmě a následně redukován na amonium v cytoplasmě (Campbell et al., 2009). Původní dráha zde byla mírně upravena tak, aby zahrnovala pravděpodobnějšího kandidáta na proximálního donora elektronů pro Har/Hcp, předpokládaný protein obsahující 4Fe-4S kódovaný NAMH_1302 (obr. 1). Homolog NAMH_1302 je zachován u C. concisus (GenBank accession YP_001466207), C. curvus (YP_001408944), C. fetus (YP_892678) a C. mediatlanticus (ZP_01871213), které mají všechny ostatní geny pro reverzní dráhu HURM. Navíc NAMH_1302 vykazoval zvýšení množství transkriptu v buňkách N. profundicola pěstovaných na dusičnanech v porovnání s amoniem.
Přestože je produkce hydroxylaminu z dusičnanů a dusitanů jak chemickou (Rollefson a Oldershaw, 1932), tak biologickou cestou (Lindsey a Rhines, 1932) známa již dlouho a bylo prokázáno, že komplex 3 redukuje dusitany na hydroxylamin po dodání reduktoru (Kostera a kol..), 2010), poměr produkce hydroxylaminu a amoniaku z dusitanů v reverzní cestě HURM není dosud jasný. Příjem extracelulárního hydroxylaminu bakteriemi je znám; exogenně dodaný hydroxylamin se snadno hromadí v anammoxosomu Kuenenia stuttgartiensis (Lindsay et al., 2001; Schmidt et al., 2004), což je kompartment, do kterého se lze dostat pouze překonáním buněčné i anammoxosomové membrány. Předpokládaný příjem vysoce mutagenního hydroxylaminu vyžaduje ochranu před poškozením DNA, což může částečně vysvětlovat rozsáhlý komplement DNA reparačních systémů identifikovaných u N. profundicola (Campbell et al., 2009). Hydroxylamin byl také navržen jako meziprodukt produkce amoniaku z dusitanů u rostlin a řas, protože ferredoxin-dependentní nitritreduktasa vykazuje vysokou reaktivitu a specifitu pro tento substrát (Kuznetsova et al., 2004; Hirasawa et al.,
Na rozdíl od chinonreduktázové funkce HURM u oxidátorů amoniaku (Klotz a Stein, 2008; Simon a Klotz, 2013) navrhujeme, aby HURM u N. profundicola fungovala, podobně jako NrfAH, jako periplazmatický chinoloxidázový systém, který přesouvá elektrony z chinolového poolu na redukci dusitanů na hydroxylamin. Je pravděpodobné, že se reverzní-HURM-cesta vyvinula ze společného předka NrfAH a ONR amonifikačního modulu u anammox bakterií. Předpokládáme, že k tomu došlo dříve, než se HURM – včetně kovalentně vázaného trimerního komplexu HaoA schopného disproporcionovat hydroxylamin – začal používat jako katabolický modul u anaerobních i aerobních bakterií oxidujících amoniak (Jetten et al., 2009; Klotz a Stein, 2010; Campbell et al., 2011; Kern et al., 2011; Simon a Klotz, 2013). O podobném obrácení funkce z redukční na oxidační aktivitu, které se uskutečňuje tvorbou komplexu řízeného kovalentní vazbou, se hovoří u NO-redukujícího cytochromu c‘-beta (cytS) a NO-oxidujícího cytochromu P460 (cytL) (Elmore et al., 2007). Geny kódující moduly NrfAH a reverzní-HURM koexistují pouze v jedné sekvenci bakteriálního genomu, C. fetus 82-40 (tab. 1). Nedávno se ukázalo, že oktahem cytochrom c hydroxylamin dehydrogenáza se vyvinula jako člen multihemové nadrodiny proteinů cytochromu c s funkcemi v dusíkovém a sirném cyklu a že cytochrom cM552 (CycB), NrfH a NapC jsou členy jiné nadrodiny cytochromu c (Bergmann et al., 2005; Klotz a Stein, 2008; Kern et al., 2011; Simon a Klotz, 2013). Je také známo, že komplexy NAP u Epsilonproteobakterií obecně neobsahují proteiny podjednotky NapC (Klotz et al., 2006; Sievert et al., 2008; Kern a Simon, 2009; Klotz a Stein, 2010; Simon a Klotz, 2013). Navrhovaná obrácená funkce komplexu n-cM552 (CycB/NapC) jako komplexu nitritreduktázy a chinoloxidázy je možná vzhledem k přítomnosti obou transkriptů a nepřítomnosti kritického tyrosinového proteinového ligandu v N. profundicola HaoA (Campbell et al., 2009), které oddělují N-oxid redukující NrfA a ONR od N-oxid oxidujících komplexů HAO (Bergmann et al., 2005; Klotz a Stein, 2008; Kern et al., 2011; Simon a Klotz, 2013).
Údaje o asimilaci 15N prokázaly, že N. profundicola začleňuje dusičnanový dusík do biomasy během růstu, pokud je jí poskytován jako jediný zdroj dusíku. Obrovský přebytek produkce amonia z dusičnanů nad vypočtenými nároky na biosyntézu nás však vede k závěru, že primární funkcí redukce dusičnanů na amonium u N. profundicola je funkce účinného respiračního akceptoru elektronů. Tento závěr podporují zvýšené rychlosti růstu a výnosy v kulturách N. profundicola s dusičnany jako jediným akceptorem elektronů. Údaje o genové expresi navíc souhlasí s naším návrhem (Campbell et al., 2009), že k tomu dochází prostřednictvím společné funkce Nap, HURM (3 a cM552) a Har/Hcp jako nové dráhy asimilace N a zachování energie: reverzní dráhy HURM. A konečně, údaje naznačují, že N. profundicola má schopnost rychle redukovat hydroxylamin na amonium, což je v souladu s návrhem volného hydroxylaminu jako meziproduktu v reverzní-HURM dráze. Pozorovaná vysoká rychlost absorpce hydroxylaminu pravděpodobně vysvětluje, proč není konzistentně pozorována během růstu kultur na dusičnanech. Předběžná měření produkce amoniaku z dusičnanů nebo dusitanů v klidových buňkách jsou podobná rychlosti 3 μM min-1 (108 buněk)-1 vypočtené z kultur, což je ~10krát méně než pozorovaná rychlost spotřeby hydroxylaminu. Vzhledem k těmto rychlostem by hydroxylamin měl být v kulturách rostoucích na dusičnanech spotřebován ihned po produkci. Vzhledem k tomu, že hydroxylamin je mutagenní, předpokládáme, že to odráží předchozí selekční tlak na udržování nízkých hladin hydroxylaminu během růstu.
Přestože byl učiněn pokus o značení biomasy pomocí 15N-NH2OH v dávkových kulturách N. profundicola, nebyl zatím úspěšný (údaje nejsou uvedeny). Vzhledem k tomu, že hydroxylamin ve vsádkových kulturách musí být dodáván v nízkých koncentracích ve srovnání s neznačenými dusičnany, aby se zabránilo toxicitě, a že naprostá většina N z hydroxylaminu by měla být přeměněna na amonium (>90 % na základě obrázku 3), není tento výsledek překvapivý. Krátkodobé značkovací experimenty s mnohem vyššími koncentracemi značeného hydroxylaminu jako jediného zdroje N mohou tento bod definitivně potvrdit.
Závěrem lze říci, že zde uvedené údaje odpovídají modelu, kdy N. profundicola redukuje dusičnany prostřednictvím volného meziproduktu hydroxylaminu. Tyto experimenty ještě zcela nevylučují možnost, že navrhovaná aktivita reverzní HURM u N. profundicola funguje jako amonium-tvořící nitritreduktáza, která přenáší 6 elektronů bez uvolnění meziproduktu N-oxidu. Nepublikované výsledky naznačují, že několik bodových mutací v genu nrfA může z pentahem cytochrom c nitritreduktázy učinit děravý enzym, který uvolňuje meziprodukty oxidu N a nedokáže stechiometricky přeměnit dusitany na amonium (Jörg Simon, pers. communi.). Vzhledem k evolučnímu vztahu mezi nrfA a haoA (Bergmann et al., 2005; Simon a Klotz, 2013) by reverzní modul HURM u N. profundicola mohl přirozeně fungovat jako enzymový komplex produkující amonium a hydroxylamin, zatímco extantní NrfA funguje „bez úniku“ jako nitritreduktáza produkující amonium. Další experimenty s použitím inhibitorů Har/Hcp s dusičnany nebo dusitany jako substrátem v celých buňkách a/nebo biochemické studie reverzního komplexu HURM ke stanovení produktu in vitro by měly poskytnout další přímé testy této hypotézy. Bez ohledu na specifický mechanismus naznačuje rozsáhlá produkce amoniaku, která značně převyšuje biosyntetické potřeby N. profundicola, že tato a příbuzné Epsilonproteobakterie mohou plnit ekologickou úlohu jako zdroj amoniaku v hypoxickém prostředí bohatém na dusičnany a chudém na amoniak, kde se běžně vyskytují.
Materiál a metody
Výpočty volné energie
Gibbsovy volné energie (tabulka 2) byly vypočteny ze standardních redoxních potenciálů poloreakcí podle Nernstovy rovnice (Δ G0 = -nFE0) nebo součtem volných energií poloreakcí získaných z literatury (Thauer et al..), 1977; van der Star et al., 2008). Všechny výpočty byly provedeny za standardních podmínek (1 M všech druhů, 25 °C, pH = 7).
Kultivace a analýza dusíkatých látek
N. profundicola kmen AmH (ATCC BAA-1463) byl kultivován a buňky počítány podle dřívějších popisů (Smith et al., 2008; Campbell et al., 2009). Amonium v supernatantech kultury bylo kvantifikováno po derivatizaci dansylchloridem a separaci pomocí HPLC s fluorescenční detekcí (Shakila et al., 2001). Dusičnany byly kvantifikovány pomocí HPLC s UV/Vis detekcí. Koncentrace hydroxylaminu byla stanovena ve filtrátech kultur (0,2 μm) podle popisu Freara a Burrella (1955).
Postupy značení 15N
Stokové roztoky 20 atomů% 15N-dusičnanu a 15N-amonia byly připraveny smícháním >99 atomů% a přirozeného množství solí pro přípravu média o konečné koncentraci 5 mM dusičnanu nebo amonia podle potřeby. Buňky byly sklizeny z kultur značených 15N odstředěním a buněčný pelet byl třikrát promyt nanočistou vodou k odstranění solí. Buněčná suspenze byla vysušena v cínových kapslích, které byly odeslány do laboratoře stabilních izotopů University of California-Davis, kde bylo hmotnostní spektrometrií izotopového poměru stanoveno 15N Atom %. Kontrolní vzorky ukázaly, že během zpracování vzorků nedošlo k žádné izotopové kontaminaci (údaje nejsou uvedeny).
Kvantitativní PCR
Pro kvantifikaci množství mRNA v celkové RNA extrahované z N. profundicola byly použity genově specifické primery (tabulka 3), jak bylo popsáno dříve (Campbell et al., 2009).

Tabulka 3. Primery a podmínky pro Q-RT-PCR kvantifikaci specifických genů ve vzorcích celkové RNA extrahované z N. profundicola.
Příjem hydroxylaminu
N. profundicola byla pěstována na H2 a mravenčanu jako donorech elektronů a dusičnanu jako jediném akceptoru elektronů do pozdní exponenciální fáze. Buňky byly sklizeny centrifugací. Všechny přenosy a promývání buněk byly prováděny v anaerobní komoře Coy Laboratories. Buňky byly resuspendovány s růstovým médiem bez dusičnanů na konečnou koncentraci ~109 buněk ml-1 a inkubovány při 45 °C po dobu 2 hodin v atmosféře 80 % H2 + 20 % CO2 před přidáním hydroxylaminu (konečná koncentrace 5 mM) z anaerobně připraveného zásobního roztoku. Alikvoty buněčné suspenze byly filtrovány a testovány na hydroxylamin, jak je popsáno výše, a na amonium pomocí HPLC po derivatizaci diethyl ethoxymethylenemalonátem (Gómez-Alonso et al., 2007).
Příspěvky autorů
Thomas E. Hanson, Barbara J. Campbell a Martin G. Klotz společně navrhli experimenty a interpretovali výsledky, Thomas E. Hanson provedl všechny analýzy sloučenin dusíku a připravil vzorky pro hmotnostní spektrometrii, Barbara J. Campbell vypěstovala všechny kultury a provedla kvantitativní PCR, Katie M. Kalis provedla experimenty s příjmem hydroxylaminu, Mark A. Campbell identifikoval NAMH_1302 jako příslušný gen. Thomas E. Hanson vypracoval návrh článku, který následně revidovali Thomas E. Hanson, Barbara J. Campbell a Martin G. Klotz.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Poděkování
Autoři děkují Lise Y. Stein (Univ. Alberta-Edmonton), Jenn Macalady (Penn State Univ.), Davidu Kirchmanovi a Mattu Cottrellovi (Univ. Delaware) za kritické přečtení návrhů rukopisu, Jennifer Biddle za přístup k anaerobní komoře a Kathy Coyne za přístup k HPLC. Tento projekt byl podpořen granty National Science Foundation pro Barbaru J. Campbell a S. Craiga Caryho (EF-0333203), Barbaru J. Campbell (DEB-0640414), Barbaru J. Campbell a Thomase E. Hansona (MCB-0950691) a Martina G. Klotzovi (MCB-0948202/1202648), grantem EPSCoR RII-2 pro University of Delaware (EPS-0814251) a motivačními prostředky poskytnutými University of North Carolina Martinu G. Klotzovi.
Kern, M., a Simon, J. (2009). Elektronové transportní řetězce a bioenergetika respiračního metabolismu dusíku u Wolinella succinogenes a dalších Epsilonproteobakterií. Biochim. Biophys. Acta 1787, 646-656. doi: 10.1016/j.bbabio.2008.12.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lindsey, G. A., and Rhines, C. M. (1932). The production of hydroxylamine by the reduction of nitrates and nitrites by various pure cultures of bacteria (Produkce hydroxylaminu redukcí dusičnanů a dusitanů různými čistými kulturami bakterií). J. Bacteriol. 24, 489-492.
Pubmed Abstract | Pubmed Full Text
Loferer-Krossbacher, M., Klima, J., and Psenner, R. (1998). Stanovení suché hmotnosti bakteriálních buněk transmisní elektronovou mikroskopií a denzitometrickou analýzou obrazu. Appl. Environ. Microbiol. 64, 688-694.
Pubmed Abstract | Pubmed Full Text
.