Introduction
Nitrate is the major fixed nitrogen pool in global N-cycle (Falkowski and Godfrey, 2008; Klotz and Stein, 2008). 硝酸塩は脱窒により亜酸化窒素や二窒素ガスに還元され,陸上や水中の生態系から失われるか,アンモニウム化により保持される (Brandes et al., 2007; Klotz and Stein, 2008, 2010)。 どちらの経路でも、硝酸塩は亜硝酸塩に還元される。 従属栄養の脱窒菌とアンモニア酸化菌では、亜硝酸塩はNO生成亜硝酸塩還元酵素によってさらに還元される。 NirSまたはNirKによってさらに還元される。 亜硝酸塩からアンモニウムへの還元は、同化型(NirB/NirA)または呼吸型(NrfA)のアンモニア生成亜硝酸還元酵素によって触媒される(Klotz and Stein, 2008, 2010)。 アンモニアを酸化するケモリソトロフとメタン栄養生物は、ヒドロキシルアミンの酸化によってNOを形成することもでき、これも陸上および水中生態系における窒素損失の潜在的経路である(Campbell et al.、2011年)。 硝酸塩を呼吸に利用したり、窒素の唯一の供給源として成長することができるいくつかのε-プロテオバクテリアは、どちらのタイプの亜硝酸塩還元酵素もコードしていないことから、これらの生物はアンモニウムに還元する未認識のメカニズムを持っていることが示唆される。
ゲノムアノテーションによると、Nautilia profundicolaだけでなく、ε-プロテオバクテリアの中のいくつかの病原性カンピロバクター属は、成長のための窒素源として、あるいは末端電子受容体として、硝酸塩を利用する可能性があることが示されています。 N. profundicolaは、ε-プロテオバクテリアの最深部分岐系統のメンバーであり (Campbell et al., 2006; Smith et al., 2008) 、その近縁種は深海の熱水噴出孔環境でのみ発見されてきた。 一方、カンピロバクター属細菌は、一般的に動物宿主に関連し、他の環境での存在は不明確である。 N. profundicola、Campylobacter concisus、C. curvus、C. fetusのゲノムには、ペリプラズムのモリブドプテリングアニンジヌクレオチド結合型硝酸還元酵素複合体(NAP)をコードする遺伝子はあるものの、アンモニウムまたはNO形成型亜硝酸還元酵素をコードする遺伝子は存在しない。 また、N. profundicolaのゲノムにはnapC/cycB遺伝子が同定されたが(Campbell et al., 2009)、これはε-proteobacteriaのNAP複合体は通常NapCタンパク質を欠いているため、異例である(Kern and Simon, 2009; Klotz and Stein, 2010; Simon and Klotz, 2013)。 ゲノム情報に基づく代謝再構築(Campbell et al., 2009)に基づき、我々は最近、亜硝酸塩がヒドロキシルアミン:ユビキノンレドックスモジュール(HURM、すなわちキノン依存性のヒドロキシルアミン脱水素酵素)によりヒドロキシルアミンに還元される新規硝酸同化経路(図1)、すなわち逆HURM経路と呼ぶ経路を提案した。 N. profundicolaでは、HURMはキノンプールとペリプラズムのヒドロキシルアミン酸化還元酵素(HAO、NAMH_1280)の間の電子伝達を仲介するNapC/NrfH関連シトクロムcM552(cycB、NAMH_0559)からなると考えられている。 HURMは、ヒドロキシルアミンデヒドロゲナーゼ(EC:1.7.2.6; HaoA3)とシトクロムcタンパク質電子シャトル(それぞれcycAとcycBがコードするc554とcM552)からなり、好気性アンモニア酸化細菌においてヒドロキシルアミン酸化をキノンプールに繋げる(Klotz と Stein, 2008; Simon と Klotz, 2013)。 嫌気性アンモニア酸化細菌(anammox)では、ヒドラジン酸化還元酵素とまだ同定されていないチトクロムcからなる酸化還元モジュールが存在する(Jetten et al.) 逆HURM経路では、ペリプラズムで亜硝酸塩から生成されたヒドロキシルアミンが細胞質に運ばれ、ハイブリッドクラスタータンパク質(Har/Hcp)とも呼ばれるヒドロキシルアミン還元酵素を介してアンモニウムに還元される。 このように、逆HURM経路の電子受容反応として提案されているのは:
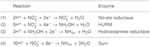
図1
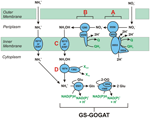
Figure1. N. profundicolaの逆HURM経路。 図中、個々のステップを大文字で記した。 描かれたタンパク質中の数字はAmHゲノムの遺伝子座タグを指す(すなわち、1280 = NAMH_1280 = HaoA)。 (A)呼吸性ペリプラズム硝酸還元酵素(NapABGH、0556-53)による硝酸塩還元、(B)HURM(Hydroxylamine:ヒドロキシルアミン酸化還元酵素(HaoA, 1280)がocataheme型亜硝酸還元酵素として機能し、NapC/NrfH/cm552ファミリー(CycB, 0559)のテトラヘムシトクロムcから供与される電子を用いてヒドロキシルアミンを生産する逆作動型ヒドロキシルアミンレドックスモジュール(Ubiquinone Redox Module)から構成されます。 (C) AmtBに関連するアンモニア輸送体を介したヒドロキシルアミンの輸送。 (D) 電子供与体(X)が不明なFe-S含有タンパク質(1302)の還元力を利用したハイブリッドクラスタータンパク質/ヒドロキシルアミン還元酵素 (Hcp/Har, 1074) によるヒドロキシルアミンからアンモニアへの還元作用。 アンモニウムのバイオマスへの同化は、グルタミン合成酵素とグルタミン:2-オキソグルタル酸アミノトランスフェラーゼ(GS-GOGAT)を介して行われる。
N. profundicola, C. concisus, C. curvus, C. fetus、Caminibacter mediatlanticusはそれぞれ逆HURM経路の酵素をコードする遺伝子を含んでおり、他のε-プロテオバクテリアのゲノムには古典的なNO形成NirS/NirK、アンモニウム形成同化siroheme NirA、または呼吸性pentaheme NrfA亜硝酸還元酵素のホモログがコードされている 。 我々は、逆HURM経路が、アンモニウム不足の宿主または非宿主関連環境におけるN. profundicolaとCampylobacter属の生存および/または分散を改善すると仮定している。 しかし、この仮説が成り立つためには、逆HURM経路がこれらの生物において生合成のためのアンモニウムを提供し、および/またはエネルギー保存を促進しなければならない。

Table 1. N. profundicolaの成長のエネルギー学
N. profundicolaはエネルギー代謝にギ酸および水素を電子供与体として利用し、通常、電子受容体として多硫化物を用いて成長する(Campbell et al, 2001; Smith et al., 2008)。 標準条件下での計算(全種 1 M、25℃、pH = 7)では、硝酸塩が逆 HURM 経路の反応によって還元されるとき、ギブス自由エネルギー(Δ G°)はポリスルフィドの還元から得られるものよりかなり大きい(表 2)。 例えば、硝酸塩で酸化されたギ酸1モルあたりのΔG°は、ポリスルフィドに比べて7.4倍大きい(-237 kJ mol-1 vs -32 kJ mol-1)。 この計算から、N. profundicolaの成長は、電子受容体として硝酸塩を用いた培養では、ポリスルフィドに比べて刺激されるはずであると予測できる。 窒素化合物とポリスルフィドの電子受容性半反応、およびギ酸または水素を電子供与体とする結合反応について、標準条件(全種1M、25℃、pH=7)で計算した反応自由エネルギー。
Growth of N. profundicola with Nitrate
Prior characterization and growth of N. profundicola utilizes media as polysulfide as combined sulfur source and electron acceptor (Campbell et al, 2001, 2009; Smith et al.、2008)。 N. profundicola のエネルギー代謝における硝酸塩の役割をさらに明らかにするため、AmH 株を硫化物を唯一の硫黄源とし、硝酸塩を唯一の電子受容体とした培地で培養した(図 2)。 電子供与体は、他の硫黄源や窒素源を含まない培地で、水素とギ酸の混合物であった(Campbell et al.) 硝酸塩を潜在的な電子受容体および窒素源として、硫化物(硫黄源)またはポリサルファイド(硫黄源および潜在的な電子受容体)を用いた成長率は、アンモニウムを唯一の窒素源として、ポリサルファイドを電子受容体と硫黄源として用いた培養で観察される成長率の2倍以上であった。 予想通り、窒素源としてアンモニウムを、硫黄源として硫化物を提供したネガティブコントロール(電子受容体なし)培養物は成長できなかった。
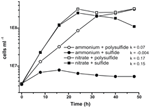
Figure 2. N. profundicolaの電子受容体、窒素化合物、および硫黄源を示しての成長。 成長速度は8時間から24時間の間に測定された;k = 比成長速度定数(h-1)。 各ポイントは2または3の独立した生物学的複製の平均値である。
N. profundicola培養における窒素バランス
N. profundicolaが生産するアンモニウムレベルが生合成必要量を超えていることを確認するために、生合成窒素需要を以下のように計算した。 指数関数的に成長するバクテリオプランクトンのC:N比を32:6.4と仮定し(Vrede et al, 1998)、N. profundicola の細胞体積を 0.021 μm3 とすると、1 × 108 個の細胞を ml-1 で生産するには、約 120 ng ml-1 の窒素(約 9 μM)が必要となり、この数値は利用する窒素源に関係なく変化するものである。 N. profundicolaは、電子受容体としてポリスルフィドを用いた増殖中に供給されたアンモニウムをあまり利用せず(図3、開丸)、これは観察された細胞密度を生み出すために計算された低いN要求量と一致する。 アンモニウムと硫化物を加えた培養液は成長せず(図2)、またアンモニウムを検出可能に消費することもなかった(図3、閉じた円)。 一方、5 mM硝酸塩で培養した細胞が生産したアンモニウムの量は、ポリサルファイドでは4.6 mM、スルフィドでは5.2 mMだった(図3、開いた四角と閉じた四角、それぞれ)。 もしε-プロテオバクテリアの逆HURM経路が主に生合成のためのアンモニウムの生産に役立つのであれば、低レベルの外来アンモニウムがHURM経路の遺伝子発現と硝酸還元活性を強く抑制すると予想された。 しかしながら、予測されるN要求量を超える硝酸塩のアンモニウムへの化学量論的変換と、アンモニウム+ポリサルファイド培養で観察されたアンモニウム消費は、N. profundicolaによって硝酸塩が末端電子受容体として利用され、硝酸アンモニウム化がアンモニウムによる抑制を受けないという仮説と一致する。
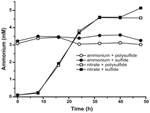
Figure 3. N. profundicolaの培養物において測定されたアンモニウム濃度-指示された電子受容体、窒素化合物、および硫黄源を含む。 各ポイントは2または3の独立した生物学的複製の平均である。
15N-NO-3 バイオマスへの組み込み
硝酸同化の可能性は、上記のすべての電子供与体および潜在的受容体の組み合わせで成長中の N. profundicola バイオマスへの 15N 標識アンモニウムまたは硝酸の組み込みを調べることによって評価された。 20 Atom% 15N 標識アンモニウムとポリサルファイドで増殖した N. profundicola は、1 回のバッチ培養で約 10 Atom% 15N に濃縮したバイオマスを生成した(図 4)が、非標識対照は 15N に濃縮されなかった。 硫化物と20 Atom% 15N標識硝酸塩で培養したところ、16 Atom% 15Nに濃縮されたバイオマスが生成された(図4)。 硝酸塩で成長したバイオマスは、アンモニウムで成長したバイオマスよりも約5倍多くのNを含んでおり(データは示されていない)、これは硝酸塩で成長したサンプルで15Nがより広範囲に濃縮されたことを説明するかもしれない。 N. profundicolaバイオマスへの窒素吸収は、天然存在量(14N)または20 Atom% 15Nで示された窒素化合物5 mMを供給したバッチ培養の1ラウンド後に決定された。 数値は3回の独立した生物学的複製の平均値±標準偏差。
Transcription of Key Pathway Genes
N. profundicolaの提案する逆HURM経路の酵素をコードする遺伝子についての転写量は、アンモニウムまたは硝酸塩で培養したバッチ式培養で定量リアルタイムPCRによって決定された。 硝酸還元酵素サブユニット(napA)をコードするmRNAは、アンモニウム+ポリサルファイド培養細胞に対して、硝酸塩+サルファイド培養細胞で4.6倍(P < 0.05, 両側不均一分散t検定)多く存在していた。 HURMの両成分であるhaoAとcycB/napCの転写はそれぞれ8.5倍と7.1倍に増加した(両者ともP < 0.05)。 HURMによってペリプラズムで生成されたヒドロキシルアミンは主要なファシリテータータンパク質チャネルを通して輸送されるだろうという我々の予測と一致して、アンモニウム/メチルアンモニウム輸送体amtBの両方のホモログをコードするmRNAは4.5倍(amtB-1、NAMH_0397、P < 0.08)および10.3倍(amtB-2、NAMH_0215、P > 0.10)に増加した。 ヒドロキシルアミンは強力な変異原であり、細胞質に到達した時点で無毒化されなければならない。 我々は、Rhodobacter capsulatus E1F1の硝酸塩同化遺伝子群のhcp遺伝子が、細胞質同化型硝酸還元酵素によって生成されるヒドロキシラミンの還元・同化に必要であるという研究に基づいて、これがNADH依存性のHar/Hcpによって達成されると提案した(Cabelloら、2004; Pinoら、2006)。 この提案と一致するように、転写産物量の最大の変化はharで見られ、11.7倍増加した。しかし、この変化は、har転写産物量の独立した測定における高い変動性のため、有意ではなかった(P > 0.10)。 当初、我々はHarの電子供与体はNAMH_0542にコードされるNADHデヒドロゲナーゼであると提案していた(Campbell et al., 2009)。 しかし、現在では、この機能のより良い候補は、他のε-プロテオバクテリアでの保存性に基づいて、4Fe-4Sクラスタータンパク質と予測されるNAMH_1302であると考えている(表1)。 この予想と一致して、NAMH_1302の転写物はアンモニウムに対して硝酸塩で成長した細胞で4.6倍多く存在したが、その変化は有意ではなかった(P > 0.10)。 アンモニウム+ポリサルファイド(黒棒)、硝酸塩+サルファイド(白棒)、またはアンモニウム添加後の硝酸塩+ポリサルファイドで生育したN. profundicolaの逆HURM経路の酵素をコードする主要遺伝子の定常mRNAレベル。 転写量は蛍光RT-PCRで決定し、各サンプルで決定した16S rRNA量に正規化した。 数値は3つの独立した生物学的複製の平均値±標準偏差である。
経路発現のアンモニウム抑制の可能性を調べるために、硝酸塩+硫化物栽培培養にアンモニウムを加え、同じ遺伝子についてmRNA存在量を定量した。 一般に、アンモニウム添加は逆HURM経路をコードする遺伝子のmRNA存在量を1.2倍から3.6倍減少させたが(図5、灰色の棒)、この効果はHURMサブユニットをコードするhaoAとnapC/cycB転写物でのみ有意(P <0.10)であった。 興味深いことに、napAの発現は最も減少が少なく(1.2倍)、これらの細胞では硝酸塩呼吸が必要であることが示された。 また、アンモニウムの添加により、アンモニウム+ポリサルファイドで培養した場合に見られるような転写レベルの低下は見られなかった。
ヒドロキシルアミンがN. profundicolaによって代謝され得るかどうかを決定するために、硝酸塩で成長した細胞の洗浄した懸濁液を、唯一の電子供与体として水素を含む硝酸塩なしの成長培地でインキュベートされた。 ヒドロキシルアミンを電子受容体として添加し、ヒドロキシルアミンとアンモニウムの両濃度を経時的に追跡した。 この実験の結果、N. profundicolaの硝酸塩生育細胞は、ヒドロキシルアミンを迅速かつ完全にアンモニウムに変換することがわかった(図6)。 本実験におけるヒドロキシルアミン変換の比速度は28.6μM min-1 108 cells-1であった。 図3の指数関数的成長(8-24時間)で計算した硝酸塩からのアンモニウム生成速度は〜3μM min-1 (108 cells)-1である。 したがって、測定されたヒドロキシルアミン変換速度は、N. profundicolaが硝酸塩で増殖する際に観察されるアンモニウム生成速度をはるかに超えている。 ヒドロキシルアミンの生産と除去の間の同様の緊密な結合は、化学石器栄養のアンモニア酸化古細菌、Nitrosopumilus maritimusについて最近報告され、ヒドロキシルアミン酸化は必須の異化ステップである(Vajralaら、2013)
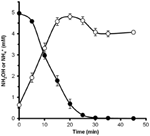
Figure 6.ヒドロキシルアミン酸化は、アンモニア酸化を引き起こす。 ヒドロキシルアミンはN. profundicolaによって急速にアンモニウムに変換される。 静止細胞懸濁液に5mMのヒドロキシルアミンを添加した後,ヒドロキシルアミン(閉じた円)およびアンモニウム(開いた円)の濃度を追跡した。 点は3反復の平均値±標準偏差である。
Discussion
ここに示したデータは、N. profundicola株AmHを有用なモデル系として、古典的NO形成(NirSまたはNirK)またはアンモニウム形成(NirB/NirA)のナイトライト還元酵素がない生物におけるナイトレートの新しい経路と一致するものであった。 亜硝酸塩がペリプラズムでヒドロキシルアミンに還元され、その後、細胞質でアンモニウムに還元される逆HURM経路が提案されている(Campbell et al.、2009)。 この経路は、Har/Hcpの近位電子供与体の候補として、NAMH_1302がコードする4Fe-4S含有タンパク質が予測されるため、若干修正されている(図1)。 NAMH_1302のホモログは、逆HURM経路の他のすべての遺伝子を持つC. concisus (GenBank accession YP_001466207), C. curvus (YP_001408944), C. fetus (YP_892678), C. mediatlanticus (ZP_01871213) に保存されている。 また、NAMH_1302は硝酸塩で培養したN. profundicolaの細胞でアンモニウムに比べて転写量が増加していた。
硝酸塩と亜硝酸塩から化学経路(Rollefson and Oldershaw, 1932)および生物経路(Lindsey and Rhines, 1932)両方から水酸化性アミンが生成することが長く知られ、3複合体が還元剤で供給すると、亜硝酸塩から水酸化性アミンへ還元することがわかっていた(Kostera et al, 2010)、逆HURM経路における亜硝酸塩からのヒドロキシルアミンとアンモニウム生成の比率はまだ明らかではない。 細菌による細胞外ヒドロキシルアミンの取り込みは知られている。外因的に供給されたヒドロキシルアミンはKuenenia stuttgartiensisのアナモクソームに容易に蓄積し(Lindsayら、2001; Schmidtら、2004)、細胞膜とアナモクソームの両方を越えることによってのみ到達できる区画となった。 変異原性の高いヒドロキシルアミンの取り込みが提案されていることから、DNA損傷に対する保護が必要であり、これはN. profundicolaで確認されたDNA修復システムの大規模な補完を部分的に説明できるかもしれない(Campbell et al.、2009年)。 また、ヒドロキシルアミンは、植物や藻類において亜硝酸塩からアンモニウムを生成する際の中間体として提案されており、フェレドキシン依存性亜硝酸還元酵素がこの基質に対して高い反応性と特異性を示すためである (Kuznetsova et al., 2004; Hirasawa et al, アンモニア酸化剤におけるHURMのキノン還元酵素機能(Klotz and Stein, 2008; Simon and Klotz, 2013)とは異なり、N. profundicolaのHURMは、NrfAHと同様に、キノールプールから電子をシャトルしてナイトライトをヒドロキシルアミンに還元するペリプラズムキノール酸化酵素システムとして働くと提唱している。 逆HURM経路は、アナモックス菌のNrfAHとONRアンモニウム化モジュールの共通祖先から進化した可能性がある。 これは、ヒドロキシルアミン不均化を行うことができる共有結合した三量体HaoA複合体を含むHURMが、嫌気性・好気性アンモニア酸化細菌において異化モジュールとして使われる前に起こったと仮定している(Jetten et al.2009; Klotz and Stein, 2010; Campbell et al.2011; Kern et al., 2011; Simon and Klotz, 2013)。 NO還元型チトクロムc’-β(cytS)とNO酸化型チトクロムP460(cytL)についても、共有結合による複合体形成によって還元活性から酸化活性へと機能が反転することが議論されている(Elmore et al.、2007)。 NrfAHモジュールとreverse-HURMモジュールをコードする遺伝子は、C. fetus 82-40というたった一つの細菌ゲノム配列に共存している(表1)。 最近、オクタヘムシトクロムcヒドロキシルアミンデヒドロゲナーゼが窒素・硫黄サイクルに機能するマルチヘムシトクロムcタンパク質スーパーファミリーのメンバーとして進化し、シトクロムcM552 (CycB), NrfH, NapCが別のシトクロムcスーパーファミリーのメンバーであることが示された (Bergmann et al., 2005; Klotz and Stein, 2008; Kern et al., 2011; Simon and Klotz, 2013). また、ε-プロテオバクテリアのNAP複合体は、一般的にNapCサブユニットタンパク質を含まないことが知られている(Klotz et al., 2006; Sievert et al., 2008; Kern and Simon, 2009; Klotz and Stein, 2010; Simon and Klotz, 2013)。 亜硝酸還元酵素-キノール酸化酵素複合体としてのn-cm552(CycB/NapC)複合体の逆機能の提案は、N. profundicola HaoAにおける両方の転写物の存在と重要なチロシンタンパク質リガンドの欠如を考えると、実現可能である(Campbell et al, 4204>
15N同化のデータから、N. profundicolaは、唯一の窒素源として硝酸態窒素が供給された場合、成長中にバイオマスに取り込まれることがわかった。 しかし,硝酸塩からのアンモニウムの生産が生合成の計算値を大きく上回ったことから,N. profundicolaによる硝酸塩からアンモニウムへの還元は,効率的な呼吸電子受容体としての機能が主であると結論づけられた。 この結論は、硝酸塩を唯一の電子受容体とするN. profundicola培養物の成長速度と収量の増加によって支持される。 さらに、遺伝子発現データは、Nap、HURM(3およびcM552)およびHar/Hcpの協調的機能によって、新しい窒素同化およびエネルギー保存経路:逆HURM経路として起こるという我々の提案(Campbellら、2009)と一致した。 最後に、N. profundicolaはヒドロキシルアミンをアンモニウムに迅速に還元する能力を有しており、逆HURM経路の中間体として遊離ヒドロキシルアミンが提案されていることと矛盾しない。 観察されたヒドロキシルアミンの高い取り込み速度は、硝酸塩を用いた培養の成長中に一貫して観察されない理由を説明すると思われる。 安静時細胞における硝酸塩または亜硝酸塩からのアンモニウム生成の予備的測定値は、培養物から計算した3μM min-1 (108 cells)-1速度に類似しており、観察されたヒドロキシルアミン消費速度よりも10倍程度低いものであった。 これらの速度を考えると、ヒドロキシルアミンは硝酸塩で生育する培養物では生成後すぐに消費されるはずである。
N. profundicolaのバッチ培養で15N-NH2OHによるバイオマスの標識が試みられたが、まだ成功していない(データは示されていない)。 バッチ培養におけるヒドロキシルアミンは、毒性を避けるために非標識硝酸塩に対して低濃度で供給されなければならず、ヒドロキシルアミンからのNの大部分はアンモニウムに変換されるべきであることを考えると(図3に基づいて>90%)、この結果は驚くべきことではない。
結論として、ここに示したデータは、N. profundicolaが遊離のヒドロキシルアミン中間体を介して硝酸塩を還元するモデルと一致する。 これらの実験は,N. profundicolaで提唱されている逆HURM活性が,N-オキシド中間体を放出せずに6電子を移動させるアンモニウム形成性亜硝酸還元酵素として機能する可能性をまだ完全に排除してはいない. 未発表の結果では、nrfA遺伝子のわずかな点変異が、ペンタヘムチトクロムc亜硝酸還元酵素を、N酸化中間体を放出し亜硝酸をアンモニウムに定比的に変換できないリーキー酵素にすることができる(Jörg Simon, 私信)。 nrfAとhaoAの進化的関係を考えると(Bergmann et al., 2005; Simon and Klotz, 2013)、N. profundicolaの逆HURMモジュールは、現存するNrfAがアンモニウム産生亜硝酸還元酵素として「漏れなく」働くのに対し、アンモニウムとヒドロキシルアミン産生酵素複合体として自然に機能しているかもしれない。 硝酸塩または亜硝酸塩を基質とするHar/Hcpの阻害剤を全細胞で使用する実験や、in vitro産物を決定するための逆HURM複合体の生化学的研究が、この仮説の直接的な検証をさらに提供するはずである。 具体的なメカニズムはともかく、N. profundicolaが生合成の必要量をはるかに超えるアンモニウムを大量に生産することから、この菌と関連するε-プロテオバクテリアがよく見られる、硝酸塩が豊富でアンモニウムが不足する低酸素環境におけるアンモニウム源として生態的役割を果たす可能性が示唆された。
材料と方法
自由エネルギー計算
ギブス自由エネルギー(表2)は、半反応の標準酸化還元電位からNernst方程式(ΔG0=-nFE0)によって、あるいは文献から収集した半反応自由エネルギーの総和によって計算した(Thauer et al, 1977; van der Star et al., 2008)。 すべての計算は標準的な条件(1M all species, 25°C, pH = 7)で行った。
培養と窒素化合物の分析
N. profundicola strain AmH (ATCC BAA-1463) は既報と同様に培養して細胞を数えた (Smith et al., 2008; Campbell et al., 2009)。 培養上清中のアンモニウムは、塩化ダンシルで誘導体化し、蛍光検出付きHPLCで分離した後に定量した(Shakila et al.、2001)。 硝酸塩は、UV/Vis 検出による HPLC で定量した。 ヒドロキシルアミン濃度はFrear and Burrell (1955)の記載に従って培養ろ液(0.2μm)で測定した。
15N Labeling Procedures
20 Atom% 15N-硝酸塩および15N-アンモニウムのストック溶液は>99 Atom%および天然存在比塩を混合して、最終濃度の5 mM硝酸またはアンモニウムで必要なだけ培地を準備することによって作製された。 15N標識培養物から遠心分離により細胞を採取し、細胞ペレットをナノ純水で3回洗浄し、塩類を除去した。 細胞懸濁液をスズカプセルで乾燥させ、カリフォルニア大学デービス校安定同位体研究所に送り、同位体比質量分析で15N Atom %を決定した。 対照試料は、試料処理中に同位体汚染が起こらなかったことを示した(データは示さず)。
Quantitative PCR
N. profundicolaから抽出した総RNA中のmRNA存在量の定量に、遺伝子特異的プライマー(表3)を以前に記載したように使用した(Campbell et al…)。 2009)。
TABLE 3

Table 3.遺伝子特異的プライマー(Table 3)を用いて、N. profundicolaから抽出したtotal RNAのmRNA量を既述の方法で定量した(Campbell et al. N. profundicolaから抽出したtotal RNAサンプルにおける特定遺伝子のQ-RT-PCR定量用プライマーと条件
Hydroxylamine Uptake
N. profundicolaを電子供与体としてH2およびギ酸、電子受容体は硝酸で指数期後半まで増殖させた。 細胞は遠心分離により採取した。 すべての移植と細胞洗浄はCoy Laboratoriesの嫌気性チャンバーで行った。 細胞は硝酸塩を含まない成長培地で最終濃度〜109細胞ml-1に再懸濁し、嫌気的に調製したストック溶液からヒドロキシルアミン(最終濃度5mM)を添加する前に80%H2+20%CO2の雰囲気下で45℃で2時間インキュベートされた。 細胞懸濁液のアリコートを濾過し、ヒドロキシルアミンについては上記のように、アンモニウムについてはジエチルエトキシメチレンマロネートで誘導体化した後にHPLCでアッセイした(Gómez-Alonso et al, 4204>
Author Contributions
Thomas E. Hanson, Barbara J. Campbell, and Martin G. Klotz collaboratively designed experiments and interpret results, Thomas E. Hanson performed all nitrogen compound analyses and prepare samples for mass spectrometry, Barbara J. Campbell grew all cultures and perform quantitative PCR, Katie M. Kalis performed hydroxylamine uptake experiments, Mark A. Campbell identified NAMH_1302 as a relevant gene.共同研究で、NYKのヒドロキシラミン取り込み実験に参加した。 この論文はThomas E. Hansonが起草し、その後Thomas E. Hanson, Barbara J. Campbell, Martin G. Klotzが修正した。
利益相反声明
著者は、本研究が利益相反の可能性として解釈できるいかなる商業または財務上の関係もなく行われたことを宣言する。
謝辞
著者らは、原稿を批判的に読んでくれた Lisa Y. Stein (Univ. Alberta-Edmonton), Jenn Macalady (Penn State Univ.), David Kirchman and Matt Cottrell (Univ. Delaware), 嫌気槽の利用について Jennifer Biddle, HPLCについてKathy Coyneに感謝の意を表したい。 このプロジェクトは,全米科学財団からBarbara J. CampbellとS. Craig Cary (EF-0333203), Barbara J. Campbell (DEB-0640414), Barbara J. Campbell and Thomas E. Hanson (MCB-0950691), Martin G. (MCB-0950691)への助成金を得て行われました. Klotz (MCB-0948202/1202648), デラウェア大学へのEPSCoR RII-2 grant (EPS-0814251), およびノースカロライナ大学から Martin G. Klotz への奨励金によって行われた。
Kern, M., およびSimon, J. (2009). Wolinella succinogenes および他の Epsilonproteobacteria における呼吸性窒素代謝の電子輸送鎖と生体エネルギー。 Biochim. Biophys. Acta 1787, 646-656. doi: 10.1016/j.bbabio.2008.12.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lindsey, G. A., and Rhines, C. M. (1932). 種々の純粋培養細菌による硝酸塩および亜硝酸塩の還元によるヒドロキシルアミンの生産. J. Bacteriol. 24, 489-492.
Pubmed Abstract | Pubmed Full Text
Loferer-Krossbacher, M., Klima, J., and Psenner, R. (1998). 透過型電子顕微鏡とデンシトメトリー画像解析による細菌細胞乾燥質量の決定。 Appl. Environ. Microbiol. 64, 688-694.
Pubmed Abstract | Pubmed Full Text
.