Introduktion
Nitrat er en af de største mængder fastgjort kvælstof i den globale N-cyklus (Falkowski og Godfrey, 2008; Klotz og Stein, 2008). Nitrat kan reduceres via denitrifikation til lattergas eller dinitrogengas, hvorved det forsvinder fra terrestriske og akvatiske økosystemer, eller via ammonificering til ammonium, som kan tilbageholdes (Brandes et al., 2007; Klotz og Stein, 2008, 2010). I begge forløb reduceres nitrat til nitrit. I heterotrofe denitrifikationssystemer og ammoniakoxidatorer reduceres nitrit yderligere af NO-dannende nitritreduktaser: NirS eller NirK. Nitritreduktion til ammonium katalyseres af assimilatorisk (NirB/NirA) eller respiratorisk (NrfA) ammoniakdannende nitritreduktase (Klotz og Stein, 2008, 2010). Ammoniak-oxiderende kemolithotrofer og methanotrofer kan også danne NO ved oxidation af hydroxylamin, som er en anden potentiel rute for kvælstoftab i terrestriske og akvatiske økosystemer (Campbell et al., 2011). Flere Epsilonproteobakterier, der er i stand til at bruge nitrat til respiration og/eller som eneste kvælstofkilde til vækst, koder ikke for homologer af nogen af nitritreduktase-typerne, hvilket tyder på, at disse organismer besidder en uerkendt mekanisme til nitritreduktion til ammonium.
Genomannotation indikerer, at ikke kun Nautilia profundicola, men også flere patogene Campylobacter spp. blandt Epsilonproteobakterierne kan udnytte nitrat som en kvælstofkilde til vækst og/eller som en terminal elektronacceptor. N. profundicola er medlem af den dybeste forgrenede linje af Epsilonproteobakterierne (Campbell et al., 2006; Smith et al., 2008), og dens slægtninge er kun fundet i hydrotermiske slamslukningsmiljøer i dybhavet. Campylobacter spp. er derimod typisk associeret med animalske værter, og deres tilstedeværelse i andre miljøer er dårligt defineret. Mens genomerne af N. profundicola, Campylobacter concisus, C. curvus og C. fetus indeholder gener, der koder for et periplasmatisk molybdopterin-guanin-dinukleotid-linked nitratreduktase-kompleks (NAP), er der ingen gener, der koder for hverken ammonium- eller NO-dannende nitritreduktaser. Desuden blev der identificeret et napC/cycB-gen i genomet af N. profundicola (Campbell et al., 2009), hvilket er usædvanligt, da NAP-komplekset i Epsilonproteobakterier normalt mangler et NapC-protein (Kern og Simon, 2009; Klotz og Stein, 2010; Simon og Klotz, 2013). Baseret på genominformeret metabolisk rekonstruktion (Campbell et al., 2009) foreslog vi for nylig en ny vej til nitratassimilation (Figur 1), hvorved nitrit reduceres til hydroxylamin af et hydroxylamin:ubiquinon redoxmodul (HURM, dvs. en quinonafhængig hydroxylamin dehydrogenase), som vi kalder den omvendte HURM-vej. I N. profundicola menes HURM at bestå af et NapC/NrfH-relateret cytochrom cM552 (cycB, NAMH_0559), der formidler elektronoverførsel mellem kinonpuljen og en periplasmatisk hydroxylaminoxidoreduktase (HAO, NAMH_1280). HURM, der opererer i fremadgående retning og består af hydroxylamindehydrogenase (EC:1.7.2.6; HaoA3) forbundet med en cytochrom c-proteinelektronskifter (c554 og/eller cM552, der er kodet af henholdsvis cycA og cycB), forbinder oxidationen af hydroxylamin med kinonpuljen i aerobe ammoniak-oxiderende bakterier (Klotz og Stein, 2008; Simon og Klotz, 2013). I anaerobe ammoniak-oxiderende (anammox) bakterier består redoxmodulet af hydrazin oxidoreduktase og et endnu uidentificeret cytochrom c (Jetten et al., 2009; Simon og Klotz, 2013). I den omvendte HURM-vej transporteres hydroxylamin, der dannes fra nitrit i periplasmaet, ind i cytoplasmaet og reduceres til ammonium via en hydroxylaminreduktase, også kendt som hybridklyngeprotein (Har/Hcp). De foreslåede elektronaccepterende reaktioner i den omvendte HURM-vej er således:
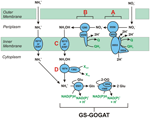
Figuren 1. Den omvendte HURM-vej i N. profundicola. De enkelte trin er angivet med store bogstaver i figuren. Numre i de afbildede proteiner henviser til locus-tags fra AmH-genomet (dvs. 1280 = NAMH_1280 = HaoA). (A) Nitratreduktion ved respiratorisk periplasmatisk nitratreduktase (NapABGH, 0556-53), (B) HURM (Hydroxylamin:Ubiquinone Redox Module) bestående af en omvendt virkende hydroxylamin oxidoreduktase (HaoA, 1280), der fungerer som en ocataheme nitritreduktase, der producerer hydroxylamin ved hjælp af elektroner, der doneres fra et tetraheme cytochrom c i NapC/NrfH/cM552-familien (CycB, 0559). (C) Transport af hydroxylamin via ammoniaktransportører, der er beslægtet med AmtB. (D) Reduktion af hydroxylamin til ammonium ved hjælp af et hybrid klyngeprotein/hydroxylaminreduktase (Hcp/Har, 1074), der udnytter reducerende kraft fra et forudsagt Fe-S-holdigt protein (1302), hvis elektrondonor (X) i øjeblikket er ukendt. Assimilation af ammonium i biomasse sker via glutaminsyntetase og glutamin:2-oxoglutarataminotransferase (GS-GOGAT).
Genomerne af N. profundicola, C. concisus, C. curvus, C. curvus, C. fetus og Caminibacter mediatlanticus indeholder hver især gener, der koder for enzymerne i den omvendte HURM-vej, mens genomerne af andre Epsilonproteobakterier koder for homologer af de klassiske NO-dannende NirS/NirK og ammoniumdannende assimilatoriske siroheme NirA, eller respiratoriske pentaheme NrfA nitritreduktaser . Vi antager, at den omvendte HURM-vej forbedrer overlevelsen og/eller spredningen af N. profundicola og Campylobacter spp. i ammoniumfattige værtsmiljøer eller miljøer, der ikke er associeret med værtsmiljøer. For at denne hypotese kan være sand, skal den omvendte HURM-vej imidlertid tilvejebringe ammonium til biosyntese og/eller lette energibesparelsen i disse organismer.

Tabel 1. Genopgørelser for kvælstofmetabolisme i genom-sekventerede Epsilonproteobakterier.
Resultater
Energetik af vækst i N. profundicola
N. profundicola udnytter både formiat og hydrogen som elektrondonorer til energimetabolisme og dyrkes typisk på polysulfid som elektronacceptor (Campbell et al, 2001; Smith et al., 2008). Beregninger under standardbetingelser (1 M af alle arter, 25°C, pH = 7) viser, at når nitrat reduceres ved reaktionerne i den omvendte HURM-vej, er den frie Gibbs-energi (Δ G°) væsentligt større end den, der er tilgængelig ved reduktion af polysulfid (tabel 2). For eksempel er Δ G° pr. mol formiat, der oxideres med nitrat, 7,4 gange større end for polysulfid (-237 kJ mol-1 vs. -32 kJ mol-1). Ud fra denne beregning kan man forudsige, at væksten af N. profundicola bør stimuleres i kulturer med nitrat som elektronacceptor i forhold til polysulfid.
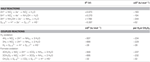
Tabel 2. Beregnede frie reaktionsenergier under standardbetingelser (1 M alle arter, 25 °C og pH = 7) for elektronacceptorhalveringsreaktioner af kvælstofforbindelser og polysulfid og koblede reaktioner med formiat eller hydrogen som elektrondonor.
Vækst af N. profundicola med nitrat
Prior karakterisering og vækst af N. profundicola udnyttede medier med polysulfid som en kombineret svovlkilde og elektronacceptor (Campbell et al, 2001, 2009; Smith et al., 2008). For yderligere at klarlægge nitratets rolle i N. profundicolas energimetabolisme blev stamme AmH dyrket med sulfid som eneste svovlkilde, således at nitrat var den eneste elektronacceptor (figur 2). Elektrondonoren var en blanding af hydrogen og formiat i et medium uden andre svovl- eller kvælstofkilder (Campbell et al., 2001). Vækstraterne med nitrat som potentiel elektronacceptor og kvælstofkilde og sulfid (svovlkilde) eller polysulfid (svovlkilde og potentiel elektronacceptor) var mere end dobbelt så høje som de vækstrater, der blev observeret i kulturer med ammonium som den eneste kvælstofkilde og polysulfid som elektronacceptor og svovlkilde. Som forventet kunne negative kontrolkulturer (ingen elektronacceptor), der fik ammonium som kvælstofkilde og sulfid som svovlkilde, ikke vokse.
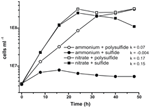
Figur 2. Vækst af N. profundicola med angivne elektronacceptorer, kvælstofforbindelser og svovlkilder. Væksthastighederne blev bestemt mellem 8 og 24 timer; k = specifik væksthastighedskonstant (h-1). Hvert punkt er gennemsnittet af 2 eller 3 uafhængige biologiske replikater.
Stikstofbalance i N. profundicola-kulturer
For at bekræfte, at niveauet af ammonium produceret af N. profundicola var højere end biosyntetiske behov, beregnede vi det biosyntetiske kvælstofbehov som følger. Under forudsætning af et C:N-forhold på 32:6,4 for eksponentielt voksende bakterioplankton (Vrede et al., 2002), 288 fg C μm-3 for eksponentielt voksende Escherichia coli (Loferer-Krossbacher et al., 1998) og et cellevolumen på 0,021 μm3 beregnet ud fra de rapporterede dimensioner for N. profundicola (Smith et al., 2008), kræver produktionen af 1 × 108 celler ml-1 ~120 ng ml-1 N (~9 μM), et tal, der ikke ville ændre sig uanset den anvendte N-kilde. N. profundicola udnyttede ikke en betydelig mængde af den ammonium, der blev tilført under vækst med polysulfid som elektronacceptor (figur 3, åbne cirkler), hvilket stemmer overens med det lave N-behov, der er beregnet til at producere de observerede celletætheder. Kulturen med ammonium plus sulfid voksede ikke (figur 2) og forbruge heller ikke ammonium i påviselig grad (figur 3, lukkede cirkler). I modsætning hertil var mængden af ammonium produceret af celler dyrket med 5 mM nitrat 4,6 mM med polysulfid og 5,2 mM med sulfid (figur 3, henholdsvis åbne og lukkede firkanter). Hvis den omvendte HURM-vej i Epsilonproteobakterierne primært tjener til at producere ammonium til biosyntese, ville vi forvente, at lave niveauer af eksogent ammonium ville kraftigt undertrykke HURM-vejens genekspression og nitratreduktionsaktivitet. Den stoikiometriske omdannelse af nitrat til ammonium ud over det forudsagte N-behov og det observerede ammoniumforbrug i ammonium + polysulfidkulturerne er imidlertid i overensstemmelse med hypotesen om, at nitrat udnyttes som en terminal elektronacceptor af N. profundicola, og at nitratammonificering ikke er underlagt repression af ammonium.
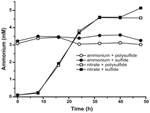
Figur 3. Ammoniumkoncentrationer målt i kulturer af N. profundicola indeholdende de angivne elektronacceptorer, kvælstofforbindelser og svovlkilder. Hvert punkt er gennemsnittet af 2 eller 3 uafhængige biologiske gentagelser.
15N-NO-3 inkorporering i biomasse
Potentialet for nitratassimilation blev vurderet ved at undersøge inkorporeringen af 15N-mærket ammonium eller nitrat i N. profundicola-biomasse under vækst med alle ovennævnte kombinationer af elektrondonorer og potentielle acceptorer. N. profundicola dyrket på 20 atom% 15N-mærket ammonium med polysulfid producerede biomasse beriget til ~10 atom% 15N efter en runde batchkultur (figur 4), mens den umærkede kontrol ikke var beriget med 15N. Kulturer dyrket med sulfid og 20 atom% 15N-mærket nitrat gav biomasse, der var beriget til 16 atom% 15N (figur 4). Nitratdyrket biomasse indeholdt ca. 5 gange mere N end ammoniumdyrket biomasse (data ikke vist), hvilket kan forklare den mere omfattende berigelse af 15N i de nitratdyrkede prøver.
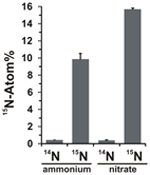
Figur 4. Kvælstofoptagelse i N. profundicola-biomasse bestemt efter en runde batchkultur med 5 mM af de angivne kvælstofforbindelser tilført i naturlig mængde (14N) eller med 20 atom% 15N. Værdierne er gennemsnit af 3 uafhængige biologiske replikater ± standardafvigelsen.
Transkription af nøglegenerne for den omvendte HURM-vej i N. profundicola blev bestemt ved kvantitativ realtids-PCR i batchkulturer, der er dyrket med ammonium eller nitrat. Alle komponenter af den foreslåede vej viste en stærk stigning i transkriptoverflod i nitratvoksede kulturer (figur 5). mRNA’er, der koder for en nitratreduktaseunderenhed (napA), var 4,6 gange (P < 0,05, tosidet heteroscedastisk t-test) mere rigelige i nitrat + sulfidvoksede celler i forhold til ammonium + polysulfidvoksede celler. Transskriptioner af begge komponenter af HURM, haoA og cycB/napC, blev forøget med henholdsvis 8,5 og 7,1 gange (P < 0,05 for begge). I overensstemmelse med vores forudsigelse om, at hydroxylamin produceret i periplasmaet af HURM ville blive transporteret gennem større facilitatorproteinkanaler, blev mRNA’er, der kodede for begge homologer af ammonium/methylammoniumtransporteren amtB, forøget med 4,5 gange (amtB-1, NAMH_0397, P < 0,08) og 10,3 gange (amtB-2, NAMH_0215, P > 0,10). Hydroxylamin er et kraftigt mutagen, der skal detoxificeres, når det ankommer i cytoplasmaet. Vi foreslår, at dette udføres af NADH-afhængig Har/Hcp baseret på undersøgelser af hcp-genet i nitratassimileringsgenklyngen af Rhodobacter capsulatus E1F1, hvor det er påkrævet for reduktion og assimilering af hydroxylamin produceret af en cytoplasmatisk assimilatorisk nitratreduktase (Cabello et al., 2004; Pino et al., 2006). I overensstemmelse med dette forslag blev den største ændring i transkriptoverflod set for har, som steg med 11,7 gange, men denne ændring var ikke signifikant (P > 0,10) på grund af den store variabilitet i uafhængige målinger af har-transkriptoverflod. Oprindeligt havde vi foreslået, at elektrondonoren til Har var en NADH-dehydrogenase, der var kodet af NAMH_0542 (Campbell et al., 2009). Vi mener imidlertid nu, at en bedre kandidat til denne funktion er NAMH_1302, et forudsagt 4Fe-4S-klyngeprotein, baseret på bevarelse i andre Epsilonproteobakterier (tabel 1). I overensstemmelse med denne forudsigelse var transkript af NAMH_1302 4,6 gange mere abundant i nitratvoksede celler i forhold til ammonium, men ændringen var ikke signifikant (P > 0,10).
FIGUR 5
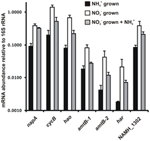
Figur 5. Steady state mRNA-niveauer for nøglegener, der koder for enzymer i den omvendte HURM-bane i N. profundicola dyrket med ammonium + polysulfid (sorte søjler), nitrat + sulfid (hvide søjler) eller nitrat + polysulfid efter tilsætning af ammonium. Transkriptoverfladen blev bestemt ved fluorescerende RT-PCR og normaliseret i forhold til 16S rRNA-overfladen bestemt i hver prøve. Værdierne er gennemsnit af 3 uafhængige biologiske replikater ± standardafvigelsen.
For at teste for potentiel ammonium-repression af ekspression af ekspressionsveje blev der tilsat ammonium til nitrat + sulfid-dyrkede kulturer, og mRNA-overfladen blev kvantificeret for de samme gener. Generelt faldt ammoniumtilsætning mRNA-abundanserne af de omvendt HURM-bane-kodende gener fra 1,2 til 3,6 gange (figur 5, grå søjler), selv om denne effekt kun var signifikant (P < 0,10) for haoA- og napC/cycB-transskriptioner, der koder for HURM-underenhederne. Interessant nok faldt ekspressionen af napA mindst (1.2-fold), hvilket indikerer behovet for nitratrespiration i disse celler. I intet tilfælde reducerede tilsætningen af ammonium transkriptniveauerne til dem, der blev set i kulturer dyrket i ammonium + polysulfid.
Evidens for et hydroxylaminintermediat
Direkte målinger af hydroxylamin i filtrater af N. profundicola-kulturer dyrket med nitrat fandt lave, men konsekvent påviselige niveauer af hydroxylamin (5,7 ± 3,5 μM, SD, n = 3). Dette lave niveau er i overensstemmelse med et mellemprodukt, hvis produktions- og forbrugshastigheder er nøje afstemt.
For at bestemme, om hydroxylamin kunne metaboliseres af N. profundicola, blev vaskede suspensioner af nitratvoksede celler inkuberet i nitratfrit vækstmedium med hydrogen som den eneste elektrondonor. Hydroxylamin blev tilsat som en potentiel elektronacceptor, og koncentrationerne af både hydroxylamin og ammonium blev fulgt over tid. Resultaterne af dette forsøg viser, at nitratvoksede celler af N. profundicola hurtigt og fuldstændigt omdanner hydroxylamin til ammonium (figur 6). Den specifikke hastighed for hydroxylaminomdannelsen i dette forsøg var 28,6 μM min-1 108 celler-1. Den ammoniumproduktionshastighed fra nitrat, der er beregnet for eksponentiel vækst i figur 3 (8-24 timer), er ~3 μM min-1 (108 celler)-1. Den målte hydroxylaminomdannelseshastighed er således langt større end den ammoniumproduktionshastighed, der er observeret under vækst af N. profundicola med nitrat. En tilsvarende tæt kobling mellem hydroxylaminproduktion og -fjernelse blev for nylig rapporteret for den kemolithotrofe ammoniak-oxiderende arkæon, Nitrosopumilus maritimus, hvor hydroxylaminoxidation er et væsentligt katabolisk trin (Vajrala et al., 2013).
FIGUR 6
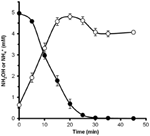
Figur 6. Hydroxylamin omdannes hurtigt til ammonium af N. profundicola. Koncentrationerne af hydroxylamin (lukkede cirkler) og ammonium (åbne cirkler) blev fulgt efter tilsætning af 5 mM hydroxylamin til en hvilende cellesuspension. Punkterne er middelværdierne fra tre gentagelser ± standardafvigelsen.
Diskussion
De data, der præsenteres her, er i overensstemmelse med en ny vej for nitratreduktion i organismer, der mangler klassiske NO-dannende (NirS eller NirK) eller ammoniumdannende (NirB/NirA) nitritreduktaser med N. profundicola stamme AmH som et nyttigt modelsystem. Der er blevet foreslået en omvendt HURM-vej, hvorved nitrit reduceres til hydroxylamin i periplasmaet og efterfølgende reduceres til ammonium i cytoplasmaet (Campbell et al., 2009). Den oprindelige vej er her blevet ændret en smule for at inkludere en mere sandsynlig kandidat til den proximale elektrondonor til Har/Hcp, et forudsagt 4Fe-4S-holdigt protein, der er kodet af NAMH_1302 (figur 1). Homologer af NAMH_1302 er bevaret i C. concisus (GenBank accession YP_001466207), C. curvus (YP_001408944), C. fetus (YP_892678) og C. mediatlanticus (ZP_01871213), som har alle de andre gener for den omvendte HURM-vej. Desuden viste NAMH_1302 en stigning i transkriptoverflod i N. profundicola-celler dyrket på nitrat i forhold til ammonium.
Mens produktionen af hydroxylamin fra nitrat og nitrit både via kemiske (Rollefson og Oldershaw, 1932) og biologiske veje (Lindsey og Rhines, 1932) længe har været kendt, og et 3-kompleks blev vist at reducere nitrit til hydroxylamin, når det tilføres reduktant (Kostera et al, 2010), men forholdet mellem hydroxylamin vs. ammoniumproduktion fra nitrit i den omvendte HURM-vej er endnu ikke klarlagt. Optagelsen af ekstracellulær hydroxylamin af bakterier er kendt; exogent tilført hydroxylamin akkumuleres let i anammoxosomet af Kuenenia stuttgartiensis (Lindsay et al., 2001; Schmidt et al., 2004), et rum, som kun kan nås ved at krydse både celle- og anammoxosomemembranen. Den foreslåede optagelse af den stærkt mutagene hydroxylamin kræver beskyttelse mod DNA-læsioner, hvilket delvist kan forklare det omfattende supplement af DNA-reparationssystemer, der er identificeret i N. profundicola (Campbell et al., 2009). Hydroxylamin er også blevet foreslået som et mellemprodukt i ammoniumproduktionen fra nitrit i planter og alger, da ferredoxinafhængig nitritreduktase udviser høj reaktivitet og specificitet for dette substrat (Kuznetsova et al., 2004; Hirasawa et al.., 2010).
I modsætning til HURM’s quinonreduktasefunktion i ammoniak-oxidatorer (Klotz og Stein, 2008; Simon og Klotz, 2013) foreslår vi, at HURM i N. profundicola fungerer, i lighed med NrfAH, som et periplasmatisk quinoloxidasesystem, der shuttler elektroner fra quinolpuljen for at reducere nitrit til hydroxylamin. Det er sandsynligt, at den omvendte HURM-vej har udviklet sig fra en fælles forfader til NrfAH- og ONR-ammonificeringsmodulet i anammox-bakterier. Vi antager, at dette skete, før HURM – herunder et kovalent bundet trimerisk HaoA-kompleks, der er i stand til hydroxylamin-disproportionering – blev brugt som et katabolisk modul i både anaerobe og aerobe ammoniak-oxiderende bakterier (Jetten et al., 2009; Klotz og Stein, 2010; Campbell et al., 2011; Kern et al., 2011; Simon og Klotz, 2013). En lignende omvendelse af funktionen fra reducerende til oxiderende aktivitet, der sker ved dannelse af komplekser med kovalente bindinger, er blevet diskuteret for det NO-reducerende cytochrom c’-beta (cytS) og det NO-oxiderende cytochrom P460 (cytL) (Elmore et al., 2007). Gener, der koder for NrfAH- og reverse-HURM-modulerne, eksisterer kun i én bakteriel genomsekvens, C. fetus 82-40 (tabel 1). Det blev for nylig vist, at octaheme cytochrom c hydroxylamin dehydrogenase udviklede sig som et medlem af en multiheme cytochrom c-protein superfamilie med funktioner i kvælstof- og svovlcyklussen, og at cytochrom cM552 (CycB), NrfH og NapC er medlemmer af en anden cytochrom c superfamilie (Bergmann et al., 2005; Klotz og Stein, 2008; Kern et al., 2011; Simon og Klotz, 2013). Det er også kendt, at NAP-komplekser i Epsilonproteobakterier generelt ikke indeholder NapC-underenhedsproteiner (Klotz et al., 2006; Sievert et al., 2008; Kern og Simon, 2009; Klotz og Stein, 2010; Simon og Klotz, 2013). Den foreslåede omvendte funktion af et n-cM552 (CycB/NapC) kompleks som et nitritreduktase-quinoloxidasekompleks er mulig i betragtning af tilstedeværelsen af begge transkriptioner og fraværet af den kritiske tyrosinproteinligand i N. profundicola HaoA (Campbell et al, 2009), som adskiller de N-oxidreducerende NrfA og ONR fra de N-oxidoxiderende HAO-komplekser (Bergmann et al., 2005; Klotz og Stein, 2008; Kern et al., 2011; Simon og Klotz, 2013).
Den 15N-assimileringsdata fastslog, at N. profundicola inkorporerer nitrat-stickstof i biomassen under vækst, når det leveres som den eneste kvælstofkilde. Den store overproduktion af ammonium fra nitrat i forhold til de beregnede krav til biosyntese får os imidlertid til at konkludere, at den primære funktion af nitratreduktion til ammonium hos N. profundicola er, at den er en effektiv respiratorisk elektronacceptor. Denne konklusion understøttes af de øgede vækstrater og udbytter i N. profundicola-kulturer med nitrat som den eneste elektronacceptor. Desuden er genekspressionsdataene i overensstemmelse med vores forslag (Campbell et al., 2009) om, at dette sker via den samordnede funktion af Nap, HURM (3 og cM552) og Har/Hcp som en ny N-assimilations- og energibesparelsesvej: den omvendte HURM-vej. Endelig viser dataene, at N. profundicola har evnen til hurtigt at reducere hydroxylamin til ammonium, hvilket er i overensstemmelse med forslaget om fri hydroxylamin som et mellemprodukt i den omvendte HURM-bane. Den høje hastighed af den observerede hydroxylaminoptagelse forklarer sandsynligvis, hvorfor den ikke konsekvent observeres under vækst af kulturer på nitrat. Foreløbige målinger af ammoniumproduktion fra nitrat eller nitrit i hvilende celler svarer til den 3 μM min-1 (108 celler)-1 hastighed beregnet fra kulturer, ~10 gange lavere end den observerede hydroxylaminforbrugshastighed. I betragtning af disse hastigheder bør hydroxylamin forbruges umiddelbart efter produktionen i kulturer, der vokser på nitrat. Da hydroxylamin er mutagent, antager vi, at dette afspejler tidligere selektivt pres for at opretholde lave hydroxylaminniveauer under vækst.
Mens mærkning af biomasse er blevet forsøgt med 15N-NH2OH i batch N. profundicola-kulturer, har det endnu ikke været en succes (data ikke vist). I betragtning af, at hydroxylamin i batchkultur skal tilføres i lave koncentrationer i forhold til det umærkede nitrat for at undgå toksicitet, og at langt størstedelen af N fra hydroxylamin bør omdannes til ammonium (>90% baseret på figur 3), er dette resultat ikke overraskende. Kortvarige mærkningseksperimenter med meget højere koncentrationer af mærket hydroxylamin som den eneste N-kilde kan endegyldigt fastslå dette punkt.
Konklusionen er, at de her præsenterede data er i overensstemmelse med en model, hvor N. profundicola reducerer nitrat via et frit hydroxylaminintermediat. Disse eksperimenter udelukker endnu ikke helt den mulighed, at den omvendte HURM-aktivitet, der er foreslået i N. profundicola, fungerer som en ammoniumdannende nitritreduktase, der overfører 6 elektroner uden at frigive et N-oxidintermediat. Upublicerede resultater viser, at nogle få punktmutationer i nrfA-genet kan gøre pentaheme cytochrom c nitritreduktase til et utæt enzym, der frigiver N-oxidintermediater og ikke formår at omdanne nitrit stoikiometrisk til ammonium (Jörg Simon, pers. communi.). I betragtning af det evolutionære forhold mellem nrfA og haoA (Bergmann et al., 2005; Simon og Klotz, 2013) kan det omvendte HURM-modul i N. profundicola naturligt fungere som et ammonium- og hydroxylaminproducerende enzymkompleks, mens det eksisterende NrfA fungerer “lækagefrit” som en ammoniumproducerende nitritreduktase. Yderligere eksperimenter, hvor der anvendes inhibitorer af Har/Hcp med nitrat eller nitrit som substrat i hele celler og/eller biokemiske undersøgelser af det omvendte HURM-kompleks for at bestemme in vitro-produktet, bør give yderligere direkte test af denne hypotese. Uanset den specifikke mekanisme tyder N. profundicolas omfattende produktion af ammonium, der langt overstiger det biosyntetiske behov, på, at den og beslægtede Epsilonproteobakterier kan spille en økologisk rolle som ammoniumkilde i nitratrige, ammoniumfattige, hypoxiske miljøer, hvor de er almindeligt forekommende.
Materialer og metoder
Fri energiberegninger
Gibbs frie energier (tabel 2) blev beregnet ud fra standard redoxpotentialer for halvreaktionerne ved hjælp af Nernst-ligningen (Δ G0 = -nFE0) eller ved summation af frie energier for halvreaktionerne indsamlet fra litteraturen (Thauer et al, 1977; van der Star et al., 2008). Alle beregninger blev udført under standardbetingelser (1 M alle arter, 25°C, pH = 7).
Kulturering og analyse af kvælstofforbindelser
N. profundicola stamme AmH (ATCC BAA-1463) blev dyrket, og cellerne blev talt som tidligere beskrevet (Smith et al., 2008; Campbell et al., 2009). Ammonium i kultursupernatanter blev kvantificeret efter derivatisering med dansylchlorid og adskillelse ved HPLC med fluorescensdetektion (Shakila et al., 2001). Nitrat blev kvantificeret ved HPLC med UV/Vis-detektion. Hydroxylamin-koncentrationer blev bestemt i kulturfiltrater (0,2 μm) som beskrevet af Frear og Burrell (1955).
15N-mærkningsprocedurer
Stockopløsninger af 20 atom% 15N-nitrat og 15N-ammonium blev fremstillet ved at blande >99 atom% og naturlige hyppighedssalte for at fremstille medium ved en slutkoncentration på 5 mM nitrat eller ammonium efter behov. Cellerne blev høstet fra 15N-mærkede kulturer ved centrifugering, og cellepellet blev vasket tre gange med nanopur vand for at fjerne salte. Celsuspensionen blev tørret i tinkapsler, som blev sendt til laboratoriet for stabile isotoper på University of California-Davis, hvor 15N Atom % blev bestemt ved hjælp af isotopforholdsmassespektrometri. Kontrolprøver viste, at der ikke var sket nogen isotopkontaminering under prøvebehandlingen (data ikke vist).
Kvantitativ PCR
Gen-specifikke primere (tabel 3) blev anvendt til at kvantificere mRNA-overflod i total RNA ekstraheret fra N. profundicola som tidligere beskrevet (Campbell et al, 2009).
TABEL 3

Tabel 3. Primere og betingelser for Q-RT-PCR-kvantificering af specifikke gener i totale RNA-prøver ekstraheret fra N. profundicola.
Hydroxylaminoptagelse
N. profundicola blev dyrket på H2 og formiat som elektrondonorer og nitrat som eneste elektronacceptor til sen eksponentiel fase. Cellerne blev høstet ved centrifugering. Alle overførsler og cellevaskninger blev udført i et anaerobt kammer fra Coy Laboratories. Cellerne blev resuspenderet med nitratfrit vækstmedium til en slutkoncentration på ~109 celler ml-1 og inkuberet ved 45 °C i 2 timer under en atmosfære af 80 % H2 + 20 % CO2, inden der blev tilsat hydroxylamin (5 mM slutkoncentration) fra en anaerobt fremstillet stamopløsning. Alikvotes af cellesuspensionen blev filtreret og analyseret for hydroxylamin som beskrevet ovenfor og for ammonium ved HPLC efter derivatisering med diethylethoxymethylenemalonat (Gómez-Alonso et al, 2007).
Author Contributions
Thomas E. Hanson, Barbara J. Campbell og Martin G. Klotz har i samarbejde designet eksperimenter og fortolket resultater, Thomas E. Hanson har udført alle analyser af kvælstofforbindelser og forberedt prøver til massespektrometri, Barbara J. Campbell har dyrket alle kulturer og udført kvantitativ PCR, Katie M. Kalis har udført hydroxylaminoptagelseseksperimenter, Mark A. Campbell har identificeret NAMH_1302 som et relevant gen. Thomas E. Hanson udarbejdede papiret, som efterfølgende blev revideret af Thomas E. Hanson, Barbara J. Campbell og Martin G. Klotz.
Interessekonflikter
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller økonomiske relationer, der kunne opfattes som en potentiel interessekonflikt.
Anerkendelser
Forfatterne vil gerne takke Lisa Y. Stein (Univ. Alberta-Edmonton), Jenn Macalady (Penn State Univ.), David Kirchman og Matt Cottrell (Univ. Delaware) for kritisk læsning af udkast til manuskriptet, Jennifer Biddle for adgang til et anaerobt kammer og Kathy Coyne for adgang til en HPLC. Dette projekt blev støttet af bevillinger fra National Science Foundation til Barbara J. Campbell og S. Craig Cary (EF-0333203), Barbara J. Campbell (DEB-0640414), Barbara J. Campbell og Thomas E. Hanson (MCB-0950691), og Martin G. Klotz (MCB-0948202/1202648), af et EPSCoR RII-2 tilskud til University of Delaware (EPS-0814251), og af incitamentmidler fra University of North Carolina til Martin G. Klotz.
Kern, M., og Simon, J. (2009). Elektrontransportkæder og bioenergetik i respiratorisk kvælstofmetabolisme i Wolinella succinogenes og andre Epsilonproteobakterier. Biochim. Biophys. Acta 1787, 646-656. doi: 10.1016/j.bbabio.2008.12.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lindsey, G. A., og Rhines, C. M. (1932). Produktion af hydroxylamin ved reduktion af nitrater og nitritter ved forskellige renkulturer af bakterier. J. Bacteriol. 24, 489-492.
Pubmed Abstract | Pubmed Full Text
Loferer-Krossbacher, M., Klima, J., og Psenner, R. (1998). Bestemmelse af bakteriecellers tørmasse ved transmissionselektronmikroskopi og densitometrisk billedanalyse. Appl. Environ. Microbiol. 64, 688-694.
Pubmed Abstract | Pubmed Full Text

Figur 5. Steady state mRNA-niveauer for nøglegener, der koder for enzymer i den omvendte HURM-bane i N. profundicola dyrket med ammonium + polysulfid (sorte søjler), nitrat + sulfid (hvide søjler) eller nitrat + polysulfid efter tilsætning af ammonium. Transkriptoverfladen blev bestemt ved fluorescerende RT-PCR og normaliseret i forhold til 16S rRNA-overfladen bestemt i hver prøve. Værdierne er gennemsnit af 3 uafhængige biologiske replikater ± standardafvigelsen.
For at teste for potentiel ammonium-repression af ekspression af ekspressionsveje blev der tilsat ammonium til nitrat + sulfid-dyrkede kulturer, og mRNA-overfladen blev kvantificeret for de samme gener. Generelt faldt ammoniumtilsætning mRNA-abundanserne af de omvendt HURM-bane-kodende gener fra 1,2 til 3,6 gange (figur 5, grå søjler), selv om denne effekt kun var signifikant (P < 0,10) for haoA- og napC/cycB-transskriptioner, der koder for HURM-underenhederne. Interessant nok faldt ekspressionen af napA mindst (1.2-fold), hvilket indikerer behovet for nitratrespiration i disse celler. I intet tilfælde reducerede tilsætningen af ammonium transkriptniveauerne til dem, der blev set i kulturer dyrket i ammonium + polysulfid.
Evidens for et hydroxylaminintermediat
Direkte målinger af hydroxylamin i filtrater af N. profundicola-kulturer dyrket med nitrat fandt lave, men konsekvent påviselige niveauer af hydroxylamin (5,7 ± 3,5 μM, SD, n = 3). Dette lave niveau er i overensstemmelse med et mellemprodukt, hvis produktions- og forbrugshastigheder er nøje afstemt.
For at bestemme, om hydroxylamin kunne metaboliseres af N. profundicola, blev vaskede suspensioner af nitratvoksede celler inkuberet i nitratfrit vækstmedium med hydrogen som den eneste elektrondonor. Hydroxylamin blev tilsat som en potentiel elektronacceptor, og koncentrationerne af både hydroxylamin og ammonium blev fulgt over tid. Resultaterne af dette forsøg viser, at nitratvoksede celler af N. profundicola hurtigt og fuldstændigt omdanner hydroxylamin til ammonium (figur 6). Den specifikke hastighed for hydroxylaminomdannelsen i dette forsøg var 28,6 μM min-1 108 celler-1. Den ammoniumproduktionshastighed fra nitrat, der er beregnet for eksponentiel vækst i figur 3 (8-24 timer), er ~3 μM min-1 (108 celler)-1. Den målte hydroxylaminomdannelseshastighed er således langt større end den ammoniumproduktionshastighed, der er observeret under vækst af N. profundicola med nitrat. En tilsvarende tæt kobling mellem hydroxylaminproduktion og -fjernelse blev for nylig rapporteret for den kemolithotrofe ammoniak-oxiderende arkæon, Nitrosopumilus maritimus, hvor hydroxylaminoxidation er et væsentligt katabolisk trin (Vajrala et al., 2013).

Figur 6. Hydroxylamin omdannes hurtigt til ammonium af N. profundicola. Koncentrationerne af hydroxylamin (lukkede cirkler) og ammonium (åbne cirkler) blev fulgt efter tilsætning af 5 mM hydroxylamin til en hvilende cellesuspension. Punkterne er middelværdierne fra tre gentagelser ± standardafvigelsen.
Diskussion
De data, der præsenteres her, er i overensstemmelse med en ny vej for nitratreduktion i organismer, der mangler klassiske NO-dannende (NirS eller NirK) eller ammoniumdannende (NirB/NirA) nitritreduktaser med N. profundicola stamme AmH som et nyttigt modelsystem. Der er blevet foreslået en omvendt HURM-vej, hvorved nitrit reduceres til hydroxylamin i periplasmaet og efterfølgende reduceres til ammonium i cytoplasmaet (Campbell et al., 2009). Den oprindelige vej er her blevet ændret en smule for at inkludere en mere sandsynlig kandidat til den proximale elektrondonor til Har/Hcp, et forudsagt 4Fe-4S-holdigt protein, der er kodet af NAMH_1302 (figur 1). Homologer af NAMH_1302 er bevaret i C. concisus (GenBank accession YP_001466207), C. curvus (YP_001408944), C. fetus (YP_892678) og C. mediatlanticus (ZP_01871213), som har alle de andre gener for den omvendte HURM-vej. Desuden viste NAMH_1302 en stigning i transkriptoverflod i N. profundicola-celler dyrket på nitrat i forhold til ammonium.
Mens produktionen af hydroxylamin fra nitrat og nitrit både via kemiske (Rollefson og Oldershaw, 1932) og biologiske veje (Lindsey og Rhines, 1932) længe har været kendt, og et 3-kompleks blev vist at reducere nitrit til hydroxylamin, når det tilføres reduktant (Kostera et al, 2010), men forholdet mellem hydroxylamin vs. ammoniumproduktion fra nitrit i den omvendte HURM-vej er endnu ikke klarlagt. Optagelsen af ekstracellulær hydroxylamin af bakterier er kendt; exogent tilført hydroxylamin akkumuleres let i anammoxosomet af Kuenenia stuttgartiensis (Lindsay et al., 2001; Schmidt et al., 2004), et rum, som kun kan nås ved at krydse både celle- og anammoxosomemembranen. Den foreslåede optagelse af den stærkt mutagene hydroxylamin kræver beskyttelse mod DNA-læsioner, hvilket delvist kan forklare det omfattende supplement af DNA-reparationssystemer, der er identificeret i N. profundicola (Campbell et al., 2009). Hydroxylamin er også blevet foreslået som et mellemprodukt i ammoniumproduktionen fra nitrit i planter og alger, da ferredoxinafhængig nitritreduktase udviser høj reaktivitet og specificitet for dette substrat (Kuznetsova et al., 2004; Hirasawa et al.., 2010).
I modsætning til HURM’s quinonreduktasefunktion i ammoniak-oxidatorer (Klotz og Stein, 2008; Simon og Klotz, 2013) foreslår vi, at HURM i N. profundicola fungerer, i lighed med NrfAH, som et periplasmatisk quinoloxidasesystem, der shuttler elektroner fra quinolpuljen for at reducere nitrit til hydroxylamin. Det er sandsynligt, at den omvendte HURM-vej har udviklet sig fra en fælles forfader til NrfAH- og ONR-ammonificeringsmodulet i anammox-bakterier. Vi antager, at dette skete, før HURM – herunder et kovalent bundet trimerisk HaoA-kompleks, der er i stand til hydroxylamin-disproportionering – blev brugt som et katabolisk modul i både anaerobe og aerobe ammoniak-oxiderende bakterier (Jetten et al., 2009; Klotz og Stein, 2010; Campbell et al., 2011; Kern et al., 2011; Simon og Klotz, 2013). En lignende omvendelse af funktionen fra reducerende til oxiderende aktivitet, der sker ved dannelse af komplekser med kovalente bindinger, er blevet diskuteret for det NO-reducerende cytochrom c’-beta (cytS) og det NO-oxiderende cytochrom P460 (cytL) (Elmore et al., 2007). Gener, der koder for NrfAH- og reverse-HURM-modulerne, eksisterer kun i én bakteriel genomsekvens, C. fetus 82-40 (tabel 1). Det blev for nylig vist, at octaheme cytochrom c hydroxylamin dehydrogenase udviklede sig som et medlem af en multiheme cytochrom c-protein superfamilie med funktioner i kvælstof- og svovlcyklussen, og at cytochrom cM552 (CycB), NrfH og NapC er medlemmer af en anden cytochrom c superfamilie (Bergmann et al., 2005; Klotz og Stein, 2008; Kern et al., 2011; Simon og Klotz, 2013). Det er også kendt, at NAP-komplekser i Epsilonproteobakterier generelt ikke indeholder NapC-underenhedsproteiner (Klotz et al., 2006; Sievert et al., 2008; Kern og Simon, 2009; Klotz og Stein, 2010; Simon og Klotz, 2013). Den foreslåede omvendte funktion af et n-cM552 (CycB/NapC) kompleks som et nitritreduktase-quinoloxidasekompleks er mulig i betragtning af tilstedeværelsen af begge transkriptioner og fraværet af den kritiske tyrosinproteinligand i N. profundicola HaoA (Campbell et al, 2009), som adskiller de N-oxidreducerende NrfA og ONR fra de N-oxidoxiderende HAO-komplekser (Bergmann et al., 2005; Klotz og Stein, 2008; Kern et al., 2011; Simon og Klotz, 2013).
Den 15N-assimileringsdata fastslog, at N. profundicola inkorporerer nitrat-stickstof i biomassen under vækst, når det leveres som den eneste kvælstofkilde. Den store overproduktion af ammonium fra nitrat i forhold til de beregnede krav til biosyntese får os imidlertid til at konkludere, at den primære funktion af nitratreduktion til ammonium hos N. profundicola er, at den er en effektiv respiratorisk elektronacceptor. Denne konklusion understøttes af de øgede vækstrater og udbytter i N. profundicola-kulturer med nitrat som den eneste elektronacceptor. Desuden er genekspressionsdataene i overensstemmelse med vores forslag (Campbell et al., 2009) om, at dette sker via den samordnede funktion af Nap, HURM (3 og cM552) og Har/Hcp som en ny N-assimilations- og energibesparelsesvej: den omvendte HURM-vej. Endelig viser dataene, at N. profundicola har evnen til hurtigt at reducere hydroxylamin til ammonium, hvilket er i overensstemmelse med forslaget om fri hydroxylamin som et mellemprodukt i den omvendte HURM-bane. Den høje hastighed af den observerede hydroxylaminoptagelse forklarer sandsynligvis, hvorfor den ikke konsekvent observeres under vækst af kulturer på nitrat. Foreløbige målinger af ammoniumproduktion fra nitrat eller nitrit i hvilende celler svarer til den 3 μM min-1 (108 celler)-1 hastighed beregnet fra kulturer, ~10 gange lavere end den observerede hydroxylaminforbrugshastighed. I betragtning af disse hastigheder bør hydroxylamin forbruges umiddelbart efter produktionen i kulturer, der vokser på nitrat. Da hydroxylamin er mutagent, antager vi, at dette afspejler tidligere selektivt pres for at opretholde lave hydroxylaminniveauer under vækst.
Mens mærkning af biomasse er blevet forsøgt med 15N-NH2OH i batch N. profundicola-kulturer, har det endnu ikke været en succes (data ikke vist). I betragtning af, at hydroxylamin i batchkultur skal tilføres i lave koncentrationer i forhold til det umærkede nitrat for at undgå toksicitet, og at langt størstedelen af N fra hydroxylamin bør omdannes til ammonium (>90% baseret på figur 3), er dette resultat ikke overraskende. Kortvarige mærkningseksperimenter med meget højere koncentrationer af mærket hydroxylamin som den eneste N-kilde kan endegyldigt fastslå dette punkt.
Konklusionen er, at de her præsenterede data er i overensstemmelse med en model, hvor N. profundicola reducerer nitrat via et frit hydroxylaminintermediat. Disse eksperimenter udelukker endnu ikke helt den mulighed, at den omvendte HURM-aktivitet, der er foreslået i N. profundicola, fungerer som en ammoniumdannende nitritreduktase, der overfører 6 elektroner uden at frigive et N-oxidintermediat. Upublicerede resultater viser, at nogle få punktmutationer i nrfA-genet kan gøre pentaheme cytochrom c nitritreduktase til et utæt enzym, der frigiver N-oxidintermediater og ikke formår at omdanne nitrit stoikiometrisk til ammonium (Jörg Simon, pers. communi.). I betragtning af det evolutionære forhold mellem nrfA og haoA (Bergmann et al., 2005; Simon og Klotz, 2013) kan det omvendte HURM-modul i N. profundicola naturligt fungere som et ammonium- og hydroxylaminproducerende enzymkompleks, mens det eksisterende NrfA fungerer “lækagefrit” som en ammoniumproducerende nitritreduktase. Yderligere eksperimenter, hvor der anvendes inhibitorer af Har/Hcp med nitrat eller nitrit som substrat i hele celler og/eller biokemiske undersøgelser af det omvendte HURM-kompleks for at bestemme in vitro-produktet, bør give yderligere direkte test af denne hypotese. Uanset den specifikke mekanisme tyder N. profundicolas omfattende produktion af ammonium, der langt overstiger det biosyntetiske behov, på, at den og beslægtede Epsilonproteobakterier kan spille en økologisk rolle som ammoniumkilde i nitratrige, ammoniumfattige, hypoxiske miljøer, hvor de er almindeligt forekommende.
Materialer og metoder
Fri energiberegninger
Gibbs frie energier (tabel 2) blev beregnet ud fra standard redoxpotentialer for halvreaktionerne ved hjælp af Nernst-ligningen (Δ G0 = -nFE0) eller ved summation af frie energier for halvreaktionerne indsamlet fra litteraturen (Thauer et al, 1977; van der Star et al., 2008). Alle beregninger blev udført under standardbetingelser (1 M alle arter, 25°C, pH = 7).
Kulturering og analyse af kvælstofforbindelser
N. profundicola stamme AmH (ATCC BAA-1463) blev dyrket, og cellerne blev talt som tidligere beskrevet (Smith et al., 2008; Campbell et al., 2009). Ammonium i kultursupernatanter blev kvantificeret efter derivatisering med dansylchlorid og adskillelse ved HPLC med fluorescensdetektion (Shakila et al., 2001). Nitrat blev kvantificeret ved HPLC med UV/Vis-detektion. Hydroxylamin-koncentrationer blev bestemt i kulturfiltrater (0,2 μm) som beskrevet af Frear og Burrell (1955).
15N-mærkningsprocedurer
Stockopløsninger af 20 atom% 15N-nitrat og 15N-ammonium blev fremstillet ved at blande >99 atom% og naturlige hyppighedssalte for at fremstille medium ved en slutkoncentration på 5 mM nitrat eller ammonium efter behov. Cellerne blev høstet fra 15N-mærkede kulturer ved centrifugering, og cellepellet blev vasket tre gange med nanopur vand for at fjerne salte. Celsuspensionen blev tørret i tinkapsler, som blev sendt til laboratoriet for stabile isotoper på University of California-Davis, hvor 15N Atom % blev bestemt ved hjælp af isotopforholdsmassespektrometri. Kontrolprøver viste, at der ikke var sket nogen isotopkontaminering under prøvebehandlingen (data ikke vist).
Kvantitativ PCR
Gen-specifikke primere (tabel 3) blev anvendt til at kvantificere mRNA-overflod i total RNA ekstraheret fra N. profundicola som tidligere beskrevet (Campbell et al, 2009).

Tabel 3. Primere og betingelser for Q-RT-PCR-kvantificering af specifikke gener i totale RNA-prøver ekstraheret fra N. profundicola.
Hydroxylaminoptagelse
N. profundicola blev dyrket på H2 og formiat som elektrondonorer og nitrat som eneste elektronacceptor til sen eksponentiel fase. Cellerne blev høstet ved centrifugering. Alle overførsler og cellevaskninger blev udført i et anaerobt kammer fra Coy Laboratories. Cellerne blev resuspenderet med nitratfrit vækstmedium til en slutkoncentration på ~109 celler ml-1 og inkuberet ved 45 °C i 2 timer under en atmosfære af 80 % H2 + 20 % CO2, inden der blev tilsat hydroxylamin (5 mM slutkoncentration) fra en anaerobt fremstillet stamopløsning. Alikvotes af cellesuspensionen blev filtreret og analyseret for hydroxylamin som beskrevet ovenfor og for ammonium ved HPLC efter derivatisering med diethylethoxymethylenemalonat (Gómez-Alonso et al, 2007).
Author Contributions
Thomas E. Hanson, Barbara J. Campbell og Martin G. Klotz har i samarbejde designet eksperimenter og fortolket resultater, Thomas E. Hanson har udført alle analyser af kvælstofforbindelser og forberedt prøver til massespektrometri, Barbara J. Campbell har dyrket alle kulturer og udført kvantitativ PCR, Katie M. Kalis har udført hydroxylaminoptagelseseksperimenter, Mark A. Campbell har identificeret NAMH_1302 som et relevant gen. Thomas E. Hanson udarbejdede papiret, som efterfølgende blev revideret af Thomas E. Hanson, Barbara J. Campbell og Martin G. Klotz.
Interessekonflikter
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller økonomiske relationer, der kunne opfattes som en potentiel interessekonflikt.
Anerkendelser
Forfatterne vil gerne takke Lisa Y. Stein (Univ. Alberta-Edmonton), Jenn Macalady (Penn State Univ.), David Kirchman og Matt Cottrell (Univ. Delaware) for kritisk læsning af udkast til manuskriptet, Jennifer Biddle for adgang til et anaerobt kammer og Kathy Coyne for adgang til en HPLC. Dette projekt blev støttet af bevillinger fra National Science Foundation til Barbara J. Campbell og S. Craig Cary (EF-0333203), Barbara J. Campbell (DEB-0640414), Barbara J. Campbell og Thomas E. Hanson (MCB-0950691), og Martin G. Klotz (MCB-0948202/1202648), af et EPSCoR RII-2 tilskud til University of Delaware (EPS-0814251), og af incitamentmidler fra University of North Carolina til Martin G. Klotz.
Kern, M., og Simon, J. (2009). Elektrontransportkæder og bioenergetik i respiratorisk kvælstofmetabolisme i Wolinella succinogenes og andre Epsilonproteobakterier. Biochim. Biophys. Acta 1787, 646-656. doi: 10.1016/j.bbabio.2008.12.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lindsey, G. A., og Rhines, C. M. (1932). Produktion af hydroxylamin ved reduktion af nitrater og nitritter ved forskellige renkulturer af bakterier. J. Bacteriol. 24, 489-492.
Pubmed Abstract | Pubmed Full Text
Loferer-Krossbacher, M., Klima, J., og Psenner, R. (1998). Bestemmelse af bakteriecellers tørmasse ved transmissionselektronmikroskopi og densitometrisk billedanalyse. Appl. Environ. Microbiol. 64, 688-694.
Pubmed Abstract | Pubmed Full Text