Introduction
Nitrate is a major fixed nitrogen pool in the global N-cycle (Falkowski and Godfrey, 2008; Klotz and Stein, 2008). Il nitrato può essere ridotto tramite denitrificazione a protossido d’azoto o gas di dinitrogeno, per cui viene perso dagli ecosistemi terrestri e acquatici, o tramite ammonificazione ad ammonio che può essere trattenuto (Brandes et al., 2007; Klotz e Stein, 2008, 2010). In entrambi i percorsi, il nitrato viene ridotto a nitrito. Nei denitrificatori eterotrofi e negli ossidatori di ammoniaca, il nitrito viene ulteriormente ridotto dalle nitrito-riduttasi che formano NO: NirS o NirK. La riduzione del nitrito ad ammonio è catalizzata da una nitrito reduttasi assimilatoria (NirB/NirA) o respiratoria (NrfA) che forma ammoniaca (Klotz e Stein, 2008, 2010). I chemolitotipi e i metanotrofi che ossidano l’ammoniaca possono anche formare NO attraverso l’ossidazione dell’idrossilammina, un’altra potenziale via di perdita di azoto negli ecosistemi terrestri e acquatici (Campbell et al., 2011). Diversi Epsilonproteobatteri che sono in grado di utilizzare il nitrato per la respirazione e/o come unica fonte di azoto per la crescita non codificano omologhi di entrambi i tipi di nitrito reduttasi, suggerendo che questi organismi possiedono un meccanismo non riconosciuto per la riduzione del nitrito ad ammonio.
L’annotazione del genoma indica che non solo Nautilia profundicola, ma diversi Campylobacter spp. patogeni tra gli Epsilonproteobatteri possono utilizzare il nitrato come fonte di azoto per la crescita e/o come accettore di elettroni terminale. N. profundicola è un membro della linea di ramificazione più profonda degli Epsilonproteobatteri (Campbell et al., 2006; Smith et al., 2008) e i suoi parenti sono stati trovati solo in ambienti di sfiato idrotermale di mare profondo. Al contrario, Campylobacter spp. sono tipicamente associati a ospiti animali e la loro presenza in altri ambienti è mal definita. Mentre i genomi di N. profundicola, Campylobacter concisus, C. curvus e C. fetus contengono geni che codificano un complesso molibdopterina guanina dinucleotide periplasmatico legato alla nitrato reduttasi (NAP), non ci sono geni che codificano né l’ammonio né la nitrito reduttasi che forma NO. Inoltre, un gene napC/cycB è stato identificato nel genoma di N. profundicola (Campbell et al., 2009), che è insolito in quanto il complesso NAP in Epsilonproteobatteri solitamente manca di una proteina NapC (Kern e Simon, 2009; Klotz e Stein, 2010; Simon e Klotz, 2013). Sulla base della ricostruzione metabolica informata dal genoma (Campbell et al., 2009), abbiamo recentemente proposto un nuovo percorso per l’assimilazione dei nitrati (Figura 1) in cui il nitrito è ridotto a idrossilammina da un modulo redox idrossilammina:ubichinone (HURM, cioè una deidrogenasi idrossilammina dipendente dal chinone), che noi chiamiamo il percorso reverse-HURM. In N. profundicola, si pensa che l’HURM consista in un citocromo cM552 legato a NapC/NrfH (cycB, NAMH_0559) che media il trasferimento di elettroni tra il pool di chinoni e una idrossilammina ossidoreduttasi periplasmatica (HAO, NAMH_1280). L’HURM, che opera in direzione avanti e consiste in una idrossilammina deidrogenasi (EC:1.7.2.6; HaoA3) collegata a una navetta di elettroni della proteina citocromo c (c554 e/o cM552 codificata da cycA e cycB, rispettivamente), collega l’ossidazione dell’idrossilammina al pool di chinoni nei batteri aerobi ammoniaca-ossidanti (Klotz e Stein, 2008; Simon e Klotz, 2013). Nei batteri anaerobici che ossidano l’ammoniaca (anammox), il modulo redox consiste di idrazina ossidoreduttasi e di un citocromo c non ancora identificato (Jetten et al., 2009; Simon e Klotz, 2013). Nella via inversa-HURM, l’idrossilammina generata dal nitrito nel periplasma viene trasportata nel citoplasma e ridotta ad ammonio attraverso una idrossilammina reduttasi, nota anche come proteina ibrida cluster (Har/Hcp). Quindi, le reazioni di accettazione degli elettroni proposte per la via inversa-HURM sono:
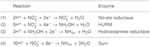
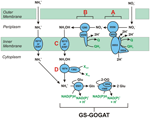
Figura 1. Il percorso inverso-HURM in N. profundicola. I singoli passaggi sono indicati con lettere maiuscole nella figura. I numeri nelle proteine raffigurate si riferiscono ai tag locus dal genoma AmH (cioè, 1280 = NAMH_1280 = HaoA). (A) riduzione del nitrato da parte della nitrato reduttasi respiratoria periplasmatica (NapABGH, 0556-53), (B) HURM (Hydroxylamine:Ubiquinone Redox Module) composto da un’idrossilammina ossidoreduttasi a funzionamento inverso (HaoA, 1280) che funziona come una nitrito reduttasi ocataheme, che produce idrossilammina utilizzando gli elettroni donati da un citocromo c tetraheme della famiglia NapC/NrfH/cM552 (CycB, 0559). (C) Trasporto di idrossilammina attraverso trasportatori di ammoniaca legati a AmtB. (D) Riduzione dell’idrossilammina ad ammonio da parte di una proteina ibrida cluster/idrossilammina reduttasi (Hcp/Har, 1074) che utilizza il potere riducente di una proteina contenente Fe-S (1302) il cui donatore di elettroni (X) è attualmente sconosciuto. L’assimilazione dell’ammonio nella biomassa avviene attraverso la glutammina sintetasi e la glutammina:2-oxoglutarato aminotransferasi (GS-GOGAT).
I genomi di N. profundicola, C. concisus, C. curvus, C. fetus, e Caminibacter mediatlanticus contengono ciascuno geni che codificano gli enzimi della via inversa-HURM, mentre i genomi di altri Epsilonproteobatteri codificano gli omologhi delle classiche NirS/NirK formanti NO e NirA, siroema assimilatore formante ammonio, o pentaeme respiratorio NrfA nitrito reduttasi. Noi ipotizziamo che il percorso inverso-HURM migliora la sopravvivenza e/o la dispersione di N. profundicola e Campylobacter spp. in carenza di ammonio host o non host ambienti associati. Tuttavia, affinché questa ipotesi sia vera, il percorso reverse-HURM deve fornire ammonio per la biosintesi e/o facilitare la conservazione dell’energia in questi organismi.

Tabella 1. Inventari dei geni del metabolismo dell’azoto in Epsilonproteobatteri sequenziati dal genoma.
Risultati
Energetica della crescita in N. profundicola
N. profundicola utilizza sia formiato che idrogeno come donatori di elettroni per il metabolismo energetico ed è tipicamente coltivato su polisolfuro come accettore di elettroni (Campbell et al., 2001; Smith et al., 2008). I calcoli in condizioni standard (1 M di tutte le specie, 25°C, pH = 7) indicano che quando il nitrato è ridotto dalle reazioni del percorso inverso-HURM, l’energia libera di Gibbs (Δ G°) è sostanzialmente maggiore di quella disponibile dalla riduzione del polisolfuro (Tabella 2). Per esempio, il Δ G° per mole di formiato ossidato con nitrato è 7,4 volte maggiore rispetto al polisolfuro (-237 kJ mol-1 contro -32 kJ mol-1). Da questo calcolo, si può prevedere che la crescita di N. profundicola dovrebbe essere stimolata nelle colture con nitrato come accettore di elettroni rispetto al polisolfuro.
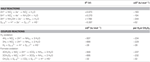
Tabella 2. Energie libere di reazione calcolate in condizioni standard (1 M tutte le specie, 25°C e pH = 7) per le mezze reazioni di accettazione di elettroni di composti azotati e polisolfuro e reazioni accoppiate con formiato o idrogeno come donatore di elettroni.
Crescita di N. profundicola con nitrato
Prima caratterizzazione e crescita di N. profundicola ha utilizzato mezzi con polisolfuro come fonte combinata di zolfo e accettore di elettroni (Campbell et al, 2001, 2009; Smith et al., 2008). Per chiarire ulteriormente il ruolo del nitrato nel metabolismo energetico di N. profundicola, il ceppo AmH è stato coltivato con solfuro come unica fonte di zolfo in modo che il nitrato fosse l’unico accettore di elettroni (Figura 2). Il donatore di elettroni era una miscela di idrogeno e formiato in un mezzo senza altre fonti di zolfo o azoto (Campbell et al., 2001). I tassi di crescita con nitrato come potenziale accettore di elettroni e fonte di azoto e solfuro (fonte di zolfo) o polisolfuro (fonte di zolfo e potenziale accettore di elettroni) erano più del doppio dei tassi di crescita osservati nelle culture che utilizzavano ammonio come unica fonte di azoto e polisolfuro come accettore di elettroni e fonte di zolfo. Come previsto, le colture di controllo negativo (nessun accettore di elettroni) fornite di ammonio come fonte di azoto e solfuro come fonte di zolfo non erano in grado di crescere.
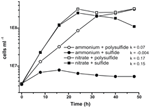
Figura 2. Crescita di N. profundicola con accettori di elettroni indicati, composti di azoto e fonti di zolfo. I tassi di crescita sono stati determinati tra 8 e 24 ore; k = costante di crescita specifica (h-1). Ogni punto è la media di 2 o 3 repliche biologiche indipendenti.
Equilibrio dell’azoto nelle colture di N. profundicola
Per confermare che il livello di ammonio prodotto da N. profundicola era in eccesso rispetto alle esigenze biosintetiche, abbiamo calcolato la domanda biosintetica di azoto come segue. Assumendo un rapporto C:N di 32:6.4 per il batterioplancton in crescita esponenziale (Vrede et al., 2002), 288 fg di C μm-3 per Escherichia coli in crescita esponenziale (Loferer-Krossbacher et al, 1998), e un volume cellulare di 0.021 μm3 calcolato dalle dimensioni riportate di N. profundicola (Smith et al., 2008), la produzione di 1 × 108 cellule ml-1 richiede ~120 ng ml-1 di N (~9 μM), una cifra che non cambierebbe indipendentemente dalla fonte N utilizzata. N. profundicola non ha utilizzato una quantità significativa di ammonio fornito durante la crescita con polisolfuro come accettore di elettroni (Figura 3, cerchi aperti), che concorda con il basso requisito N calcolato per produrre le densità delle cellule osservate. L’ammonio più cultura solfuro non è cresciuto (Figura 2) e anche non ha consumato in modo rilevabile ammonio (Figura 3, cerchi chiusi). Al contrario, la quantità di ammonio prodotta dalle cellule cresciute con 5 mM nitrato era 4.6 mM con polisolfuro e 5.2 mM con solfuro (Figura 3, aperto e chiuso quadrati, rispettivamente). Se il percorso inverso-HURM nel Epsilonproteobacteria serve principalmente per produrre ammonio per la biosintesi, ci aspetteremmo bassi livelli di ammonio esogeno per reprimere fortemente l’espressione del gene percorso HURM e attività di riduzione del nitrato. Tuttavia, la conversione stechiometrica di nitrato di ammonio in eccesso del requisito previsto N e osservato consumo di ammonio nelle culture di ammonio + polisolfuro è coerente con l’ipotesi che il nitrato viene utilizzato come un accettore di elettroni terminale da N. profundicola e che ammonification nitrato non è soggetto a repressione da ammonio.
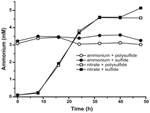
Figura 3. Concentrazioni di ammonio misurate in colture di N. profundicola contenenti gli accettori di elettroni indicati, composti azotati e fonti di zolfo. Ogni punto è la media di 2 o 3 repliche biologiche indipendenti.
Incorporazione di 15N-NO-3 nella biomassa
Il potenziale di assimilazione dei nitrati è stato valutato esaminando l’incorporazione di ammonio o nitrato marcato con 15N nella biomassa di N. profundicola durante la crescita con tutte le combinazioni di donatori di elettroni e potenziali accettori. N. profundicola cresciuto su 20 Atom% 15N-ammonio etichettato con polisolfuro prodotto biomassa arricchito a ~ 10 Atom% 15N dopo un giro di coltura batch (Figura 4), mentre il controllo non etichettato non era arricchito in 15N. Le colture coltivate con solfuro e 20 Atom% 15N-etichettato con nitrato hanno prodotto biomassa arricchita al 16 Atom% 15N (Figura 4). La biomassa coltivata con nitrato conteneva circa 5 volte più N della biomassa coltivata con ammonio (dati non mostrati), il che può spiegare l’arricchimento più esteso di 15N nei campioni coltivati con nitrato.
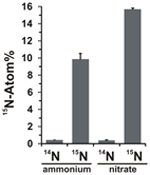
Figura 4. Assorbimento di azoto nella biomassa di N. profundicola determinato dopo un ciclo di coltura in batch con 5 mM dei composti di azoto indicati forniti in abbondanza naturale (14N) o al 20 Atom% 15N. I valori sono le medie di 3 repliche biologiche indipendenti ± la deviazione standard.
Trascrizione dei geni chiave del percorso
L’abbondanza di trascrizione per i geni che codificano gli enzimi del percorso proposto per il reverse-HURM in N. profundicola è stata determinata mediante PCR quantitativa in tempo reale in colture batch coltivate con ammonio o nitrato. Tutti i componenti del percorso proposto visualizzato un forte aumento di abbondanza trascrizione in culture coltivate nitrato (Figura 5). mRNA che codifica una subunità nitrato reduttasi (napA) erano 4.6 volte (P < 0,05, a due code eteroscedastico t-test) più abbondante in nitrato + solfuro cresciuto cellule rispetto all’ammonio + polisolfuro cresciuto cellule. Trascrizioni di entrambi i componenti del HURM, haoA e cycB/napC, sono stati aumentati da 8.5- e 7.1-fold (P < 0.05 per entrambi), rispettivamente. Coerentemente con la nostra previsione che l’idrossilammina prodotta nel periplasma dall’HURM sarebbe stata trasportata attraverso i principali canali delle proteine facilitatrici, gli mRNA che codificano entrambi gli omologhi del trasportatore di ammonio/metilammonio amtB sono aumentati di 4,5 volte (amtB-1, NAMH_0397, P < 0,08) e 10,3 volte (amtB-2, NAMH_0215, P > 0,10). L’idrossilammina è un potente mutageno che deve essere detossificato quando arriva nel citoplasma. Proponiamo che ciò avvenga tramite il NADH-dipendente Har/Hcp basato sugli studi del gene hcp nel cluster di geni per l’assimilazione dei nitrati di Rhodobacter capsulatus E1F1 dove è richiesto per la riduzione e l’assimilazione dell’idrossilammina prodotta da una nitrato reduttasi assimilatoria citoplasmatica (Cabello et al., 2004; Pino et al., 2006). Coerentemente con questa proposta, il più grande cambiamento in abbondanza trascrizione è stato visto per har, che è aumentato di 11,7 volte, ma questo cambiamento non era significativo (P > 0,10) a causa della elevata variabilità nelle misure indipendenti di abbondanza trascrizione har. Originariamente, avevamo proposto che il donatore di elettroni di Har fosse una deidrogenasi NADH codificata da NAMH_0542 (Campbell et al., 2009). Tuttavia, ora crediamo che un candidato migliore per questa funzione sia NAMH_1302, una proteina cluster 4Fe-4S prevista, basata sulla conservazione in altri Epsilonproteobatteri (Tabella 1). Coerentemente con questa previsione, trascrizioni di NAMH_1302 erano 4.6 volte più abbondante nelle cellule coltivate nitrato rispetto all’ammonio, ma il cambiamento non era significativo (P > 0.10).
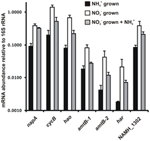
Figura 5. Steady state livelli di mRNA per i geni chiave che codificano gli enzimi del percorso inverso-HURM in N. profundicola cresciuto con ammonio + polisolfuro (barre nere), nitrato + solfuro (barre bianche), o nitrato + polisolfuro dopo l’aggiunta di ammonio. Abbondanza trascrizione è stato determinato da fluorescente RT-PCR e normalizzato all’abbondanza 16S rRNA determinato in ogni campione. I valori sono le medie di 3 repliche biologiche indipendenti ± la deviazione standard.
Per verificare la potenziale repressione dell’ammonio di espressione del percorso, l’ammonio è stato aggiunto a nitrato + solfuro coltivato culture e l’abbondanza mRNA quantificato per gli stessi geni. In generale, l’aggiunta di ammonio diminuito abbondanze mRNA del percorso inverso-HURM geni codificanti da 1.2- a 3.6 volte (Figura 5, barre grigie), anche se questo effetto era solo significativo (P < 0.10) per haoA e napC/cycB trascrizioni che codificano le subunità HURM. È interessante notare che l’espressione di napA è diminuita meno (1,2 volte), indicando la necessità della respirazione dei nitrati in queste cellule. In nessun caso, l’aggiunta di ammonio ha ridotto i livelli di trascrizione a quelli visti nelle culture cresciute in ammonio + polisolfuro.
Prova di un intermedio di idrossilammina
Misure dirette di idrossilammina nei filtri delle culture di N. profundicola coltivate con nitrato hanno trovato livelli bassi, ma costantemente rilevabili di idrossilammina (5,7 ± 3,5 μM, SD, n = 3). Questo basso livello è coerente con un intermedio i cui tassi di produzione e consumo sono strettamente abbinati.
Per determinare se l’idrossilammina potrebbe essere metabolizzata da N. profundicola, sospensioni lavate di cellule coltivate con nitrato sono state incubate in un terreno di crescita senza nitrato con idrogeno come unico donatore di elettroni. L’idrossilammina è stata aggiunta come potenziale accettore di elettroni e le concentrazioni sia di idrossilammina che di ammonio sono state seguite nel tempo. I risultati di questo esperimento indicano che le cellule coltivate a nitrati di N. profundicola convertono rapidamente e completamente l’idrossilammina in ammonio (Figura 6). Il tasso specifico di conversione dell’idrossilammina in questo esperimento era 28,6 μM min-1 108 cellule-1. Il tasso di produzione di ammonio dal nitrato calcolato per la crescita esponenziale in Figura 3 (8-24 h) è ~3 μM min-1 (108 cellule)-1. Così, il tasso di conversione idrossilammina misurato è molto superiore al tasso di produzione di ammonio osservato durante la crescita di N. profundicola con nitrato. Un accoppiamento altrettanto stretto tra la produzione e la rimozione dell’idrossilammina è stato recentemente riportato per l’archaeon chemiolitotrofo che ossida l’ammoniaca, Nitrosopumilus maritimus, dove l’ossidazione dell’idrossilammina è una fase catabolica essenziale (Vajrala et al., 2013).
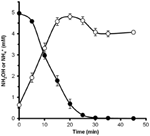
Figura 6. L’idrossilammina è rapidamente convertita in ammonio da N. profundicola. Le concentrazioni di idrossilammina (cerchi chiusi) e di ammonio (cerchi aperti) sono state seguite dopo l’aggiunta di 5 mM di idrossilammina a una sospensione cellulare a riposo. I punti sono i valori medi di tre repliche ± la deviazione standard.
Discussione
I dati qui presentati sono coerenti con un nuovo percorso per la riduzione dei nitrati in organismi che mancano di NO-forming classico (NirS o NirK) o ammonio-forming (NirB/NirA) nitrito reduttasi con N. profundicola ceppo AmH come un sistema modello utile. Un percorso inverso-HURM è stato proposto in cui il nitrito è ridotto a idrossilammina nel periplasma e successivamente ridotto ad ammonio nel citoplasma (Campbell et al., 2009). Il percorso originale è stato leggermente modificato qui per includere un candidato più probabile per il donatore di elettroni prossimale a Har/Hcp, una proteina contenente 4Fe-4S codificata da NAMH_1302 (Figura 1). Gli omologhi di NAMH_1302 sono conservati in C. concisus (GenBank accession YP_001466207), C. curvus (YP_001408944), C. fetus (YP_892678), e C. mediatlanticus (ZP_01871213) che possiedono tutti gli altri geni per il percorso inverso-HURM. Inoltre, NAMH_1302 ha mostrato un aumento dell’abbondanza della trascrizione nelle cellule di N. profundicola cresciute su nitrato rispetto all’ammonio.
Sebbene la produzione di idrossilammina da nitrato e nitrito sia per via chimica (Rollefson e Oldershaw, 1932) che biologica (Lindsey e Rhines, 1932) è nota da tempo e un complesso 3 ha dimostrato di ridurre il nitrito a idrossilammina quando viene fornito un riduttore (Kostera et al., 2010), il rapporto tra idrossilammina e produzione di ammonio dal nitrito nel percorso reverse-HURM non è ancora chiaro. L’assorbimento dell’idrossilammina extracellulare da parte dei batteri è noto; l’idrossilammina fornita esogenamente si accumula prontamente nell’anammoxosoma di Kuenenia stuttgartiensis (Lindsay et al., 2001; Schmidt et al., 2004), un compartimento che può essere raggiunto solo attraversando sia la membrana cellulare che quella dell’anammoxosoma. La proposta di assorbimento dell’idrossilammina, altamente mutagena, richiede una protezione contro le lesioni del DNA, il che può spiegare in parte l’ampio complemento di sistemi di riparazione del DNA identificati in N. profundicola (Campbell et al., 2009). L’idrossilammina è stata anche proposta come un intermedio della produzione di ammonio dal nitrito nelle piante e nelle alghe, poiché la ferredoxina-dipendente nitrito reduttasi mostra un’alta reattività e specificità per questo substrato (Kuznetsova et al., 2004; Hirasawa et al, 2010).
A differenza della funzione di chinone reduttasi di HURM in ammoniaca-ossidatori (Klotz e Stein, 2008; Simon e Klotz, 2013), proponiamo che HURM in N. profundicola agisce, simile a NrfAH, come un sistema periplasmatico di chinolo ossidasi che trasporta elettroni dal pool di chinolo per ridurre il nitrito a idrossilammina. È probabile che il reverse-HURM-pathway si sia evoluto da un antenato comune del modulo di ammonificazione NrfAH e ONR nei batteri anammox. Noi ipotizziamo che questo sia avvenuto prima che HURM – compreso un complesso trimerico HaoA legato covalentemente in grado di disproporzionare l’idrossilammina – fosse usato come modulo catabolico sia nei batteri anaerobi che aerobi che ossidano l’ammoniaca (Jetten et al., 2009; Klotz e Stein, 2010; Campbell et al., 2011; Kern et al., 2011; Simon e Klotz, 2013). Una simile inversione di funzione dall’attività riducente a quella ossidante effettuata dalla formazione di complessi covalenti è stata discussa per il citocromo c’-beta (cytS) e il citocromo P460 (cytL) NO-ossidante (Elmore et al., 2007). I geni che codificano i moduli NrfAH e reverse-HURM coesistono in una sola sequenza di genoma batterico, C. fetus 82-40 (Tabella 1). È stato dimostrato di recente che l’ottaemide citocromo c idrossilammina deidrogenasi si è evoluto come membro di una superfamiglia di proteine multieme citocromo c con funzioni nei cicli dell’azoto e dello zolfo e che il citocromo cM552 (CycB), NrfH, e NapC sono membri di un’altra superfamiglia di citocromo c (Bergmann et al., 2005; Klotz e Stein, 2008; Kern et al., 2011; Simon e Klotz, 2013). È anche noto che i complessi NAP in Epsilonproteobatteri generalmente non contengono proteine di subunità NapC (Klotz et al., 2006; Sievert et al., 2008; Kern e Simon, 2009; Klotz e Stein, 2010; Simon e Klotz, 2013). La funzione inversa proposta di un complesso n-cM552 (CycB/NapC) come complesso nitrito reduttasi-quinolo ossidasi è fattibile data la presenza di entrambi i trascritti e l’assenza del ligando critico della proteina tirosina in N. profundicola HaoA (Campbell et al, 2009), che separano l’N-ossido riducente NrfA e ONR dai complessi N-ossido ossidante HAO (Bergmann et al., 2005; Klotz e Stein, 2008; Kern et al., 2011; Simon e Klotz, 2013).
I dati di assimilazione 15N hanno stabilito che N. profundicola incorpora azoto nitrato nella biomassa durante la crescita quando viene fornito come unica fonte di azoto. Tuttavia, il grande eccesso di produzione di ammonio dal nitrato rispetto alle richieste calcolate per la biosintesi ci porta a concludere che la funzione primaria della riduzione del nitrato in ammonio da parte di N. profundicola è quella di un efficiente accettore di elettroni respiratorio. Questa conclusione è supportata dall’aumento dei tassi di crescita e delle rese nelle colture di N. profundicola con nitrato come unico accettore di elettroni. Inoltre, i dati di espressione genica concordano con la nostra proposta (Campbell et al., 2009) che ciò avviene attraverso la funzione concertata di Nap, HURM (3 e cM552) e Har/Hcp come una nuova via di assimilazione di N e di conservazione dell’energia: la via reverse-HURM. Infine, i dati indicano che N. profundicola ha la capacità di ridurre rapidamente l’idrossilammina all’ammonio, coerentemente con la proposta di idrossilammina libera come intermedio nel percorso reverse-HURM. L’alto tasso di assorbimento dell’idrossilammina osservato spiega probabilmente perché non viene osservato costantemente durante la crescita delle colture su nitrato. Misure preliminari di produzione di ammonio da nitrato o nitrito in cellule a riposo sono simili al tasso di 3 μM min-1 (108 cellule)-1 calcolato dalle culture, ~ 10 volte inferiore al tasso di consumo di idrossilammina osservato. Dati questi tassi, l’idrossilammina dovrebbe essere consumata immediatamente dopo la produzione nelle culture che crescono su nitrato. Poiché l’idrossilammina è mutagena, ipotizziamo che questo rifletta una precedente pressione selettiva per mantenere bassi i livelli di idrossilammina durante la crescita.
Mentre l’etichettatura della biomassa è stata tentata con 15N-NH2OH in colture di N. profundicola, non ha ancora avuto successo (dati non mostrati). Dato che l’idrossilammina nella cultura batch deve essere fornita a basse concentrazioni rispetto al nitrato non etichettato per evitare la tossicità e che la stragrande maggioranza di N da idrossilammina dovrebbe essere convertita in ammonio (>90% in base alla figura 3), questo risultato non è sorprendente. Esperimenti di etichettatura a breve termine con concentrazioni molto più elevate di idrossilammina etichettata come unica fonte di N possono stabilire definitivamente questo punto.
In conclusione, i dati qui presentati sono coerenti con un modello in cui N. profundicola riduce il nitrato attraverso un intermedio libero di idrossilammina. Questi esperimenti non escludono ancora completamente la possibilità che l’attività reverse-HURM proposta in N. profundicola funzioni come una nitrito reduttasi formante ammonio che trasferisce 6 elettroni senza rilasciare un intermedio N-ossido. Risultati non pubblicati indicano che alcune mutazioni puntiformi nel gene nrfA possono rendere la nitrito reduttasi del citocromo c del pentaema in un enzima che rilascia intermedi di ossido di N e non riesce a convertire il nitrito stechiometricamente in ammonio (Jörg Simon, pers. communi.). Data la relazione evolutiva tra nrfA e haoA (Bergmann et al., 2005; Simon e Klotz, 2013), il modulo reverse-HURM in N. profundicola potrebbe funzionare naturalmente come un complesso enzimatico che produce ammonio e idrossilammina mentre l’attuale NrfA opera “senza perdite” come una nitrito reduttasi che produce ammonio. Ulteriori esperimenti utilizzando inibitori di Har/Hcp con nitrato o nitrito come substrato in cellule intere e/o studi biochimici del complesso inverso-HURM per determinare il prodotto in vitro dovrebbero fornire ulteriori test diretti di questa ipotesi. Indipendentemente dal meccanismo specifico, l’ampia produzione di ammonio in eccesso rispetto alle esigenze biosintetiche da parte di N. profundicola suggerisce che esso e i relativi Epsilonproteobatteri possono svolgere un ruolo ecologico come fonte di ammonio in ambienti ricchi di nitrati, privi di ammonio e ipossici dove si trovano comunemente.
Materiali e metodi
Calcoli di energia libera
Le energie libere di Gibbs (Tabella 2) sono state calcolate dai potenziali redox standard delle mezze reazioni mediante l’equazione di Nernst (Δ G0 = -nFE0) o dalla somma delle energie libere delle mezze reazioni raccolte dalla letteratura (Thauer et al, 1977; van der Star et al., 2008). Tutti i calcoli sono stati eseguiti in condizioni standard (1 M tutte le specie, 25°C, pH = 7).
Cultura e analisi dei composti azotati
N. profundicola ceppo AmH (ATCC BAA-1463) è stato coltivato e le cellule contate come precedentemente descritto (Smith et al., 2008; Campbell et al., 2009). L’ammonio nei surnatanti della coltura è stato quantificato dopo la derivatizzazione con cloruro di dansile e la separazione mediante HPLC con rilevamento della fluorescenza (Shakila et al., 2001). Il nitrato è stato quantificato mediante HPLC con rilevamento UV/Vis. Le concentrazioni di idrossilammina sono state determinate nei filtrati di coltura (0.2 μm) come descritto da Frear e Burrell (1955).
Procedure di etichettatura 15N
Le soluzioni di stock di 20 Atom% 15N-nitrato e 15N-ammonio sono state preparate mescolando >99 Atom% e sali di abbondanza naturale per preparare il mezzo ad una concentrazione finale di 5 mM di nitrato o ammonio come necessario. Le cellule sono state raccolte da culture marcate 15N mediante centrifugazione e il pellet di cellule è stato lavato tre volte con acqua nanopura per rimuovere i sali. La sospensione cellulare è stata essiccata in capsule di stagno che sono state inviate al laboratorio di isotopi stabili dell’Università della California-Davis dove il 15N Atom % è stato determinato dalla spettrometria di massa del rapporto isotopico. I campioni di controllo hanno indicato che nessuna contaminazione isotopica si era verificata durante l’elaborazione del campione (dati non mostrati).
PCDR quantitativa
I primer specifici del gene (Tabella 3) sono stati utilizzati per quantificare l’abbondanza di mRNA nell’RNA totale estratto da N. profundicola come precedentemente descritto (Campbell et al., 2009).

Tabella 3. Primer e condizioni per la quantificazione Q-RT-PCR di geni specifici in campioni di RNA totale estratti da N. profundicola.
Hydroxylamine Uptake
N. profundicola è stata coltivata su H2 e formiato come donatori di elettroni e nitrato come unico accettore di elettroni fino alla fase esponenziale avanzata. Le cellule sono state raccolte per centrifugazione. Tutti i trasferimenti e i lavaggi delle cellule sono stati eseguiti in una camera anaerobica dei Coy Laboratories. Le cellule sono state risospese con terreno di crescita privo di nitrato ad una concentrazione finale di ~ 109 cellule ml-1 e incubate a 45 ° C per 2 ore in un’atmosfera di 80% H2 + 20% CO2 prima dell’aggiunta di idrossilammina (5 mM concentrazione finale) da una soluzione stock preparato anaerobicamente. Aliquote della sospensione cellulare sono state filtrate e dosate per l’idrossilammina come descritto sopra e per l’ammonio mediante HPLC dopo la derivatizzazione con dietil etossimetilenemalonato (Gómez-Alonso et al, 2007).
Contributi degli autori
Thomas E. Hanson, Barbara J. Campbell, e Martin G. Klotz hanno progettato esperimenti e interpretato i risultati, Thomas E. Hanson ha eseguito tutte le analisi dei composti azotati e preparato i campioni per la spettrometria di massa, Barbara J. Campbell ha coltivato tutte le colture ed eseguito la PCR quantitativa, Katie M. Kalis ha eseguito esperimenti di assorbimento di idrossilammina, Mark A. Campbell ha identificato NAMH_1302 come un gene rilevante. Thomas E. Hanson ha redatto l’articolo, che è stato successivamente rivisto da Thomas E. Hanson, Barbara J. Campbell, e Martin G. Klotz.
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che possa essere interpretata come un potenziale conflitto di interessi.
Riconoscimenti
Gli autori desiderano ringraziare Lisa Y. Stein (Univ. Alberta-Edmonton), Jenn Macalady (Penn State Univ.), David Kirchman e Matt Cottrell (Univ. Delaware) per la lettura critica delle bozze del manoscritto, Jennifer Biddle per l’accesso ad una camera aerobica e Kathy Coyne per l’accesso ad un HPLC. Questo progetto è stato sostenuto da sovvenzioni della National Science Foundation a Barbara J. Campbell e S. Craig Cary (EF-0333203), a Barbara J. Campbell (DEB-0640414), a Barbara J. Campbell e Thomas E. Hanson (MCB-0950691), e a Martin G. Klotz (MCB-0948202/1202648), da una sovvenzione EPSCoR RII-2 all’Università del Delaware (EPS-0814251), e da fondi di incentivazione forniti dalla University of North Carolina a Martin G. Klotz.
Kern, M., e Simon, J. (2009). Catene di trasporto degli elettroni e bioenergetica del metabolismo respiratorio dell’azoto in Wolinella succinogenes e altri Epsilonproteobatteri. Biochim. Biophys. Acta 1787, 646-656. doi: 10.1016/j.bbabio.2008.12.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lindsey, G. A., and Rhines, C. M. (1932). La produzione di idrossilammina dalla riduzione di nitrati e nitriti da varie colture pure di batteri. J. Bacteriol. 24, 489-492.
Pubmed Abstract | Pubmed Full Text
Loferer-Krossbacher, M., Klima, J., and Psenner, R. (1998). Determinazione della massa secca delle cellule batteriche mediante microscopia elettronica a trasmissione e analisi densitometrica dell’immagine. Appl. Environ. Microbiol. 64, 688-694.
Pubmed Abstract | Pubmed Full Text