Introduction
Nitraat is een belangrijke vaste stikstofpool in de mondiale N-cyclus (Falkowski en Godfrey, 2008; Klotz en Stein, 2008). Nitraat kan worden gereduceerd via denitrificatie tot distikstofoxide of dinitrogeengas, waarbij het uit terrestrische en aquatische ecosystemen verloren gaat, of via ammonificatie tot ammonium dat kan worden vastgehouden (Brandes et al., 2007; Klotz and Stein, 2008, 2010). In beide routes wordt nitraat gereduceerd tot nitriet. In heterotrofe denitrificeerders en ammoniumoxidatiebedrijven wordt nitriet verder gereduceerd door NO-vormende nitrietreductases: NirS of NirK. Nitrietreductie tot ammonium wordt gekatalyseerd door assimilatoir (NirB/NirA) of respiratoir (NrfA) ammoniakvormend nitrietreductase (Klotz en Stein, 2008, 2010). Ammoniak-oxiderende chemolithotrofen en methanotrofen kunnen ook NO vormen door de oxidatie van hydroxylamine, een andere potentiële route van stikstofverlies in terrestrische en aquatische ecosystemen (Campbell et al., 2011). Verscheidene Epsilonproteobacteria die nitraat kunnen gebruiken voor de ademhaling en/of als enige stikstofbron voor de groei coderen niet voor homologs van een van beide nitrietreductase types, wat suggereert dat deze organismen een niet-herkend mechanisme bezitten voor de reductie van nitriet tot ammonium.
Genoomannotatie geeft aan dat niet alleen Nautilia profundicola, maar ook verscheidene pathogene Campylobacter spp. onder de Epsilonproteobacteria mogelijk nitraat gebruiken als stikstofbron voor groei en/of als eindelektronenacceptor. N. profundicola is lid van de diepst vertakkende lijn van de Epsilonproteobacteria (Campbell et al., 2006; Smith et al., 2008) en zijn verwanten zijn alleen aangetroffen in diepzee hydrothermale vent omgevingen. Campylobacter spp. daarentegen worden meestal geassocieerd met dierlijke gastheren en hun aanwezigheid in andere milieus is slecht gedefinieerd. Hoewel de genomen van N. profundicola, Campylobacter concisus, C. curvus en C. foetus genen bevatten die coderen voor een periplasmair molybdopterine-guanine-dinucleotide-gekoppeld nitraatreductasecomplex (NAP), zijn er geen genen die coderen voor ammonium- of NO-vormende nitrietreductases. Bovendien werd een napC/cycB-gen geïdentificeerd in het genoom van N. profundicola (Campbell et al., 2009), wat ongebruikelijk is omdat het NAP-complex in Epsilonproteobacteria gewoonlijk een NapC-eiwit ontbeert (Kern en Simon, 2009; Klotz en Stein, 2010; Simon en Klotz, 2013). Op basis van genoomgeïnformeerde metabole reconstructie (Campbell et al., 2009) hebben wij onlangs een nieuwe route voor nitraatassimilatie voorgesteld (figuur 1) waarbij nitriet wordt gereduceerd tot hydroxylamine door een hydroxylamine:ubiquinon redox module (HURM, d.w.z. een quinon-afhankelijk hydroxylamine dehydrogenase), die wij de omgekeerde-HURM route noemen. In N. profundicola zou de HURM bestaan uit een NapC/NrfH-gerelateerd cytochroom cM552 (cycB, NAMH_0559) dat elektronenoverdracht tussen de chinonpool en een periplasmatisch hydroxylamine oxidoreductase (HAO, NAMH_1280) bemiddelt. HURM, dat in voorwaartse richting werkt en bestaat uit hydroxylamine-dehydrogenase (EC:1.7.2.6; HaoA3), verbonden met een cytochroom c-eiwit-elektronshuttle (c554 en/of cM552, gecodeerd door respectievelijk cycA en cycB), verbindt de oxidatie van hydroxylamine met de chinonpool in aerobe ammoniak-oxiderende bacteriën (Klotz en Stein, 2008; Simon en Klotz, 2013). In anaerobe ammoniak oxiderende (anammox) bacteriën bestaat de redox module uit hydrazine oxidoreductase en een nog niet geïdentificeerd cytochroom c (Jetten et al., 2009; Simon and Klotz, 2013). In de omgekeerde-HURM-route wordt hydroxylamine, gegenereerd uit nitriet in het periplasma, naar het cytoplasma getransporteerd en gereduceerd tot ammonium via een hydroxylamine-reductase, ook bekend als het hybride clustereiwit (Har/Hcp). De voorgestelde elektronen accepterende reacties van de omgekeerde-HURM-route zijn dus:
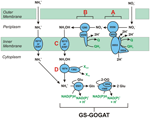
Figuur 1. De omgekeerde-HURM-route in N. profundicola. Afzonderlijke stappen zijn in de figuur aangegeven met hoofdletters. Nummers in de afgebeelde eiwitten verwijzen naar locus-tags van het AmH-genoom (d.w.z. 1280 = NAMH_1280 = HaoA). (A) Nitraatreductie door respiratoir periplasmatisch nitraatreductase (NapABGH, 0556-53), (B) HURM (Hydroxylamine:Ubiquinone Redox Module), bestaande uit een omgekeerd werkend hydroxylamine-oxidoreductase (HaoA, 1280) dat functioneert als een ocataheme nitrietreductase, dat hydroxylamine produceert met gebruikmaking van elektronen die worden afgestaan door een tetraheme cytochroom c van de NapC/NrfH/cM552-familie (CycB, 0559). (C) Transport van hydroxylamine via ammoniaktransporters die verwant zijn aan AmtB. (D) Reductie van hydroxylamine tot ammonium door een hybride clustereiwit/hydroxylamine reductase (Hcp/Har, 1074) dat gebruik maakt van de reductiekracht van een voorspeld Fe-S-bevattend eiwit (1302) waarvan de elektronendonor (X) momenteel onbekend is. De assimilatie van ammonium in biomassa gebeurt via glutaminesynthetase en glutamine:2-oxoglutaraat aminotransferase (GS-GOGAT).
De genomen van N. profundicola, C. concisus, C. curvus, C. foetus, en Caminibacter mediatlanticus bevatten elk genen die coderen voor de enzymen van de omgekeerde-HURM-route, terwijl de genomen van andere Epsilonproteobacteriën coderen voor homologen van de klassieke NO-vormende NirS/NirK en ammoniumvormende assimilatoire siroheme NirA, of respiratoire pentaheme NrfA nitrietreductases . Wij stellen de hypothese voorop dat de omgekeerde-HURM-route de overleving en/of verspreiding van N. profundicola en Campylobacter spp. verbetert in ammoniumarme gastheer- of niet-gastheergeassocieerde omgevingen. Wil deze hypothese echter juist zijn, dan moet de omgekeerde-HURM-route ammonium voor de biosynthese leveren en/of het energiebehoud in deze organismen vergemakkelijken.

Tabel 1. Nitrogen metabolism gene inventories in genome-sequenced Epsilonproteobacteria.
Results
Energetics of Growth in N. profundicola
N. profundicola utilizes both formate and hydrogen as electron donors for energy metabolism and is typically grown on polysulfide as the electron acceptor (Campbell et al, 2001; Smith et al., 2008). Berekeningen onder standaardomstandigheden (1 M van alle species, 25°C, pH = 7) geven aan dat wanneer nitraat gereduceerd wordt door de reacties van de omgekeerde-HURM-route, de Gibbs-vrije energie (Δ G°) aanzienlijk groter is dan die van de reductie van polysulfide (Tabel 2). Zo is bijvoorbeeld de Δ G° per mol met nitraat geoxideerd formiaat 7,4-maal hoger dan bij polysulfide (-237 kJ mol-1 tegen -32 kJ mol-1). Uit deze berekening kan men voorspellen dat de groei van N. profundicola zou moeten worden gestimuleerd in culturen met nitraat als de elektronenacceptor ten opzichte van polysulfide.
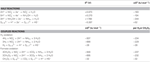
Tabel 2. Berekende vrije reactie-energieën onder standaardomstandigheden (1 M alle soorten, 25°C en pH = 7) voor elektron-accepterende halfreacties van stikstofverbindingen en polysulfide en gekoppelde reacties met formiaat of waterstof als elektronendonor.
Groei van N. profundicola met nitraat
Vorige karakterisering en groei van N. profundicola maakten gebruik van media met polysulfide als een gecombineerde zwavelbron en elektronenacceptor (Campbell et al, 2001, 2009; Smith et al., 2008). Om de rol van nitraat in het energiemetabolisme van N. profundicola verder te verduidelijken, werd stam AmH gekweekt met sulfide als enige zwavelbron, zodat nitraat de enige elektronenacceptor was (figuur 2). De elektronendonor was een mengsel van waterstof en formiaat in een medium zonder andere bronnen van zwavel of stikstof (Campbell et al., 2001). De groeisnelheden met nitraat als potentiële elektronenacceptor en stikstofbron en sulfide (zwavelbron) of polysulfide (zwavelbron en potentiële elektronenacceptor) waren meer dan twee keer zo hoog als de groeisnelheden die werden waargenomen bij culturen met ammonium als enige stikstofbron en polysulfide als elektronenacceptor en zwavelbron. Zoals verwacht konden negatieve-controleculturen (zonder elektronenacceptor) met ammonium als stikstofbron en sulfide als zwavelbron niet groeien.
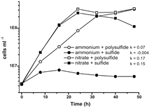
Figuur 2. Groei van N. profundicola met aangegeven elektronenacceptoren, stikstofverbindingen en zwavelbronnen. De groeisnelheden werden bepaald tussen 8 en 24 uur; k = specifieke groeisnelheidsconstante (h-1). Elk punt is het gemiddelde van 2 of 3 onafhankelijke biologische replicaten.
Stikstofbalans in N. profundicola Culturen
Om te bevestigen dat het niveau van ammonium geproduceerd door N. profundicola hoger was dan de biosynthetische behoeften, berekenden we de biosynthetische stikstofbehoefte als volgt. Uitgaande van een C:N-verhouding van 32:6,4 voor exponentieel groeiend bacterioplankton (Vrede et al., 2002), 288 fg C μm-3 voor exponentieel groeiende Escherichia coli (Loferer-Krossbacher et al, 1998), en een celvolume van 0,021 μm3 berekend uit de gerapporteerde afmetingen van N. profundicola (Smith et al., 2008), vereist de productie van 1 × 108 cellen ml-1 ~120 ng ml-1 N (~9 μM), een cijfer dat niet zou veranderen ongeacht de gebruikte N-bron. N. profundicola gebruikte geen significante hoeveelheid ammonium tijdens de groei met polysulfide als elektronenacceptor (figuur 3, open cirkels), wat overeenkomt met de lage N-vereiste berekend om de waargenomen celdichtheden te produceren. De ammonium-plus-sulfidecultuur groeide niet (figuur 2) en verbruikte ook geen detecteerbaar ammonium (figuur 3, gesloten cirkels). Daarentegen was de hoeveelheid ammonium geproduceerd door cellen gekweekt met 5 mM nitraat 4,6 mM met polysulfide en 5,2 mM met sulfide (figuur 3, open en gesloten vierkantjes, respectievelijk). Als de omgekeerde HURM-route in de Epsilonproteobacteriën in de eerste plaats dient om ammonium te produceren voor de biosynthese, zouden we verwachten dat lage niveaus van exogeen ammonium de genexpressie en de nitraatreductieactiviteit van de HURM-route sterk zouden onderdrukken. De stoichiometrische omzetting van nitraat in ammonium boven de voorspelde N-behoefte en het waargenomen ammoniumverbruik in de ammonium + polysulfide culturen is echter consistent met de hypothese dat nitraat door N. profundicola wordt gebruikt als een eindelektronenacceptor en dat de nitraatammonificatie niet wordt onderdrukt door ammonium.
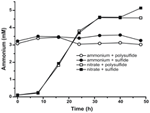
Figuur 3. Ammoniumconcentraties gemeten in culturen van N. profundicola die de aangegeven elektronenacceptoren, stikstofverbindingen en zwavelbronnen bevatten. Elk punt is het gemiddelde van 2 of 3 onafhankelijke biologische replicaten.
15N-NO-3 opname in biomassa
Het potentieel voor nitraatassimilatie werd beoordeeld door de opname van 15N-gelabeld ammonium of nitraat in N. profundicola biomassa te onderzoeken tijdens groei met alle bovenstaande combinaties van elektronendonoren en potentiële acceptoren. N. profundicola gekweekt op 20 Atom% 15N-gelabeld ammonium met polysulfide produceerde biomassa verrijkt tot ~10 Atom% 15N na één ronde van batchcultuur (Figuur 4), terwijl de niet-gelabelde controle niet verrijkt was in 15N. Culturen gekweekt met sulfide en 20 Atom% 15N-gelabeld nitraat produceerden biomassa verrijkt tot 16 Atom% 15N (figuur 4). De met nitraat gekweekte biomassa bevatte ongeveer 5 maal meer N dan de met ammonium gekweekte biomassa (gegevens niet weergegeven), wat de uitgebreidere verrijking van 15N in de met nitraat gekweekte monsters kan verklaren.
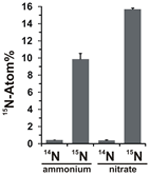
Figuur 4. Stikstofopname in de biomassa van N. profundicola bepaald na één ronde van batchcultuur met 5 mM van de aangegeven stikstofverbindingen geleverd in natuurlijke abundantie (14N) of met 20 Atom% 15N. De waarden zijn gemiddelden van 3 onafhankelijke biologische replicaten ± de standaardafwijking.
Transcriptie van sleutelpathwaygenen
Transcriptieabundantie voor genen die coderen voor enzymen van de voorgestelde omgekeerde-HURM pathway in N. profundicola werd bepaald door kwantitatieve real-time PCR in batchculturen gekweekt met ammonium of nitraat. Alle componenten van de voorgestelde route vertoonden een sterke toename in transcriptabundantie in met nitraat gekweekte culturen (Figuur 5). mRNA’s die coderen voor een nitraatreductase-subeenheid (napA) waren 4,6-voudig (P < 0,05, tweestrengs heteroscedastische t-test) talrijker in met nitraat + sulfide gekweekte cellen ten opzichte van met ammonium + polysulfide gekweekte cellen. Transcripten van beide componenten van de HURM, haoA en cycB/napC, waren respectievelijk 8,5- en 7,1-voudig verhoogd (P < 0,05 voor beide). In overeenstemming met onze voorspelling dat hydroxylamine, geproduceerd in het periplasma door de HURM, getransporteerd zou worden via belangrijke facilitator-eiwit kanalen, werden mRNA’s die coderen voor beide homologs van de ammonium/methylammonium transporter amtB 4,5-voudig (amtB-1, NAMH_0397, P < 0,08) en 10,3-voudig (amtB-2, NAMH_0215, P > 0,10) verhoogd. Hydroxylamine is een krachtig mutageen dat moet worden ontgift als het in het cytoplasma aankomt. Wij stellen dat dit gebeurt door het NADH-afhankelijke Har/Hcp, gebaseerd op studies van het hcp-gen in de gencluster voor nitraatassimilatie van Rhodobacter capsulatus E1F1, waar het nodig is voor de reductie en assimilatie van hydroxylamine dat geproduceerd wordt door een cytoplasmatisch assimilatoir nitraatreductase (Cabello et al., 2004; Pino et al., 2006). In overeenstemming met dit voorstel werd de grootste verandering in transcriptdichtheid waargenomen voor har, dat met een factor 11,7 toenam, maar deze verandering was niet significant (P > 0,10) als gevolg van de grote variabiliteit in onafhankelijke metingen van har transcriptdichtheid. Oorspronkelijk hadden wij voorgesteld dat de elektronendonor van Har een NADH-dehydrogenase was, gecodeerd door NAMH_0542 (Campbell et al., 2009). Wij zijn nu echter van mening dat een betere kandidaat voor deze functie NAMH_1302 is, een voorspeld 4Fe-4S clustereiwit, gebaseerd op conservering in andere Epsilonproteobacteria (Tabel 1). In overeenstemming met deze voorspelling, transcripten van NAMH_1302 waren 4.6-voudig meer overvloedig in nitraat gekweekte cellen ten opzichte van ammonium, maar de verandering was niet significant (P > 0.10).
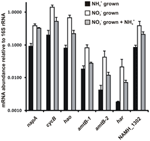
Figuur 5. Steady state mRNA-niveaus voor de belangrijkste genen die coderen voor enzymen van de omgekeerde-HURM-route in N. profundicola gekweekt met ammonium + polysulfide (zwarte balken), nitraat + sulfide (witte balken), of nitraat + polysulfide na de toevoeging van ammonium. Transcript abundantie werd bepaald door fluorescerende RT-PCR en genormaliseerd naar 16S rRNA abundantie bepaald in elk monster. De waarden zijn gemiddelden van 3 onafhankelijke biologische replicaten ± de standaardafwijking.
Om te testen of ammonium de expressie van de pathway mogelijk onderdrukt, werd ammonium toegevoegd aan nitraat + sulfide gekweekte culturen en werd de mRNA-abundantie gekwantificeerd voor dezelfde genen. In het algemeen verminderde de toevoeging van ammonium de mRNA-abundantie van de omgekeerde-HURM-route-coderende genen van 1,2- tot 3,6-voudig (Figuur 5, grijze balken), hoewel dit effect alleen significant was (P < 0,10) voor haoA en napC/cycB transcripten die coderen voor de HURM-subeenheden. Interessant is dat de expressie van napA het minst afnam (1,2-voudig), wat wijst op de noodzaak van nitraatademhaling in deze cellen. In geen enkel geval verminderde de toevoeging van ammonium de transcriptieniveaus tot die welke werden waargenomen in culturen gekweekt in ammonium + polysulfide.
Aanwijzingen voor een tussenproduct van hydroxylamine
Directe metingen van hydroxylamine in filtraten van N. profundicola culturen gekweekt met nitraat vonden lage, maar consistent detecteerbare niveaus van hydroxylamine (5,7 ± 3,5 μM, SD, n = 3). Dit lage niveau is consistent met een tussenproduct waarvan de productie- en consumptiesnelheden nauw op elkaar zijn afgestemd.
Om te bepalen of hydroxylamine door N. profundicola kan worden gemetaboliseerd, werden gewassen suspensies van met nitraat gekweekte cellen geïncubeerd in nitraatvrij groeimedium met waterstof als enige elektronendonor. Hydroxylamine werd toegevoegd als potentiële elektronenacceptor en de concentraties van zowel hydroxylamine als ammonium werden in de tijd gevolgd. Uit de resultaten van dit experiment blijkt dat met nitraat gekweekte cellen van N. profundicola hydroxylamine snel en volledig omzetten in ammonium (figuur 6). De specifieke omzettingssnelheid van hydroxylamine bedroeg in dit experiment 28,6 μM min-1 108 cellen-1. De ammoniumproductiesnelheid uit nitraat berekend voor exponentiële groei in figuur 3 (8-24 h) is ~3 μM min-1 (108 cellen)-1. De gemeten hydroxylamineconversiesnelheid is dus veel hoger dan de ammoniumproductiesnelheid die wordt waargenomen tijdens de groei van N. profundicola met nitraat. Een soortgelijke nauwe koppeling tussen hydroxylamine productie en verwijdering werd onlangs gemeld voor de chemolithotrofe ammonia-oxiderende archaeon, Nitrosopumilus maritimus, waar hydroxylamine oxidatie een essentiële katabole stap is (Vajrala et al., 2013).
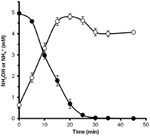
Figuur 6. Hydroxylamine wordt door N. profundicola snel omgezet in ammonium. De concentraties van hydroxylamine (gesloten cirkels) en ammonium (open cirkels) werden gevolgd na toevoeging van 5 mM hydroxylamine aan een rustende celsuspensie. De punten zijn de gemiddelde waarden van drie replicaten ± de standaardafwijking.
Discussie
De hier gepresenteerde gegevens zijn consistent met een nieuwe route voor nitraatreductie in organismen die geen klassieke NO-vormende (NirS of NirK) of ammoniumvormende (NirB/NirA) nitrietreductases hebben, met N. profundicola stam AmH als een bruikbaar modelsysteem. Er is een omgekeerde-HURM-route voorgesteld waarbij nitriet in het periplasma wordt gereduceerd tot hydroxylamine en vervolgens in het cytoplasma wordt gereduceerd tot ammonium (Campbell et al., 2009). De oorspronkelijke route is hier enigszins gewijzigd om een meer waarschijnlijke kandidaat voor de proximale elektronendonor voor Har/Hcp op te nemen, een voorspeld 4Fe-4S-bevattend eiwit dat wordt gecodeerd door NAMH_1302 (figuur 1). Homologs van NAMH_1302 worden geconserveerd in C. concisus (GenBank toetreding YP_001466207), C. curvus (YP_001408944), C. foetus (YP_892678), en C. mediatlanticus (ZP_01871213) die alle andere genen voor de omgekeerde-HURM-route bezitten. Bovendien vertoonde NAMH_1302 een toename in transcript abundantie in N. profundicola cellen gekweekt op nitraat ten opzichte van ammonium.
Hoewel de productie van hydroxylamine uit nitraat en nitriet zowel via chemische (Rollefson en Oldershaw, 1932) als biologische routes (Lindsey en Rhines, 1932) reeds lang bekend is en een 3 complex werd aangetoond om nitriet te reduceren tot hydroxylamine wanneer het wordt voorzien van reductant (Kostera et al., 2010), is de verhouding tussen de hydroxylamine- en de ammoniumproductie uit nitriet in de omgekeerde-HURM-route nog niet duidelijk. De opname van extracellulaire hydroxylamine door bacteriën is bekend; exogeen toegediende hydroxylamine hoopt zich gemakkelijk op in het anammoxosoom van Kuenenia stuttgartiensis (Lindsay et al., 2001; Schmidt et al., 2004), een compartiment dat alleen kan worden bereikt door zowel de celmembraan als de anammoxosoommembraan te passeren. De voorgestelde opname van het sterk mutagene hydroxylamine vereist bescherming tegen DNA-laesies, wat gedeeltelijk het uitgebreide complement van DNA-reparatiesystemen kan verklaren dat in N. profundicola werd geïdentificeerd (Campbell et al., 2009). Hydroxylamine is ook voorgesteld als een tussenproduct van ammoniumproductie uit nitriet in planten en algen, aangezien ferredoxine-afhankelijk nitrietreductase een hoge reactiviteit en specificiteit voor dit substraat vertoont (Kuznetsova et al., 2004; Hirasawa et al,
In tegenstelling tot de quinonreductase functie van HURM in ammoniak-oxidanten (Klotz en Stein, 2008; Simon en Klotz, 2013), stellen wij voor dat HURM in N. profundicola, vergelijkbaar met NrfAH, werkt als een periplasmatisch quinoloxidase systeem dat elektronen verplaatst van de quinolpool om nitriet te reduceren tot hydroxylamine. Het is waarschijnlijk dat de omgekeerde-HURM-pathway evolueerde uit een gemeenschappelijke voorouder van de NrfAH en ONR ammonificatie module in anammox bacteriën. Wij veronderstellen dat dit gebeurde voordat HURM – inclusief een covalent gebonden trimerisch HaoA complex dat in staat is tot hydroxylamine disproportionering – werd gebruikt als een katabole module in zowel anaerobe als aerobe ammoniak oxiderende bacteriën (Jetten et al., 2009; Klotz en Stein, 2010; Campbell et al., 2011; Kern et al., 2011; Simon en Klotz, 2013). Een soortgelijke omkering van de functie van reducerende naar oxiderende activiteit, bewerkstelligd door covalente binding-gestuurde complexvorming, is besproken voor het NO-reducerende cytochroom c’-beta (cytS) en het NO-oxiderende cytochroom P460 (cytL) (Elmore et al., 2007). Genen die coderen voor de NrfAH en omgekeerde-HURM modules komen naast elkaar voor in slechts één bacteriële genoomsequentie, C. foetus 82-40 (Tabel 1). Recent werd aangetoond dat octaheme cytochroom c hydroxylamine dehydrogenase evolueerde als lid van een multi-heme cytochroom c eiwit superfamilie met functies in de stikstof- en zwavelcycli en dat cytochroom cM552 (CycB), NrfH, en NapC leden zijn van een andere cytochroom c superfamilie (Bergmann et al., 2005; Klotz en Stein, 2008; Kern et al., 2011; Simon en Klotz, 2013). Het is ook bekend dat NAP-complexen in Epsilonproteobacteria over het algemeen geen NapC-subeenheidseiwitten bevatten (Klotz et al., 2006; Sievert et al., 2008; Kern en Simon, 2009; Klotz en Stein, 2010; Simon en Klotz, 2013). De voorgestelde omgekeerde functie van een n-cM552 (CycB/NapC) complex als een nitrietreductase-quinoloxase complex is haalbaar gezien de aanwezigheid van beide transcripten en de afwezigheid van het kritieke tyrosine eiwitligand in N. profundicola HaoA (Campbell et al, 2009), die de N-oxide reducerende NrfA en ONR scheiden van de N-oxide oxiderende HAO complexen (Bergmann et al., 2005; Klotz en Stein, 2008; Kern et al., 2011; Simon en Klotz, 2013).
De 15N assimilatiegegevens stelden vast dat N. profundicola tijdens de groei nitraat-stikstof in de biomassa opneemt wanneer deze als enige stikstofbron wordt geleverd. De grote overproductie van ammonium uit nitraat boven de berekende vraag voor biosynthese doet ons echter concluderen dat de voornaamste functie van nitraatreductie tot ammonium door N. profundicola die is van een efficiënte respiratoire elektronenacceptor. Deze conclusie wordt ondersteund door de verhoogde groeisnelheid en opbrengst in N. profundicola culturen met nitraat als enige elektronenacceptor. Verder zijn de genexpressiegegevens in overeenstemming met ons voorstel (Campbell et al., 2009) dat dit gebeurt via de gecoördineerde functie van Nap, HURM (3 en cM552) en Har/Hcp als een nieuwe N-assimilatie- en energiebehoudroute: de omgekeerde-HURM-route. Tenslotte blijkt uit de gegevens dat N. profundicola in staat is om hydroxylamine snel te reduceren tot ammonium, hetgeen consistent is met het voorstel van vrije hydroxylamine als tussenproduct in de omgekeerde-HURM-route. De hoge snelheid waarmee hydroxylamine wordt opgenomen, verklaart waarschijnlijk waarom dit niet consequent wordt waargenomen tijdens de groei van culturen op nitraat. Voorlopige metingen van de ammoniumproductie uit nitraat of nitriet in rustende cellen zijn vergelijkbaar met de 3 μM min-1 (108 cellen)-1 berekend uit culturen, ~ 10-voudig lager dan de waargenomen hydroxylamine verbruikssnelheid. Gezien deze percentages moet hydroxylamine onmiddellijk na de productie worden verbruikt in culturen die op nitraat groeien. Aangezien hydroxylamine mutageen is, veronderstellen wij dat dit een gevolg is van vroegere selectieve druk om lage hydroxylaminegehaltes te handhaven tijdens de groei.
Terwijl het labelen van biomassa is geprobeerd met 15N-NH2OH in batch N. profundicola culturen, is dit nog niet succesvol geweest (gegevens niet getoond). Aangezien hydroxylamine in batchculturen in lage concentraties ten opzichte van het ongelabelde nitraat moet worden toegediend om toxiciteit te vermijden en dat het overgrote deel van de N uit hydroxylamine moet worden omgezet in ammonium (>90% op basis van figuur 3), is dit resultaat niet verrassend. Kortetermijnexperimenten met veel hogere concentraties gelabeld hydroxylamine als enige N-bron kunnen dit punt definitief vaststellen.
Concluderend zijn de hier gepresenteerde gegevens consistent met een model waarin N. profundicola nitraat reduceert via een vrij hydroxylamine tussenproduct. Deze experimenten sluiten nog niet volledig de mogelijkheid uit dat de omgekeerd-HURM-activiteit die in N. profundicola wordt voorgesteld, functioneert als een ammoniumvormend nitrietreductase dat 6 elektronen overdraagt zonder een N-oxide tussenproduct vrij te maken. Ongepubliceerde resultaten wijzen erop dat enkele puntmutaties in het nrfA-gen pentaheme cytochrome c nitrietreductase kunnen veranderen in een lek enzym dat N-oxide tussenproducten vrijgeeft en er niet in slaagt nitriet stoichiometrisch in ammonium om te zetten (Jörg Simon, pers. communi.). Gezien de evolutionaire relatie tussen nrfA en haoA (Bergmann et al., 2005; Simon and Klotz, 2013), zou de omgekeerde-HURM module in N. profundicola van nature kunnen functioneren als een ammonium- en hydroxylamine-producerend enzymcomplex terwijl het huidige NrfA “lekvrij” werkt als een ammonium-producerend nitrietreductase. Verdere experimenten met remmers van Har/Hcp met nitraat of nitriet als substraat in hele cellen en/of biochemische studies van het omgekeerde-HURM complex om het in vitro product te bepalen moeten aanvullende directe tests van deze hypothese opleveren. Ongeacht het specifieke mechanisme suggereert de uitgebreide productie van ammonium die de biosynthetische behoeften van N. profundicola ver overschrijdt, dat deze en verwante Epsilonproteobacteriën een ecologische rol kunnen spelen als bron van ammonium in nitraatrijke, ammoniumarme, hypoxische omgevingen waarin zij veelvuldig voorkomen.
Materialen en methoden
Berekeningen van de vrije energie
Gibbs vrije energieën (Tabel 2) werden berekend uit standaard redoxpotentialen van de halfreacties met behulp van de Nernst-vergelijking (Δ G0 = -nFE0) of door sommatie van halfreactie vrije energieën verzameld uit de literatuur (Thauer et al., 1977; van der Star et al., 2008). Alle berekeningen werden uitgevoerd bij standaard condities (1 M alle soorten, 25°C, pH = 7).
Kweek en stikstof-verbindingen analyse
N. profundicola stam AmH (ATCC BAA-1463) werd gekweekt en cellen geteld zoals eerder beschreven (Smith et al., 2008; Campbell et al., 2009). Ammonium in kweeksupernatanten werd gekwantificeerd na derivatisering met dansylchloride en scheiding door HPLC met fluorescentiedetectie (Shakila et al., 2001). Nitraat werd gekwantificeerd door HPLC met UV/Vis-detectie. Hydroxylamine concentraties werden bepaald in cultuur filtraten (0,2 micrometer) zoals beschreven door Frear en Burrell (1955).
15N Labeling Procedures
Stock oplossingen van 20 Atom% 15N-nitraat en 15N-ammonium werden bereid door het mengen van >99 Atom% en natuurlijke abundantie zouten om medium te bereiden op een eindconcentratie van 5 mM nitraat of ammonium, zoals nodig. Cellen werden geoogst uit 15N gelabelde culturen door centrifugatie en de celpellet werd driemaal gewassen met nanopure water om zouten te verwijderen. De celsuspensie werd gedroogd in tinnen capsules die naar het laboratorium voor stabiele isotopen van de Universiteit van Californië-Davis werden gezonden, waar het 15N Atom % werd bepaald met behulp van isotopenverhouding-massaspectrometrie. Controlemonsters gaven aan dat er geen isotopenverontreiniging was opgetreden tijdens de verwerking van de monsters (gegevens niet weergegeven).
Quantitatieve PCR
Genespecifieke primers (tabel 3) werden gebruikt om de mRNA-abundantie te kwantificeren in totaal RNA geëxtraheerd uit N. profundicola zoals eerder beschreven (Campbell et al., 2009).

Tabel 3. Primers en voorwaarden voor Q-RT-PCR kwantificering van specifieke genen in totaal RNA monsters geëxtraheerd uit N. profundicola.
Hydroxylamine Uptake
N. profundicola werd gekweekt op H2 en formiaat als elektron donoren en nitraat als de enige elektron acceptor tot de late exponentiële fase. Cellen werden geoogst door centrifugatie. Alle overdrachten en celwasbeurten werden uitgevoerd in een anaërobe kamer van Coy Laboratories. Cellen werden geresuspendeerd met nitraatvrij groeimedium tot een eindconcentratie van ~109 cellen ml-1 en geïncubeerd bij 45°C gedurende 2 uur onder een atmosfeer van 80% H2 + 20% CO2 voorafgaand aan de toevoeging van hydroxylamine (5 mM eindconcentratie) uit een anaëroob bereide voorraadoplossing. Aliquots van de celsuspensie werden gefiltreerd en op hydroxylamine onderzocht zoals hierboven beschreven en op ammonium door HPLC na derivatisering met diethyl ethoxymethylenemalonaat (Gómez-Alonso et al., 2007).
Bijdragen van auteurs
Thomas E. Hanson, Barbara J. Campbell, en Martin G. Klotz hebben samen experimenten ontworpen en resultaten geïnterpreteerd, Thomas E. Hanson heeft alle stikstofanalyses uitgevoerd en monsters voorbereid voor massaspectrometrie, Barbara J. Campbell heeft alle culturen gekweekt en kwantitatieve PCR uitgevoerd, Katie M. Kalis heeft hydroxylamine-opname-experimenten uitgevoerd, Mark A. Campbell heeft NAMH_1302 als een relevant gen geïdentificeerd. Thomas E. Hanson redigeerde het artikel, dat vervolgens werd herzien door Thomas E. Hanson, Barbara J. Campbell, en Martin G. Klotz.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in de afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
De auteurs willen Lisa Y. Stein (Univ. Alberta-Edmonton), Jenn Macalady (Penn State Univ.), David Kirchman en Matt Cottrell (Univ. Delaware) bedanken voor het kritisch lezen van concept manuscripten, Jennifer Biddle voor toegang tot eenaerobic kamer en Kathy Coyne voor toegang tot een HPLC. Dit project werd ondersteund door subsidies van de National Science Foundation aan Barbara J. Campbell en S. Craig Cary (EF-0333203), aan Barbara J. Campbell (DEB-0640414), aan Barbara J. Campbell en Thomas E. Hanson (MCB-0950691), en aan Martin G. Klotz (MCB-0948202/1202648), door een EPSCoR RII-2 subsidie aan de Universiteit van Delaware (EPS-0814251), en door stimuleringsfondsen verstrekt door de Universiteit van North Carolina aan Martin G. Klotz.
Kern, M., en Simon, J. (2009). Electron transport chains and bioenergetics of respiratory nitrogen metabolism in Wolinella succinogenes and other Epsilonproteobacteria. Biochim. Biophys. Acta 1787, 646-656. doi: 10.1016/j.bbabio.2008.12.010
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Lindsey, G. A., and Rhines, C. M. (1932). The production of hydroxylamine by the reduction of nitrates and nitrites by various pure cultures of bacteria. J. Bacteriol. 24, 489-492.
Pubmed Abstract | Pubmed Full Text
Loferer-Krossbacher, M., Klima, J., and Psenner, R. (1998). Bepaling van de droge massa van bacteriële cellen met behulp van transmissie-elektronenmicroscopie en densitometrische beeldanalyse. Application. Environ. Microbiol. 64, 688-694.
Pubmed Abstract | Pubmed Full Text