BIOKEMISKA TÄMNINGAR
Dihedrala vinklar (eller torsionsvinklar)
Definitioner av bindningsvinklar och dihedrala vinklar (torsionsvinklar). Polypeptidhuvudkedjans dihedrala vinklar, φ, ψ och ω. Ramachandran-ritningar.
De konformationer som biologiska molekyler antar bestämmer de fysiska och kemiska egenskaper som de uppvisar i biologiska system. Därför behöver vi ett sätt att beskriva de konformationer som observeras för de typer av molekyler som studeras inom biokemin. Huvudfokus i det här avsnittet kommer att ligga på polypeptidkonformationer, som en förberedelse för att förstå struktur-funktionsförhållandena i proteiner
En dihedralvinkel – även kallad torsionsvinkel – definieras av fyra sekventiellt bundna atomer. Detta representeras i figuren nedan av strukturen A-B-C-D (andra panelen; observera skillnaden mellan bindningsvinkel och torsionsvinkel). Föreställ dig att du tittar längs bindningen mellan atomerna B och C (vilket indikeras av pilen). Detta är den centrala bindningen av de tre definierade bindningarna. Först ser vi B-C-bindningen i figurens plan, med B-A-bindningen pekande åt vänster och uppåt utanför planet, och C-D-bindningen pekande nedåt och åt höger. Sedan tar vi upp denna struktur och börjar vrida den så att vi kan se rakt ner på B-C-bindningen (tredje panelen). Så småningom är vår vy likvärdig med Newmanprojektionen i den sista panelen. Från denna vy är dihedralvinkeln τ den skenbara vinkel som D har i förhållande till A, enligt bilden. Vi definierar värdeområdet för dihedralvinkeln som , och värdet på τ är ungefär -150°. (Den negativa delen av området motsvarar när D är moturs i förhållande till A.)
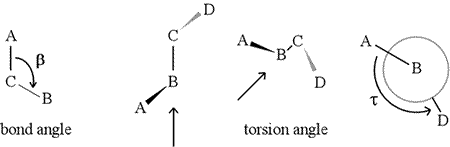
Självklart kan andra atomer vara knutna till B och C – och det är de vanligen. Vi skulle behöva specificera vilka atomer som motsvarar A, B, C och D för att entydigt definiera dihedralvinkeln. För långa oförgrenade polymerer, som proteiner, är det rimligt att kräva att A till D är alla huvudkedjans atomer. Nedan finns en molekylgrafisk bild som motsvarar ovanstående skiss och som illustrerar definitionen av polypeptidhuvudkedjans dihedralvinkel Phi (φ).
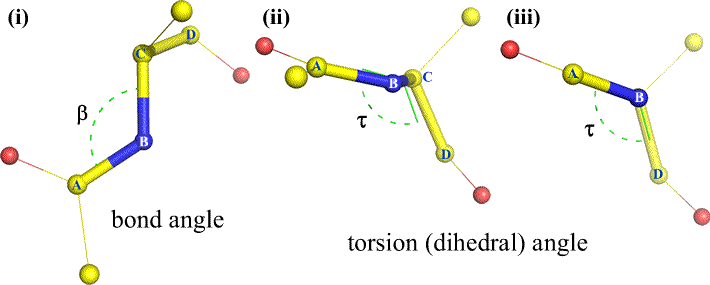
Polypeptidhuvudkedjans dihedralvinkel: Phi (φ), Psi (ψ) och Omega (ω)
En dihedralvinkel definieras av fyra atomer. Den kan visualiseras genom att titta ner på den centrala bindningen (dvs. bindningen från atom 2 till atom 3). Dihedralvinklarna längs en polypeptidkedja är av tre typer:
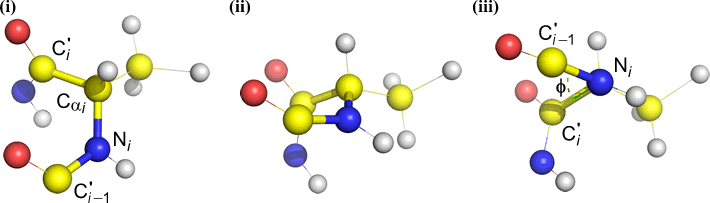
Phi (φ) – centralbindning mellan N(i) och C(alfa, i) . Titta ner på bindningen N(i)-Cα(i), notera den vinkel som acylkolet C(i) har i förhållande till C(i-1) – acylkolet från föregående rest.
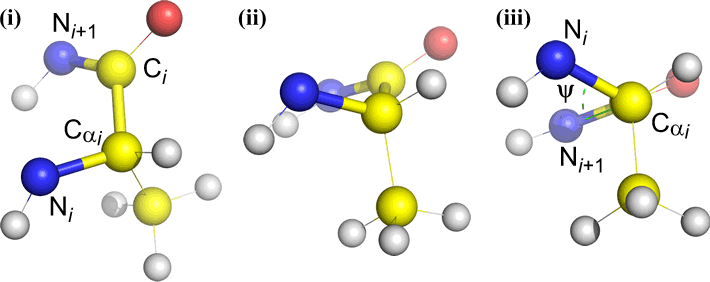
Psi (ψ) – centralbindning mellan C(alfa, i) och C(i) . Titta ner på bindningen Cα(i)-C(i), notera den vinkel som N(i + 1) utgör i förhållande till N(i).
Omega (ω) – peptidbindningen mellan acylkolet C(i) och N(i+1) är den centrala bindningen.
Phi (φ) och psi (ψ) kallas ibland Ramachandranvinklar, eftersom de används i en tvådimensionell plott av huvudkedjans dihedrala vinklar som kallas Ramachandranplott (se nedan).
Ramachandran plot
Ramachandran plot är en graf över huvudkedjans dihedrala vinklar phi (φ) och psi (ψ) för en polypeptidkedja, med phi (φ) värden längs x-axeln och psi (ψ) värden längs y-axeln.
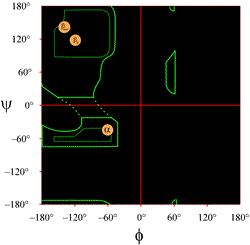
Layouten för en Ramachandranplott som vanligtvis presenteras i läroböcker visas till vänster (klicka på figuren för att visa en större version). Konturerna anger omfattningen av tillåtna (ljusgröna) och mest gynnade (mörkgröna) kombinationer av (φ, ψ). De orangefärgade cirklarna visar var de ideala phi- och psi-värdena för de vanligaste regelbundna sekundära strukturella egenskaperna, betasträngar (i antiparallella och parallella ark) och alfahelixer, finns. Utanför dessa cirklar är motsvarande konformationer missgynnade eller otillåtna. De exakta platserna för countours bör inte tas alltför bokstavligt, eftersom de gynnsamma och tillåtna regionerna beror på resternas identitet. Särskilt glycin har mycket större tillåtna områden än vad som visas här. Detta diskuteras vidare nedan.
En ”riktig” Ramachandran-plott
I ”slutspelet” av proteinstrukturbestämningen måste den experimentellt bestämda modellen analyseras med avseende på dess stereokemiska kvalitet. Allvarliga problem med modellen kan indikeras om det finns exempel på icke-Gly-rester vars dihedralvinklar i huvudkedjan ligger utanför de tillåtna regionerna, eller om en alltför stor andel av resterna ligger utanför den mest gynnade regionen. Ett exempel på en Ramachandran-plott för ett protein med 190 rester visas i den bifogade figuren.
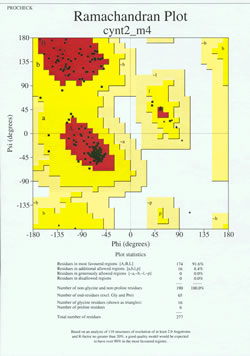
Figuren visar en Ramachandran-plott för en proteinstruktur som bestämts genom röntgenkristallografi. (Klicka på den för att se en större version i ett nytt fönster.) Varje svart ruta representerar huvudkedjans konformation vid en rest i proteinet. Observera hur phi, psi-värdena för resterna grupperar sig i de röda ”mest gynnade” regionerna. Den röda regionen uppe till vänster (märkt ”B” i figuren) motsvarar rester i en betasträngkonformation av huvudkedjan, medan det stora området nära mitten (märkt ”A”) motsvarar alfahelixen. Det tredje, lilla röda området i figuren är där rester som antar en vänsterhänt (”L”) alfahelix är belägna. En del av resterna ligger i ”ytterligare tillåtna områden” (ljusgult) som gränsar till de mest gynnade områdena. Observera att glycinresterna (markerade som trianglar) i vissa fall ligger i ”otillåtna områden”. Detta beror på att Gly, med endast den lilla väteatomen som ”sidokedja”, är mycket mindre steriskt belastad än andra aminosyror. Gly kan anta par av phi, psi vinklar som inte är tillåtna för någon annan rest.