BIOCHEMISTYKA
Kąty diadyczne (lub skrętne)
Definicje kąta wiązania i kąta diadycznego (skrętnego). Kąty dwuścienne łańcucha głównego polipeptydu, φ, ψ i ω. Działki Ramachandrana.
Konformacje, jakie przyjmują cząsteczki biologiczne, determinują właściwości fizyczne i chemiczne, jakie wykazują one w układach biologicznych. Dlatego potrzebujemy sposobu, aby opisać konformacje obserwowane dla typów cząsteczek badanych w biochemii. Główny nacisk w tym rozdziale zostanie położony na konformacje polipeptydów, jako przygotowanie do zrozumienia zależności struktura-funkcja w białkach
Kąt dwuścienny – zwany również kątem skręcenia – jest zdefiniowany przez cztery kolejno połączone atomy. Jest to reprezentowane na rysunku poniżej przez strukturę A-B-C-D (drugi panel; zwróć uwagę na rozróżnienie między kątem wiązania i kątem skręcenia). Wyobraźmy sobie, że patrzymy wzdłuż wiązania pomiędzy atomami B i C (jak wskazuje strzałka). Jest to wiązanie centralne spośród trzech zdefiniowanych wiązań. Na początku widzimy wiązanie B-C w płaszczyźnie rysunku, przy czym wiązanie B-A skierowane jest w lewo i w górę poza płaszczyznę, a wiązanie C-D skierowane jest w dół i w prawo. Następnie podnosimy tę strukturę i zaczynamy ją obracać tak, abyśmy mogli patrzeć prosto w dół na wiązanie B-C (trzeci panel). Ostatecznie, nasz widok odpowiada rzutowi Newmana w ostatnim panelu. Z tego widoku, kąt dwuścienny τ jest pozornym kątem odjętym przez D względem A, jak pokazano na rysunku. Definiujemy zakres wartości kątów dwuściennych jako , a wartość τ wynosi około -150° (ujemna część zakresu odpowiada sytuacji, gdy D jest przeciwnie do ruchu wskazówek zegara względem A.)
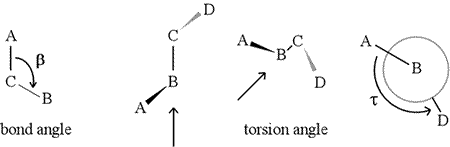
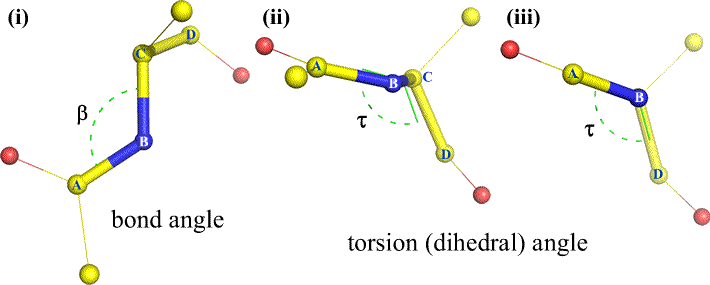
Oczywiście, do B i C mogą być dołączone inne atomy – i zwykle są. Musielibyśmy określić, które atomy odpowiadają A, B, C i D, aby jednoznacznie zdefiniować kąt dwuścienny. W przypadku długich nierozgałęzionych polimerów, takich jak białka, sensowne jest wymaganie, aby atomy od A do D były atomami łańcucha głównego. Poniżej znajduje się obraz grafiki molekularnej, który odpowiada powyższemu szkicowi i ilustruje definicję kąta dwuścianu łańcucha głównego polipeptydu Phi (φ).
Kąty dwuścianu łańcucha głównego polipeptydu: Phi (φ), Psi (ψ), i Omega (ω)
Kąt dwuścienny jest zdefiniowany przez cztery atomy. Można go zobrazować patrząc w dół na centralne wiązanie (tj. wiązanie od atomu 2 do atomu 3). Kąty dwuścienne wzdłuż łańcucha polipeptydowego są trzech typów:
Phi (φ) – centralne wiązanie pomiędzy N(i) i C(alfa, i) . Patrząc w dół wiązania N(i)-Cα(i), zwróć uwagę na kąt, jaki tworzy węgiel acylowy C(i) względem C(i-1) – węgla acylowego z poprzedniej reszty.
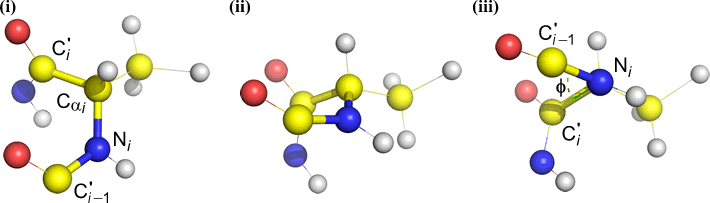
Psi (ψ) – wiązanie centralne pomiędzy C(alfa, i) a C(i) . Patrząc w dół na wiązanie Cα(i)-C(i), zwróć uwagę na kąt odejmowany przez N(i + 1) względem N(i).
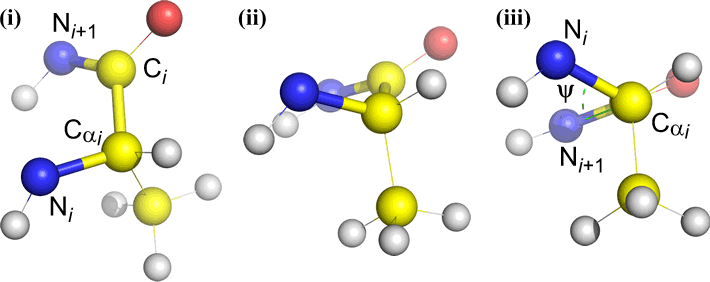
Omega (ω) – wiązanie peptydowe pomiędzy węglem acylowym C(i) a N(i+1) jest wiązaniem centralnym.
Phi (φ) i psi (ψ) są czasami określane jako kąty Ramachandrana, ponieważ są używane w dwuwymiarowym wykresie kątów dwuścianu łańcucha głównego zwanym wykresem Ramachandrana (patrz poniżej).
Krąg Ramachandrana
Krąg Ramachandrana jest wykresem kątów dwuścianu łańcucha głównego phi (φ) i psi (ψ) dla łańcucha polipeptydowego, z wartościami phi (φ) wzdłuż osi x i wartościami psi (ψ) wzdłuż osi y.
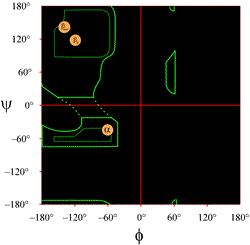
Układ wykresu Ramachandrana, jak zwykle przedstawiany w podręcznikach, jest pokazany po lewej stronie (kliknij na rysunek, aby wyświetlić większą wersję). Kontury wskazują zakres dozwolonych (jasnozielony) i najbardziej preferowanych (ciemnozielony) kombinacji (φ, ψ). Pomarańczowe kółka pokazują położenie idealnych wartości phi, psi dla najczęstszych regularnych cech struktury drugorzędowej, nici beta (w antyrównoległych i równoległych arkuszach) i heliksów alfa. Poza tymi konturami, odpowiadające im konformacje są niepożądane lub niedozwolone. Dokładne położenie konturów nie powinno być traktowane zbyt dosłownie, ponieważ korzystne i dozwolone regiony zależą od tożsamości reszt. Glicyna, w szczególności, ma znacznie większe dozwolone regiony niż pokazane tutaj. Jest to omówione poniżej.
„Prawdziwy” wykres Ramachandrana
W „końcowej rozgrywce” wyznaczania struktury białka, eksperymentalnie wyznaczony model musi być przeanalizowany pod kątem jego jakości stereochemicznej. Poważne problemy z modelem mogą być zasygnalizowane, jeśli istnieją przypadki reszt nie-Gly, których kąty dwuścienne łańcucha głównego leżą poza dozwolonymi regionami, lub jeśli zbyt duża część reszt znajduje się poza najbardziej preferowanym regionem. Przykład wykresu Ramachandrana dla białka o 190 resztach jest pokazany na załączonym rysunku.
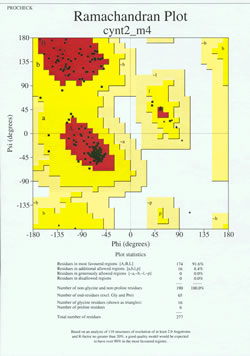
Rysunek przedstawia wykres Ramachandrana dla struktury białka wyznaczonej metodą krystalografii rentgenowskiej. (Kliknij na niego, aby wyświetlić jego większą wersję w nowym oknie.) Każdy czarny kwadrat reprezentuje konformację łańcucha głównego przy jednej reszcie białka. Zwróć uwagę jak wartości phi, psi dla reszt skupiają się w czerwonych „najbardziej preferowanych” regionach. Czerwony obszar u góry po lewej (oznaczony na rysunku jako „B”) odpowiada resztom w konformacji beta łańcucha głównego, podczas gdy duży obszar w pobliżu środka (oznaczony jako „A”) odpowiada helisie alfa. Trzeci, mały czerwony obszar wykresu to miejsce, gdzie znajdują się reszty, które przyjmują lewoskrętną („L”) helisę alfa. Niektóre z tych reszt leżą w „dodatkowych dozwolonych regionach” (jasnożółte), które graniczą z regionami najbardziej faworyzowanymi. Zauważmy, że reszty glicyny (oznaczone jako trójkąty) leżą w niektórych przypadkach w „regionach niedozwolonych”. Dzieje się tak dlatego, że Gly, z małym atomem wodoru jako „łańcuchem bocznym”, jest znacznie mniej obciążona sterycznie niż inne aminokwasy. Gly jest w stanie przyjąć pary kątów phi, psi, które nie są dozwolone dla żadnej innej reszty.