Sujets de biochimie
Angles dièdres (ou de torsion)
Définitions de l’angle de liaison et de l’angle dihdral (de torsion). Angles dièdres de la chaîne principale des polypeptides, φ, ψ, et ω. Graphiques de Ramachandran.
Les conformations que les molécules biologiques adoptent déterminent les propriétés physiques et chimiques qu’elles présentent dans les systèmes biologiques. Par conséquent, nous avons besoin d’un moyen de décrire les conformations observées pour les types de molécules étudiées en biochimie. Dans cette section, l’accent principal sera mis sur les conformations des polypeptides, comme préparation à la compréhension des relations structure-fonction dans les protéines
Un angle dièdre – également appelé angle de torsion – est défini par quatre atomes liés séquentiellement. Il est représenté dans la figure ci-dessous par la structure A-B-C-D (deuxième panneau ; notez la distinction entre angle de liaison et angle de torsion). Imaginez que vous regardez le long de la liaison entre les atomes B et C (comme indiqué par la flèche). Il s’agit de la liaison centrale des trois liaisons définies. Au début, nous voyons la liaison B-C dans le plan de la figure, avec la liaison B-A pointant vers la gauche et vers le haut hors du plan, et la liaison C-D pointant vers le bas et vers la droite. Ensuite, nous prenons cette structure et commençons à la tourner de manière à pouvoir regarder directement la liaison B-C (troisième panneau). Finalement, notre vue est équivalente à la projection de Newman dans le dernier panneau. De ce point de vue, l’angle dièdre τ est l’angle apparent sous-tendu par D par rapport à A, comme indiqué. Nous définissons la gamme de valeurs des angles dièdres comme étant , et la valeur de τ est d’environ -150° (La partie négative de la gamme correspond au moment où D est dans le sens inverse des aiguilles d’une montre par rapport à A.)
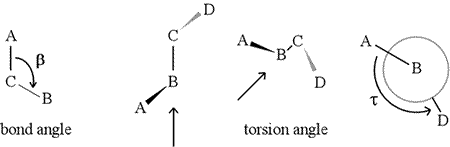
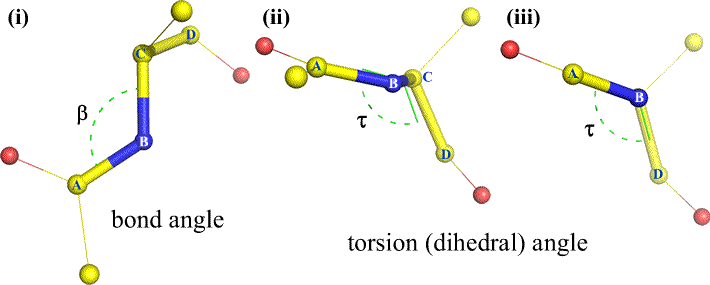
Bien sûr, d’autres atomes peuvent être attachés à B et C – et le sont généralement. Il nous faudrait préciser quels atomes correspondent à A, B, C et D pour définir sans ambiguïté l’angle dièdre. Pour les longs polymères non ramifiés, comme les protéines, il est logique d’exiger que A à D soient tous des atomes de la chaîne principale. Vous trouverez ci-dessous une image de graphisme moléculaire correspondant au croquis ci-dessus et illustrant la définition de l’angle dièdre de la chaîne principale d’un polypeptide Phi (φ).
Angles dièdres dièdres de la chaîne principale d’un polypeptide : Phi (φ), Psi (ψ) et Omega (ω)
Un angle dièdre est défini par quatre atomes. Il peut être visualisé en regardant vers le bas de la liaison centrale (c’est-à-dire la liaison de l’atome 2 à l’atome 3). Les angles dièdres le long d’une chaîne polypeptidique sont de trois types :
Phi (φ) – liaison centrale entre N(i) et C(alpha, i) . Regardez vers le bas la liaison N(i)-Cα(i), notez l’angle sous-tendu par le carbone acyle C(i) par rapport à C(i-1) – le carbone acyle du résidu précédent.
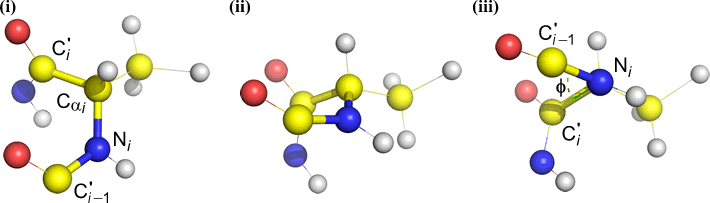
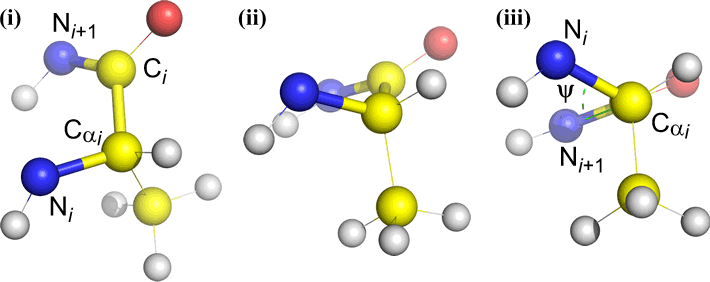
Psi (ψ) – liaison centrale entre C(alpha, i) et C(i) . Regardez vers le bas la liaison Cα(i)-C(i), notez l’angle sous-tendu par N(i + 1) par rapport à N(i).
Omega (ω) – la liaison peptidique entre le carbone acyle C(i) et N(i+1) est la liaison centrale.
Phi (φ) et psi (ψ) sont parfois appelés angles de Ramachandran, car ils sont utilisés dans un tracé bidimensionnel des angles dièdres de la chaîne principale appelé tracé de Ramachandran (voir ci-dessous).
Tracé de Ramachandran
Le tracé de Ramachandran est un graphique des angles dièdres de la chaîne principale phi (φ) et psi (ψ) pour une chaîne polypeptidique, avec les valeurs de phi (φ) le long de l’axe des x et les valeurs de psi (ψ) le long de l’axe des y.
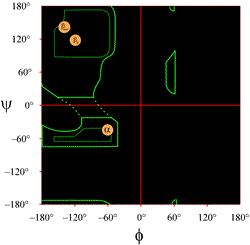
La disposition d’un tracé de Ramachandran tel qu’il est généralement présenté dans les manuels est illustrée à gauche (cliquez sur la figure pour afficher une version plus grande). Les contours indiquent l’étendue des combinaisons autorisées (vert clair) et les plus favorisées (vert foncé) de (φ, ψ). Les cercles orange montrent les emplacements des valeurs idéales de phi, psi pour les caractéristiques structurelles secondaires régulières les plus courantes, les brins bêta (en feuillets antiparallèles et parallèles) et les hélices alpha. En dehors des contours, les conformations correspondantes sont défavorisées ou interdites. Les emplacements exacts des contours ne doivent pas être pris trop au pied de la lettre, car les régions favorables et autorisées dépendent de l’identité du résidu. La glycine, en particulier, a des régions autorisées beaucoup plus grandes que celles montrées ici. Ceci est discuté plus loin.
Un « vrai » tracé de Ramachandran
Dans la « finale » de la détermination de la structure des protéines, le modèle déterminé expérimentalement doit être analysé pour sa qualité stéréochimique. De sérieux problèmes avec le modèle peuvent être indiqués s’il y a des cas de résidus non-Gly dont les angles dièdres de la chaîne principale se trouvent en dehors des régions autorisées, ou si une proportion trop élevée de résidus se trouve en dehors de la région la plus favorisée. Un exemple de tracé de Ramachandran pour une protéine de 190 résidus est illustré dans la figure ci-jointe.
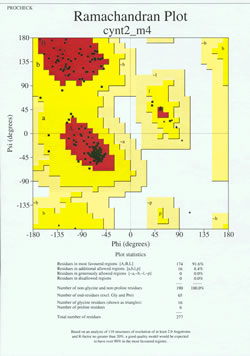
La figure montre un tracé de Ramachandran pour une structure de protéine déterminée par cristallographie aux rayons X. (Cliquez dessus pour en afficher une version plus grande dans une nouvelle fenêtre.) Chaque carré noir représente la conformation de la chaîne principale au niveau d’un résidu de la protéine. Notez comment les valeurs phi, psi pour les résidus se regroupent dans les régions rouges « les plus favorisées ». La région rouge en haut à gauche (étiquetée « B » dans la figure) correspond aux résidus dans une conformation de brin bêta de la chaîne principale, tandis que la grande zone près du milieu (étiquetée « A ») correspond à l’hélice alpha. La troisième petite zone rouge du graphique correspond aux résidus qui adoptent une hélice alpha gauchère (« L »). Certains de ces résidus se trouvent dans des « régions autorisées supplémentaires » (jaune vif) qui bordent les régions les plus favorisées. Notez comment les résidus de glycine (indiqués par des triangles) se trouvent dans certains cas dans des « régions non autorisées ». Cela s’explique par le fait que la Gly, dont la « chaîne latérale » ne comporte qu’un petit atome d’hydrogène, est beaucoup moins encombrée stériquement que les autres acides aminés. Gly est capable d’adopter des paires d’angles phi, psi qui ne sont autorisés pour aucun autre résidu.