TÓPICOS BIOCEMISTRIA
Ângulos diedros (ou de torção)
Definições de ângulo de ligação e ângulo dihdral (torção). Ângulos dielétricos da cadeia principal de polipéptidos, φ, ψ, e ω. Lotes de Ramachandran.
As conformações que as moléculas biológicas adotam determinam as propriedades físicas e químicas que elas exibem nos sistemas biológicos. Portanto, precisamos de uma forma de descrever as conformações observadas para os tipos de moléculas estudadas em bioquímica. O foco principal nesta seção será sobre as conformações de polipeptídeos, como uma preparação para compreender as relações estrutura-função em proteínas
Um ângulo diedro – também chamado ângulo de torção – é definido por quatro átomos ligados sequencialmente. Isto é representado na figura abaixo pela estrutura A-B-C-D (segundo painel; note a distinção entre ângulo de ligação e ângulo de torção). Imagine olhar ao longo da ligação entre os átomos B e C (como indicado pela seta). Esta é a ligação central das três ligações definidas. No início, vemos a ligação B-C no plano da figura, com a ligação B-A apontando para a esquerda e para cima fora do plano, e a ligação C-D apontando para baixo e para a direita. Depois pegamos nesta estrutura, e começamos a virá-la para que possamos olhar para baixo a ligação B-C (terceiro painel). Eventualmente, nossa visão é equivalente à projeção de Newman no último painel. A partir desta vista, o ângulo diedro τ é o ângulo aparente subtendido por D em relação a A, como mostra a figura. Nós definimos o intervalo de valores dos ângulos diedros a ser , e o valor de τ é cerca de -150° (A parte negativa do intervalo corresponde a quando D é anti-horário em relação a A.)
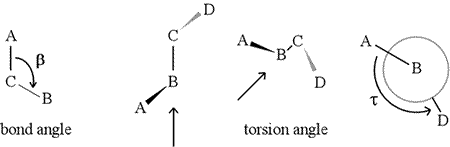
O curso, outros átomos podem ser ligados a B e C – e normalmente são. Teríamos de especificar que átomos correspondem a A, B, C e D para definir sem ambiguidade o ângulo diedro. Para polímeros longos não ramificados, como as proteínas, faz sentido exigir que A a D sejam todos os átomos principais da cadeia. Abaixo está uma imagem gráfica molecular que corresponde ao esboço acima e ilustra a definição do polipéptido da cadeia principal ângulo diedroédrico Phi (φ).
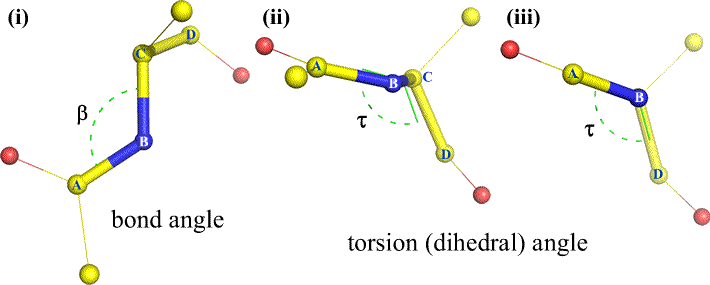
Polipéptido da cadeia principal ângulos diedroédricos: Phi (φ), Psi (ψ), e Omega (ω)
Um ângulo diedro é definido por quatro átomos. Ele pode ser visualizado olhando para baixo a ligação central (ou seja, a ligação do átomo 2 ao átomo 3). Os ângulos diedros ao longo de uma cadeia de polipeptídeos são de três tipos:
Phi (φ) – ligação central entre N(i) e C(alfa, i) . Observe abaixo a ligação N(i)-Cα(i), note o ângulo subtendido pelo carbono acyl C(i) em relação ao C(i-1) – o carbono acyl do resíduo anterior.
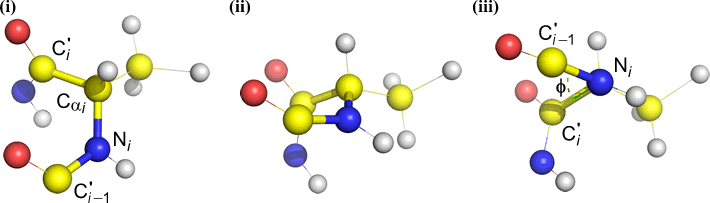
Psi (ψ) – ligação central entre C(alfa, i) e C(i) . Veja abaixo a ligação Cα(i)-C(i), note o ângulo subtendido por N(i + 1) em relação a N(i).
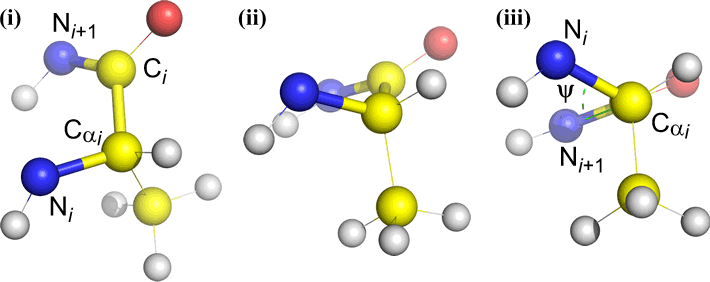
Omega (ω) – a ligação peptídeo entre o carbono acyl C(i) e N(i+1) é a ligação central.
Phi (φ) e psi (ψ) são às vezes referidos como ângulos Ramachandran, uma vez que são usados em uma trama bidimensional de ângulos de cadeia principal chamada de trama Ramachandran (ver abaixo).
Plotagem Ramachandran
A trama Ramachandran é um gráfico dos ângulos principais da cadeia diádrica phi (φ) e psi (ψ) para uma cadeia de polipéptidos, com valores phi (φ) ao longo do eixo x e valores psi (ψ) ao longo do eixo y.
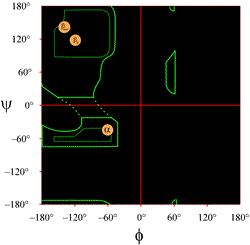
O layout de um gráfico Ramachandran como tipicamente apresentado nos livros didáticos é mostrado à esquerda (clique na figura para exibir uma versão maior). Os contornos indicam a extensão das combinações permitidas (verde claro) e mais favorecidas (verde escuro) de (φ, ψ). Os círculos alaranjados mostram a localização dos phi ideais, valores psi para as características estruturais secundárias regulares mais comuns, fios beta (em folhas paralelas e antiparalelas) e hélices alfa. Fora dos contornos, as conformações correspondentes não são favorecidas ou proibidas. As localizações exactas dos contadores não devem ser tomadas demasiado à letra, uma vez que as regiões favoráveis e permitidas dependem da identidade dos resíduos. Glycine, em particular, tem regiões permitidas muito maiores do que as aqui mostradas. Isto é discutido mais abaixo.
Um gráfico “real” Ramachandran
No “jogo final” de determinação da estrutura da proteína, o modelo determinado experimentalmente deve ser analisado por sua qualidade estereoquímica. Problemas sérios com o modelo podem ser indicados se houver casos de resíduos não glicosos cujos ângulos da cadeia principal estejam fora das regiões permitidas, ou se uma proporção muito alta dos resíduos estiver fora da região mais favorecida. Um exemplo de um gráfico Ramachandran para uma proteína de 190 resíduos é mostrado na figura que acompanha o modelo.
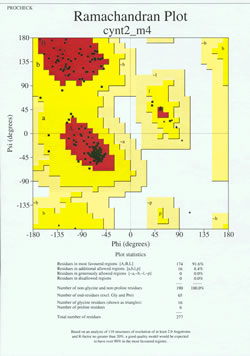
A figura mostra um gráfico Ramachandran para uma estrutura protéica determinada por cristalografia de raios X. (Clique sobre ele para ver uma versão maior em uma nova janela.) Cada quadrado preto representa a conformação da cadeia principal em um resíduo da proteína. Observe como os valores phi, psi para os resíduos se agrupam nas regiões vermelhas “mais favorecidas”. A região vermelha na parte superior esquerda (rotulada “B” na figura) corresponde aos resíduos em uma conformação beta da cadeia principal, enquanto a grande área próxima ao meio (rotulada “A”) corresponde à hélice alfa. A terceira, pequena área vermelha da trama é onde estão localizados os resíduos que adotam uma hélice alfa canhota (“L”). Alguns dos resíduos encontram-se em “regiões adicionais permitidas” (amarelo vivo) que bordejam as regiões mais favorecidas. Observe como os resíduos de glicina (indicados como triângulos) se encontram em alguns casos em “regiões proibidas”. Isto porque Gly, com apenas o pequeno átomo de hidrogênio como sua “cadeia lateral”, é muito menos estéril do que outros aminoácidos. Gly é capaz de adotar pares de phi, ângulos psi que não são permitidos para nenhum outro resíduo.