TÉMATA Z BIOCHEMIE
Difedrální (nebo torzní) úhly
Definice vazebného úhlu a dihdrálního (torzního) úhlu. Dihedrální úhly hlavního řetězce polypeptidů, φ, ψ a ω. Ramachandranovy grafy.
Konformace, které biologické molekuly zaujímají, určují fyzikální a chemické vlastnosti, které vykazují v biologických systémech. Proto potřebujeme způsob, jak popsat konformace pozorované u typů molekul studovaných v biochemii. Hlavní pozornost v této části bude věnována konformacím polypeptidů jako přípravě na pochopení vztahů mezi strukturou a funkcí v proteinech
Dihedrální úhel – nazývaný také torzní úhel – je definován čtyřmi postupně vázanými atomy. Na obrázku níže je to znázorněno strukturou A-B-C-D (druhý panel; všimněte si rozdílu mezi vazebným a torzním úhlem). Představte si, že se díváte podél vazby mezi atomy B a C (jak ukazuje šipka). Jedná se o centrální vazbu ze tří definovaných vazeb. Nejprve vidíme vazbu B-C v rovině obrázku, přičemž vazba B-A směřuje doleva a nahoru mimo rovinu a vazba C-D směřuje dolů a doprava. Poté tuto strukturu zvedneme a začneme ji otáčet tak, abychom se mohli dívat přímo dolů na vazbu B-C (třetí panel). Nakonec náš pohled odpovídá Newmanově projekci na posledním panelu. Z tohoto pohledu je dihedrální úhel τ zdánlivý úhel, který svírá D vzhledem k A, jak je znázorněno na obrázku. Definujeme rozsah hodnot dihedrálních úhlů , přičemž hodnota τ je přibližně -150° (Záporná část rozsahu odpovídá tomu, když je D vůči A proti směru hodinových ručiček.)
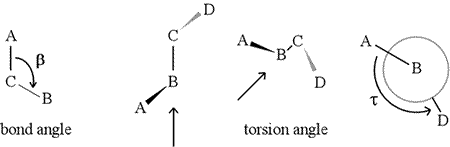
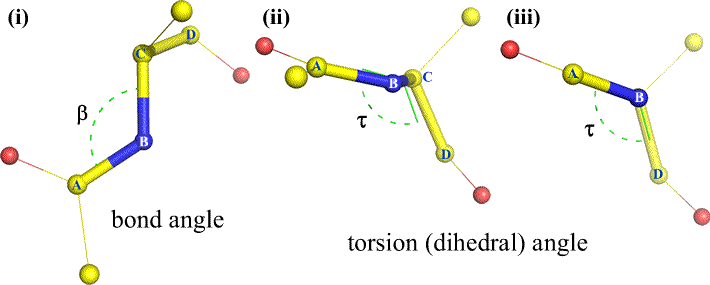
K B a C mohou být samozřejmě připojeny další atomy – a obvykle jsou. Museli bychom určit, které atomy odpovídají A, B, C a D, abychom jednoznačně definovali dihedrální úhel. U dlouhých nerozvětvených polymerů, jako jsou bílkoviny, má smysl požadovat, aby A až D byly všechny atomy hlavního řetězce. Níže je obrázek molekulární grafiky, který odpovídá výše uvedenému náčrtu a ilustruje definici dihedrálního úhlu hlavního řetězce polypeptidu Phi (φ).
Dihedrální úhly hlavního řetězce polypeptidu: Difedrální úhel Phi (φ), Psi (ψ) a Omega (ω)
Dihedrální úhel je definován čtyřmi atomy. Lze si ho představit pohledem dolů na centrální vazbu (tj. vazbu od atomu 2 k atomu 3). Difedrální úhly podél polypeptidového řetězce jsou tří typů:
Phi (φ) – centrální vazba mezi N(i) a C(alfa, i) . Podívejte se dolů na vazbu N(i)-Cα(i), všimněte si úhlu, který svírá acylový uhlík C(i) vzhledem k C(i-1) – acylovému uhlíku z předchozího zbytku.
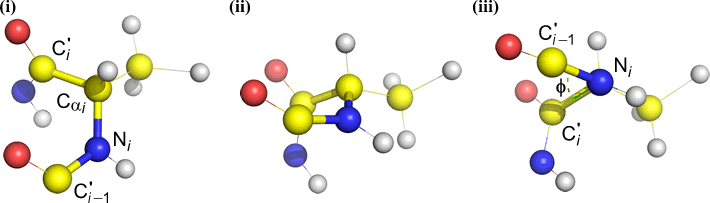
Psi (ψ) – centrální vazba mezi C(alfa, i) a C(i) . Podívejte se dolů na vazbu Cα(i)-C(i), všimněte si úhlu, který svírá N(i + 1) vzhledem k N(i).
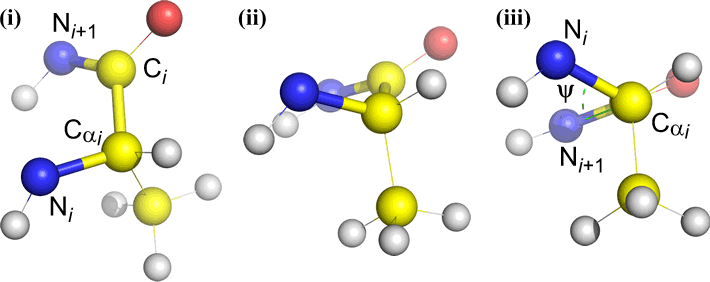
Omega (ω) – peptidová vazba mezi acylovým uhlíkem C(i) a N(i+1) je centrální vazbou.
Phi (φ) a psi (ψ) se někdy označují jako Ramachandranovy úhly, protože se používají ve dvourozměrném grafu dihedrálních úhlů hlavního řetězce zvaném Ramachandranův graf (viz níže).
Ramachandranův graf
Ramachandranův graf je graf dihedrálních úhlů hlavního řetězce phi (φ) a psi (ψ) pro polypeptidový řetězec, s hodnotami phi (φ) na ose x a hodnotami psi (ψ) na ose y.
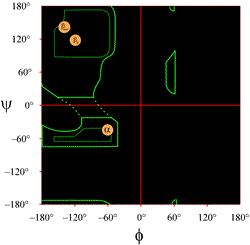
Uspořádání Ramachandranova grafu, jak se obvykle uvádí v učebnicích, je znázorněno vlevo (kliknutím na obrázek zobrazíte jeho větší verzi). Obrysy označují rozsah povolených (světle zelená) a nejvíce preferovaných (tmavě zelená) kombinací (φ, ψ). Oranžové kruhy ukazují umístění ideálních hodnot phi, psi pro nejběžnější pravidelné sekundární strukturní prvky, beta vlákna (v antiparalelních a paralelních listech) a alfa šroubovice. Mimo čtverce jsou příslušné konformace nevýhodné nebo nepřípustné. Přesné umístění kontur by se nemělo brát příliš doslova, protože příznivé a povolené oblasti závisí na identitě reziduí. Zejména glycin má mnohem větší povolené oblasti, než je zde uvedeno. O tom je pojednáno níže.
„Skutečný“ Ramachandranův graf
Ve „finální hře“ určování struktury proteinů je třeba experimentálně stanovený model analyzovat z hlediska jeho stereochemické kvality. Závažné problémy s modelem mohou být indikovány, pokud se vyskytují případy ne-Gly zbytků, jejichž dihedrální úhly hlavního řetězce leží mimo povolené oblasti, nebo pokud je příliš vysoký podíl zbytků mimo nejvíce zvýhodněnou oblast. Příklad Ramachandranova grafu pro protein o 190 zbytcích je uveden na přiloženém obrázku.
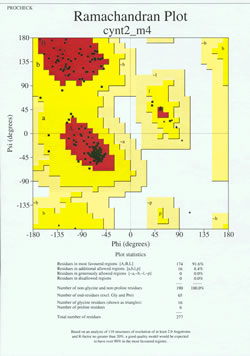
Obrázek ukazuje Ramachandranův graf pro strukturu proteinu určenou pomocí rentgenové krystalografie. (Kliknutím na něj zobrazíte jeho větší verzi v novém okně.) Každý černý čtverec představuje konformaci hlavního řetězce u jednoho zbytku proteinu. Všimněte si, jak se hodnoty phi, psi pro rezidua shlukují v červených „nejvýhodnějších“ oblastech. Červená oblast vlevo nahoře (na obrázku označená „B“) odpovídá zbytkům v konformaci beta vlákna hlavního řetězce, zatímco velká oblast blízko středu (označená „A“) odpovídá alfa šroubovici. Třetí, malá červená oblast na obrázku představuje zbytky, které zaujímají levotočivou („L“) alfa šroubovici. Některá rezidua leží v „dalších povolených oblastech“ (světle žlutá), které hraničí s nejvíce zvýhodněnými oblastmi. Všimněte si, že zbytky glycinu (označené jako trojúhelníky) leží v některých případech v „nepovolených oblastech“. Je to proto, že glycin, který má jako „postranní řetězec“ pouze malý atom vodíku, je mnohem méně stericky zatížen než ostatní aminokyseliny. Gly je schopen zaujmout dvojice úhlů phi, psi, které nejsou povoleny pro žádný jiný zbytek
.