Biokémiai témakörök
Diéderes (vagy torziós) szögek
A kötésszög és a diéderes (torziós) szög definíciói. Polipeptid fő lánc diéderes szögek, φ, ψ és ω. Ramachandran-diagramok.
A biológiai molekulák által felvett konformációk határozzák meg a biológiai rendszerekben mutatott fizikai és kémiai tulajdonságaikat. Ezért szükségünk van egy olyan módszerre, amellyel leírhatjuk a biokémiában vizsgált molekulatípusoknál megfigyelt konformációkat. Ebben a fejezetben elsősorban a polipeptidkonformációkkal foglalkozunk, mint a fehérjékben lévő szerkezet-funkció összefüggések megértésének előkészítésével
A diéderes szöget – más néven torziós szöget – négy egymás után kötött atom határozza meg. Ezt az alábbi ábrán az A-B-C-D szerkezet ábrázolja (második panel; figyeljük meg a kötésszög és a torziós szög közötti különbséget). Képzeljük el, hogy a B és C atomok közötti kötés mentén nézünk végig (ahogy a nyíl jelzi). Ez a központi kötés a három meghatározott kötés közül. Először a B-C kötést látjuk az ábra síkjában, a B-A kötés balra és a síkból felfelé mutat, a C-D kötés pedig lefelé és jobbra. Ezután felvesszük ezt a szerkezetet, és elkezdjük elforgatni, hogy egyenesen a B-C kötést nézzük (harmadik panel). Végül a nézetünk megegyezik az utolsó panelen látható Newman-projekcióval. Ebből a nézetből a τ diéderes szög a D által az A-hoz képest bezárt látszólagos szög, ahogy az ábrán látható. A diéderes szögek értéktartományát úgy határozzuk meg, hogy , és τ értéke körülbelül -150° (A tartomány negatív része megfelel annak, amikor D az A-hoz képest az óramutató járásával ellentétesen áll.)
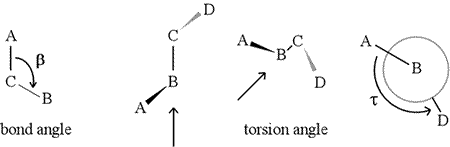
A B-hez és C-hez természetesen más atomok is kapcsolódhatnak – és általában kapcsolódnak is. A diéderes szög egyértelmű meghatározásához meg kellene adnunk, hogy mely atomok felelnek meg A, B, C és D-nek. Hosszú, elágazás nélküli polimerek, például fehérjék esetében van értelme megkövetelni, hogy A-tól D-ig az összes fő láncatom legyen. Az alábbiakban egy molekuláris grafikus kép látható, amely megfelel a fenti vázlatnak, és szemlélteti a polipeptid főlánc diéderes szögének Phi (φ) meghatározását.
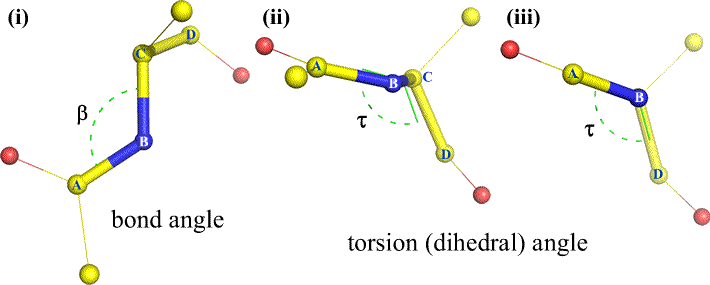
Polipeptid főlánc diéderes szöge:
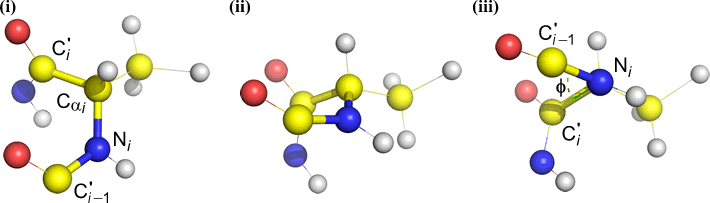
A diéderes szöget négy atom határozza meg. Ezt a központi kötés (azaz a 2. atomtól a 3. atomig tartó kötés) lefelé tekintve lehet szemléltetni. A diéderes szögek egy polipeptidlánc mentén háromfélék lehetnek:
Phi (φ) – központi kötés N(i) és C(alfa, i) között . Nézzünk végig az N(i)-Cα(i) kötésen, figyeljük meg a C(i) acil szén által bezárt szöget a C(i-1) – az előző maradék acil szénjéhez képest.
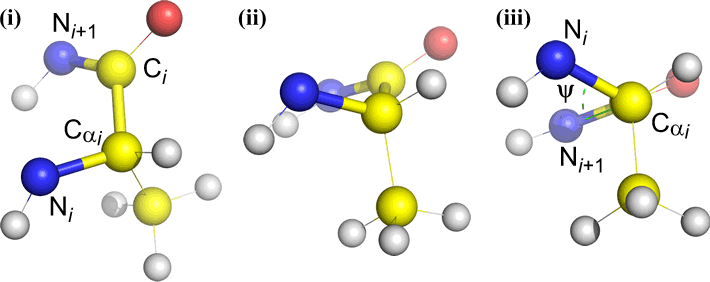
Psi (ψ) – központi kötés C(alfa, i) és C(i) között . Nézzük meg a Cα(i)-C(i) kötést, figyeljük meg az N(i + 1) által az N(i)-hez képest bezárt szöget.
Omega (ω) – a C(i) és N(i+1) acilszén közötti peptidkötés a központi kötés.
Phi (φ) és psi (ψ) néha Ramachandran-szögnek nevezik, mivel a főlánc diéderszögeinek kétdimenziós ábrázolásában, az úgynevezett Ramachandran-diagramban (lásd alább) használják őket.
Ramachandran-diagram
A Ramachandran-diagram egy polipeptidlánc phi (φ) és psi (ψ) főlánc-diéderszögeinek grafikonja, ahol a phi (φ) értékek az x-tengelyen, a psi (ψ) értékek pedig az y-tengelyen helyezkednek el.
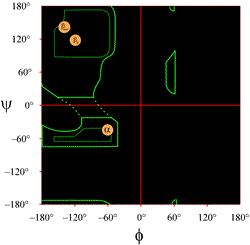
A tankönyvekben jellemzően bemutatott Ramachandran-diagram elrendezése a bal oldalon látható (kattintson az ábrára a nagyobb változat megjelenítéséhez). A kontúrok a megengedett (világoszöld) és a legkedvezőbb (sötétzöld) (φ, ψ) kombinációk kiterjedését jelzik. A narancssárga körök az ideális phi, psi értékek helyét mutatják a leggyakoribb szabályos másodlagos szerkezeti jellemzők, a béta-szálak (antiparallel és párhuzamos lapokban) és az alfa-hélixek esetében. A körökön kívül a megfelelő konformációk kedvezőtlenek vagy tiltottak. A körvonalak pontos helyét nem szabad túlságosan szó szerint venni, mivel a kedvező és megengedett régiók a maradékok azonosságától függnek. A glicin különösen az itt bemutatottnál sokkal nagyobb megengedett régiókkal rendelkezik. Ezt a továbbiakban tárgyaljuk.
Egy “valódi” Ramachandran-diagram
A fehérjeszerkezet-meghatározás “végjátékában” a kísérletileg meghatározott modellt sztereokémiai minősége szempontjából elemezni kell. Komoly problémákat jelezhet a modellel, ha vannak olyan nem-Gly-maradékok, amelyeknek a főlánc diéderes szögei kívül esnek a megengedett tartományokon, vagy ha a maradékok túl nagy aránya van a legkedvezőbb tartományon kívül. A mellékelt ábrán egy 190 maradékból álló fehérjére vonatkozó Ramachandran-diagram példája látható.
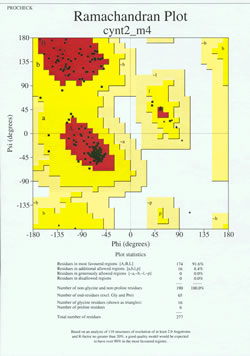
Az ábra egy röntgenkrisztallográfiával meghatározott fehérjeszerkezet Ramachandran-diagramját mutatja. (Az ábrára kattintva egy új ablakban nagyobb méretben jelenik meg.) Minden fekete négyzet a fehérje egy-egy maradékánál a főlánc konformációját jelöli. Figyeljük meg, hogy a maradékok phi, psi értékei hogyan csoportosulnak a piros “legkedvezőbb” régiókba. A bal felső piros régió (az ábrán “B”-vel jelölve) a főlánc béta-szálas konformációjában lévő maradékoknak felel meg, míg a középsőhöz közeli nagy terület (az ábrán “A”-val jelölve) az alfa-hélixnek felel meg. Az ábrán a harmadik, kis piros terület a balkezes (“L”) alfa-hélixet alkalmazó maradékok helye. A maradékok egy része a “további engedélyezett régiókban” (élénksárga) található, amelyek a legkedvezőbb régiókkal határosak. Vegyük észre, hogy a glicin-maradványok (háromszögekkel jelölve) néhány esetben “nem megengedett régiókban” helyezkednek el. Ennek az az oka, hogy a Gly, amelynek csak a kis hidrogénatom az “oldallánca”, sterikusan sokkal kevésbé terhelt, mint más aminosavak. A Gly képes olyan phi, psi szögpárokat felvenni, amelyek egyetlen más maradék esetében sem megengedettek.