Biokemian aiheet
Dihedraali- (tai vääntö-) kulmat
Sidekulman ja dihdraali- (vääntö-) kulman määritelmät. Polypeptidin pääketjun dihedrikulmat φ, ψ ja ω. Ramachandranin kuvaajat.
Biologisten molekyylien omaksumat konformaatiot määräävät niiden fysikaaliset ja kemialliset ominaisuudet biologisissa järjestelmissä. Siksi tarvitsemme tavan kuvata biokemiassa tutkittujen molekyylityyppien havaittuja konformaatioita. Tässä osiossa keskitytään pääasiassa polypeptidikonformaatioihin, jotta voidaan valmistautua ymmärtämään rakenne-toimintasuhteita proteiineissa
Dihedrikulma – jota kutsutaan myös vääntökulmaksi – määritellään neljän peräkkäin sitoutuneen atomin avulla. Tätä edustaa alla olevassa kuvassa rakenne A-B-C-D (toinen paneeli; huomaa ero sidoskulman ja vääntökulman välillä). Kuvittele, että katsot atomien B ja C välistä sidosta pitkin (kuten nuoli osoittaa). Tämä on keskeinen sidos kolmesta määritellystä sidoksesta. Aluksi näemme B-C-sidoksen kuvan tasossa, jolloin B-A-sidos osoittaa vasemmalle ja ylöspäin tasosta ja C-D-sidos osoittaa alaspäin ja oikealle. Sitten otamme tämän rakenteen ja alamme kääntää sitä niin, että voimme katsoa suoraan B-C-sidosta alaspäin (kolmas paneeli). Lopulta näkymämme vastaa viimeisen paneelin Newman-projektiota. Tästä näkymästä katsottuna dihedraalikulma τ on se näennäinen kulma, jonka D muodostaa suhteessa A:han, kuten kuvassa on esitetty. Määrittelemme dihedraalikulmien arvoalueeksi , ja τ:n arvo on noin -150° (Alueen negatiivinen osa vastaa tilannetta, jossa D on vastapäivään A:han nähden.)
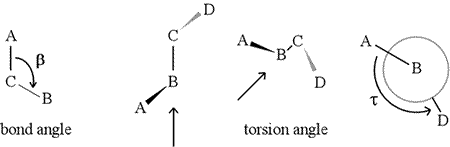
B:hen ja C:hen voi tietysti olla kiinnittyneenä muitakin atomeja – ja yleensä onkin. Meidän olisi määriteltävä, mitkä atomit vastaavat A:ta, B:tä, C:tä ja D:tä, jotta voisimme yksiselitteisesti määritellä dihedraalikulman. Pitkissä haarautumattomissa polymeereissä, kuten proteiineissa, on järkevää vaatia, että A:sta D:hen ovat kaikki pääketjun atomit. Alla on molekyyligrafiikkakuva, joka vastaa yllä olevaa luonnosta ja havainnollistaa polypeptidin pääketjun dihedraalikulman Phi (φ) määritelmää.
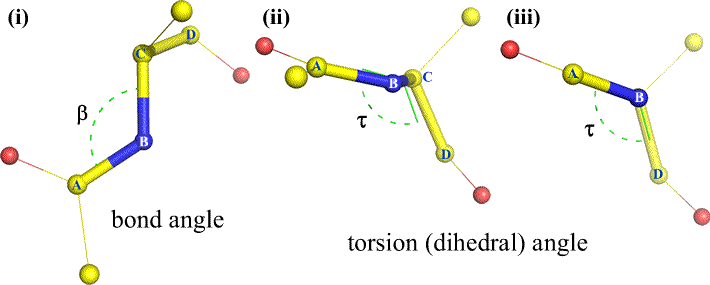
Polypeptidin pääketjun dihedraalikulmat: Phi (φ), Psi (ψ) ja Omega (ω)
Dihedrikulma määritellään neljän atomin avulla. Se voidaan havainnollistaa katsomalla alaspäin keskeistä sidosta (eli sidosta atomista 2 atomiin 3). Polypeptidiketjun varrella olevia dihedrikulmia on kolmea tyyppiä:
Phi (φ) – N(i):n ja C(alfa, i):n välinen keskeinen sidos . Katso N(i)-Cα(i)-sidosta alaspäin ja huomaa kulma, jonka asyylihiili C(i) muodostaa suhteessa C(i-1) – edellisen jäännöksen asyylihiileen.
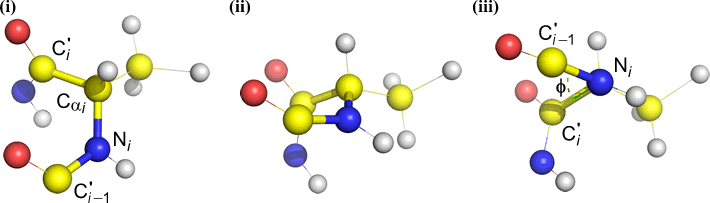
Psi (ψ) – C(alfa, i) ja C(i) välinen keskeinen sidos . Katso Cα(i)-C(i)-sidosta alaspäin, huomaa kulma, jonka N(i + 1) muodostaa N(i):n suhteen.
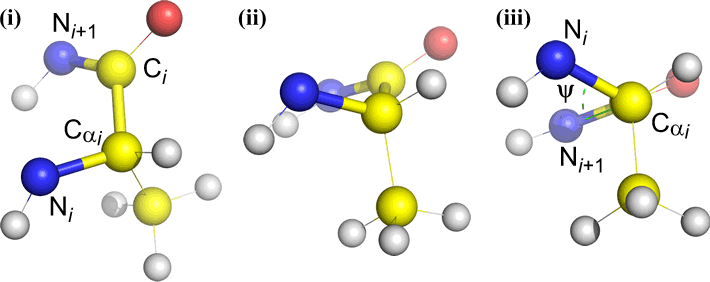
Omega (ω) – peptidisidos asyylihiilen C(i) ja N(i+1) välillä on keskeinen sidos.
Phi (φ) ja psi (ψ) kutsutaan joskus Ramachandranin kulmiksi, koska niitä käytetään pääketjun dihedraalikulmien kaksiulotteisessa kuvaajassa, jota kutsutaan Ramachandranin kuvaajaksi (ks. alla).
Ramachandran-diagrammi
Ramachandran-diagrammi on polypeptidiketjun pääketjun dihedraalikulmien phi (φ) ja psi (ψ) kuvaaja, jossa phi (φ)-arvot ovat x-akselilla ja psi (ψ)-arvot y-akselilla.
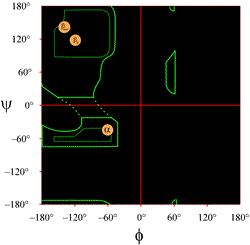
Vasemmalla on esitetty Ramachandranin kaavio, sellaisena kuin se tyypillisesti esitetään oppikirjoissa (klikkaa kuvaa näyttääksesi suuremman version). Yläviivat osoittavat sallittujen (vaaleanvihreä) ja suosituimpien (tummanvihreä) (φ, ψ) yhdistelmien laajuuden. Oranssit ympyrät osoittavat ihanteellisten phi- ja psi-arvojen sijainnit yleisimmille säännöllisille sekundaarirakennepiirteille, beetasäikeille (antiparalleeleina ja rinnakkaisina arkkeina) ja alfaheliksille. Piirien ulkopuolella vastaavat konformaatiot ovat epäsuotuisia tai kiellettyjä. Määrälukujen tarkkoja sijainteja ei pidä ottaa liian kirjaimellisesti, sillä suotuisat ja sallitut alueet riippuvat jäännöksen identiteetistä. Erityisesti glysiinillä on paljon suurempia sallittuja alueita kuin tässä on esitetty. Tätä käsitellään jäljempänä.
”Oikea” Ramachandranin kuvaaja
Proteiinirakenteen määrityksen ”loppupelissä” kokeellisesti määritettyä mallia on analysoitava sen stereokemiallisen laadun kannalta. Malliin voi liittyä vakavia ongelmia, jos siinä on muita kuin gly-jäämiä, joiden pääketjun dihedraalikulmat ovat sallittujen alueiden ulkopuolella, tai jos liian suuri osa jäämistä on suosituimman alueen ulkopuolella. Oheisessa kuvassa on esimerkki Ramachandranin kuvaajasta 190 jäännöksestä koostuvalle proteiinille.
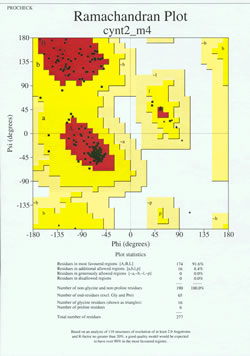
Kuvassa on Ramachandranin kuvaaja röntgenkristallografialla määritetylle proteiinirakenteelle. (Klikkaa sitä nähdäksesi suuremman version uudessa ikkunassa.) Jokainen musta neliö edustaa pääketjun konformaatiota proteiinin yhden jäännöksen kohdalla. Huomaa, kuinka jäännösten phi-, psi-arvot ryhmittyvät punaisille ”suosituimmille” alueille. Vasemmalla ylhäällä oleva punainen alue (kuvassa merkintä ”B”) vastaa pääketjun beetasäikeen konformaatiossa olevia jäännöksiä, kun taas suuri alue lähellä keskikohtaa (merkintä ”A”) vastaa alfaheliksiä. Kuvion kolmannella, pienellä punaisella alueella sijaitsevat vasemmanpuoleisen (”L”) alfakierteen omaksuneet jäännökset. Osa jäännöksistä sijaitsee ”sallituilla lisäalueilla” (kirkkaan keltainen), jotka rajaavat suosituimpia alueita. Huomaa, että glysiinijäämät (merkitty kolmioina) sijaitsevat joissakin tapauksissa ”kielletyillä alueilla”. Tämä johtuu siitä, että gly, jonka ”sivuketjuna” on vain pieni vetyatomi, on sterisesti paljon vähemmän kuormitettu kuin muut aminohapot. Gly pystyy omaksumaan phi-, psi-kulmapareja, jotka eivät ole sallittuja millekään muulle jäämälle.