BIOKEMISK TEMATIK
Didedralvinkler (eller torsionsvinkler)
Definitioner af bindingsvinkel og diddralvinkel (torsionsvinkel). Polypeptidhovedkædens dihedralvinkler, φ, ψ og ω. Ramachandran-plot.
De konformationer, som biologiske molekyler antager, bestemmer de fysiske og kemiske egenskaber, som de udviser i biologiske systemer. Derfor har vi brug for en måde at beskrive de konformationer, der observeres for de typer molekyler, der studeres i biokemien. Hovedfokus i dette afsnit vil være på polypeptidkonformiteter som en forberedelse til at forstå struktur-funktionsrelationer i proteiner
En dihedralvinkel – også kaldet torsionsvinkel – er defineret af fire sekventielt forbundne atomer. Dette er repræsenteret i nedenstående figur ved strukturen A-B-C-D (andet panel; bemærk forskellen mellem bindingsvinkel og torsionsvinkel). Forestil dig, at du ser langs bindingen mellem atomerne B og C (som angivet med pilen). Dette er den centrale binding af de tre definerede bindinger. I første omgang ser vi B-C-bindingen i figurens plan, med B-A-bindingen pegende til venstre og opad ud af planen, og C-D-bindingen pegende nedad og til højre. Derefter tager vi denne struktur op og begynder at dreje den, så vi kan se lige nedad på B-C-bindingen (tredje panel). Til sidst svarer vores syn til Newman-projektionen i det sidste panel. Fra dette synspunkt er dihedralvinklen τ den tilsyneladende vinkel, som D udgør i forhold til A, som vist. Vi definerer intervallet af værdier af dihedralvinkler til at være , og værdien af τ er ca. -150° (Den negative del af intervallet svarer til, når D er mod uret i forhold til A.)
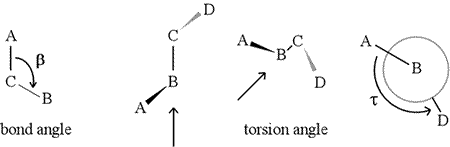
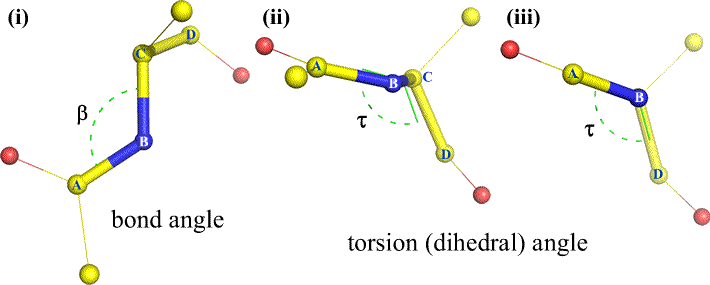
Der kan naturligvis være andre atomer knyttet til B og C – og det er de som regel. Vi ville være nødt til at specificere, hvilke atomer der svarer til A, B, C og D for at kunne definere dihedralvinklen entydigt. For lange uforgrenede polymerer, som f.eks. proteiner, giver det mening at kræve, at A til D er alle hovedkædeatomer. Nedenfor er et molekylærgrafisk billede, der svarer til ovenstående skitse og illustrerer definitionen af polypeptidhovedkædens dihedralvinkel Phi (φ).
Polypeptidhovedkædens dihedralvinkler: Phi (φ), Psi (ψ) og Omega (ω)
En dihedralvinkel er defineret af fire atomer. Den kan visualiseres ved at se nedad på den centrale binding (dvs. bindingen fra atom 2 til atom 3). De diedriske vinkler langs en polypeptidkæde er af tre typer:
Phi (φ) – centralbinding mellem N(i) og C(alpha, i) . Kig ned langs N(i)-Cα(i)-bindingen, bemærk den vinkel, som acylkulstoffet C(i) danner i forhold til C(i-1) – acylkulstoffet fra den foregående rest.
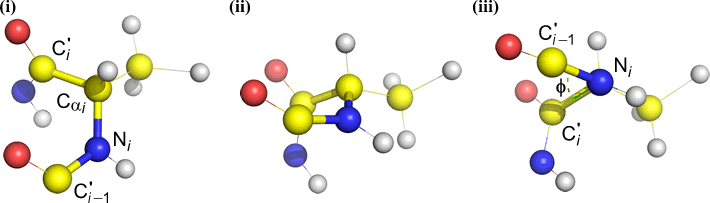
Psi (ψ) – centralbinding mellem C(alpha, i) og C(i) . Se nedad på Cα(i)-C(i)-bindingen, bemærk den vinkel, som N(i + 1) indtager i forhold til N(i).
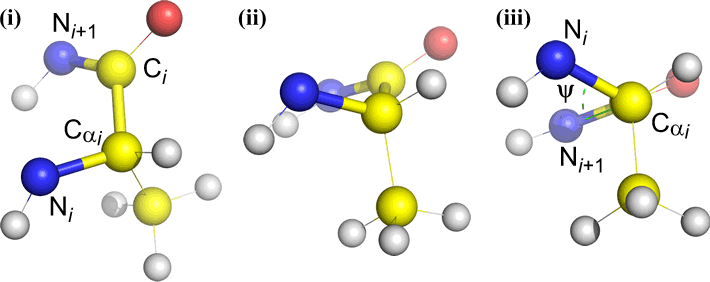
Omega (ω) – peptidbindingen mellem acylkulstoffet C(i) og N(i+1) er den centrale binding.
Phi (φ) og psi (ψ) kaldes undertiden Ramachandran-vinkler, da de anvendes i et todimensionelt plot af hovedkædens dihedralvinkler kaldet et Ramachandran-plot (se nedenfor).
Ramachandran-plot
Ramachandran-plottet er en graf over hovedkædens dihedralvinkler phi (φ) og psi (ψ) for en polypeptidkæde, med phi (φ)-værdier langs x-aksen og psi (ψ)-værdier langs y-aksen.
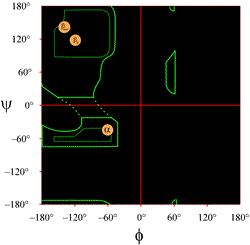
Layoutet af et Ramachandran-plot, som det typisk præsenteres i lærebøger, er vist til venstre (klik på figuren for at få vist en større version). Konturerne angiver omfanget af tilladte (lysegrønne) og mest begunstigede (mørkegrønne) kombinationer af (φ, ψ). De orange cirkler viser placeringen af de ideelle phi- og psi-værdier for de mest almindelige regelmæssige sekundære strukturelle træk, betastrenge (i antiparallelle og parallelle ark) og alfa-helixer. Uden for disse cirkler er de tilsvarende konformationer ugunstige eller ikke tilladte. De nøjagtige placeringer af tællelinjerne bør ikke tages for bogstaveligt, da de gunstige og tilladte regioner afhænger af residuernes identitet. Især glycin har meget større tilladte regioner end vist her. Dette diskuteres yderligere nedenfor.
Et “rigtigt” Ramachandran-plot
I “slutspillet” af proteinstrukturbestemmelse skal den eksperimentelt bestemte model analyseres med hensyn til dens stereokemiske kvalitet. Der kan være alvorlige problemer med modellen, hvis der er tilfælde af ikke-Gly-rester, hvis hovedkædens dihedralvinkler ligger uden for de tilladte regioner, eller hvis en for stor andel af resterne ligger uden for den mest begunstigede region. Et eksempel på et Ramachandran-plot for et protein med 190 rester er vist i den medfølgende figur.
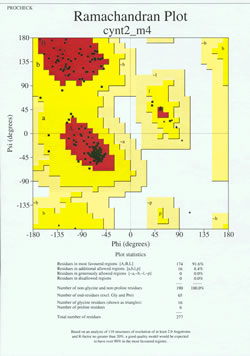
Figuren viser et Ramachandran-plot for en proteinstruktur bestemt ved hjælp af røntgenkrystallografi. (Klik på den for at se en større version i et nyt vindue.) Hver sort firkant repræsenterer konformationen af hovedkæden ved en rest i proteinet. Bemærk, hvordan phi- og psi-værdierne for resterne klynger sig i de røde “mest begunstigede” regioner. Den røde region øverst til venstre (mærket “B” i figuren) svarer til rester i en betastrengskonformation af hovedkæden, mens det store område nær midten (mærket “A”) svarer til alfahelix. Det tredje, lille røde område i plottet er det område, hvor rester, der antager en venstrehåndet (“L”) alfa-helix, er placeret. Nogle af resterne ligger i “yderligere tilladte områder” (lysegult), der grænser op til de mest begunstigede områder. Bemærk, hvordan glycinresterne (angivet som trekanter) i nogle tilfælde ligger i “ikke-godkendte regioner”. Det skyldes, at Gly, der kun har et lille hydrogenatom som “sidekæde”, er meget mindre sterisk belastet end andre aminosyrer. Gly er i stand til at antage par af phi, psi-vinkler, som ikke er tilladt for nogen anden rest.