Temas de bioquímica
Ángulos diedros (o de torsión)
Definiciones de ángulo de enlace y ángulo diédrico (de torsión). Ángulos diédricos de la cadena principal del polipéptido, φ, ψ, y ω. Gráficos de Ramachandran.
Las conformaciones que adoptan las moléculas biológicas determinan las propiedades físicas y químicas que presentan en los sistemas biológicos. Por lo tanto, necesitamos una manera de describir las conformaciones observadas para los tipos de moléculas estudiadas en bioquímica. En esta sección nos centraremos principalmente en las conformaciones de los polipéptidos, como preparación para entender las relaciones estructura-función en las proteínas
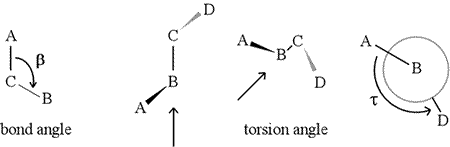
Un ángulo diedro -también llamado ángulo de torsión- está definido por cuatro átomos enlazados secuencialmente. Esto está representado en la figura siguiente por la estructura A-B-C-D (segundo panel; nótese la distinción entre ángulo de enlace y ángulo de torsión). Imagina que miras a lo largo del enlace entre los átomos B y C (como indica la flecha). Este es el enlace central de los tres enlaces definidos. Al principio, vemos el enlace B-C en el plano de la figura, con el enlace B-A apuntando hacia la izquierda y hacia arriba fuera del plano, y el enlace C-D apuntando hacia abajo y hacia la derecha. A continuación, cogemos esta estructura y empezamos a girarla para poder ver directamente el enlace B-C (tercer panel). Finalmente, nuestra vista es equivalente a la proyección de Newman en el último panel. Desde este punto de vista, el ángulo diedro τ es el ángulo aparente subtendido por D con respecto a A, como se muestra. Definimos el rango de valores de los ángulos diedros como , y el valor de τ es de aproximadamente -150° (La parte negativa del rango corresponde a cuando D está en sentido contrario a las agujas del reloj con respecto a A.)
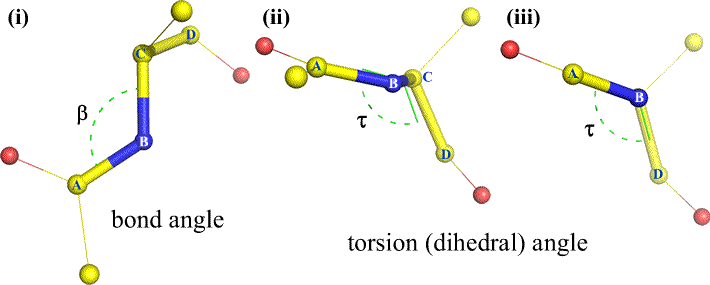
Por supuesto, otros átomos pueden estar unidos a B y C – y normalmente lo están. Tendríamos que especificar qué átomos corresponden a A, B, C y D para definir inequívocamente el ángulo diedro. En el caso de polímeros largos no ramificados, como las proteínas, tiene sentido exigir que de A a D sean todos los átomos de la cadena principal. A continuación se muestra una imagen gráfica molecular que corresponde al esquema anterior e ilustra la definición del ángulo diedro de la cadena principal del polipéptido Phi (φ).
Ángulos diedros de la cadena principal del polipéptido: Phi (φ), Psi (ψ) y Omega (ω)
Un ángulo diedro está definido por cuatro átomos. Se puede visualizar mirando hacia abajo el enlace central (es decir, el enlace del átomo 2 al átomo 3). Los ángulos diedros a lo largo de una cadena polipeptídica son de tres tipos:
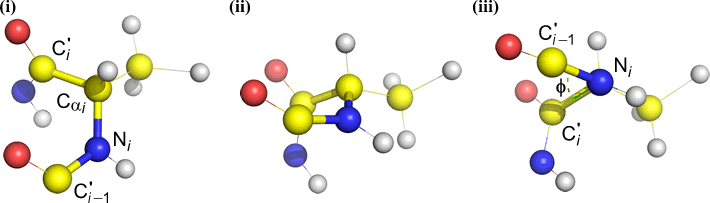
Phi (φ) – enlace central entre N(i) y C(alpha, i) . Mire hacia abajo el enlace N(i)-Cα(i), observe el ángulo subtendido por el carbono acilo C(i) con respecto a C(i-1) – el carbono acilo del residuo anterior.
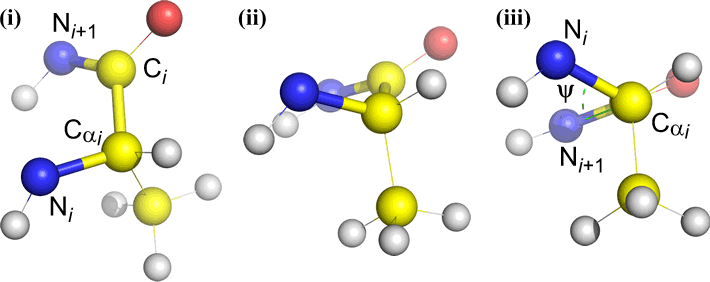
Psi (ψ) – enlace central entre C(alfa, i) y C(i) . Mire hacia abajo el enlace Cα(i)-C(i), observe el ángulo subtendido por N(i + 1) en relación con N(i).
Omega (ω) – el enlace peptídico entre el carbono acilo C(i) y N(i+1) es el enlace central.
Phi (φ) y psi (ψ) se denominan a veces ángulos de Ramachandran, ya que se utilizan en un gráfico bidimensional de los ángulos diedros de la cadena principal llamado gráfico de Ramachandran (véase más adelante).
Parcela de Ramachandran
La parcela de Ramachandran es un gráfico de los ángulos diedros de la cadena principal phi (φ) y psi (ψ) para una cadena polipeptídica, con los valores phi (φ) a lo largo del eje x y los valores psi (ψ) a lo largo del eje y.
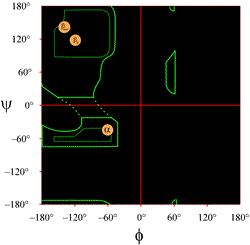
A la izquierda se muestra el trazado de un diagrama de Ramachandran tal y como se presenta habitualmente en los libros de texto (haga clic en la figura para ver una versión ampliada). Los contornos indican la extensión de las combinaciones permitidas (verde claro) y más favorecidas (verde oscuro) de (φ, ψ). Los círculos naranjas muestran las ubicaciones de los valores ideales de phi, psi para las características estructurales secundarias regulares más comunes, las hebras beta (en hojas antiparalelas y paralelas) y las hélices alfa. Fuera de los contornos, las conformaciones correspondientes están desfavorecidas o no permitidas. Las ubicaciones exactas de los contornos no deben tomarse al pie de la letra, ya que las regiones favorables y permitidas dependen de la identidad del residuo. La glicina, en particular, tiene regiones permitidas mucho mayores que las que se muestran aquí. Esto se discute más adelante.
Un diagrama de Ramachandran «real»
En el «juego final» de la determinación de la estructura de la proteína, el modelo determinado experimentalmente debe ser analizado por su calidad estereoquímica. Se pueden indicar problemas graves con el modelo si hay casos de residuos no Gly cuyos ángulos diedros de la cadena principal se encuentran fuera de las regiones permitidas, o si una proporción demasiado alta de los residuos está fuera de la región más favorecida. En la figura adjunta se muestra un ejemplo de diagrama de Ramachandran para una proteína de 190 residuos.
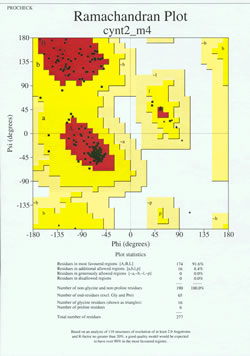
La figura muestra un diagrama de Ramachandran para una estructura proteica determinada por cristalografía de rayos X. (Haga clic en ella para ver una versión más grande en una nueva ventana.) Cada cuadrado negro representa la conformación de la cadena principal en un residuo de la proteína. Obsérvese cómo los valores phi, psi de los residuos se agrupan en las regiones rojas «más favorecidas». La región roja de la parte superior izquierda (etiquetada como «B» en la figura) corresponde a los residuos en una conformación de cadena principal beta, mientras que la zona grande cerca del centro (etiquetada como «A») corresponde a la hélice alfa. La tercera y pequeña zona roja del gráfico es donde se encuentran los residuos que adoptan una hélice alfa zurda («L»). Algunos de los residuos se encuentran en «regiones adicionales permitidas» (amarillo brillante) que bordean las regiones más favorecidas. Nótese que los residuos de glicina (indicados como triángulos) se encuentran en algunos casos en «regiones no permitidas». Esto se debe a que la Gly, con sólo el pequeño átomo de hidrógeno como «cadena lateral», está mucho menos estéricamente cargada que otros aminoácidos. Gly es capaz de adoptar pares de ángulos phi, psi que no están permitidos para ningún otro residuo.