BIOCHEMISTRY TOPICS
二面角(またはねじれ角)
結合角と二面角(ねじれ角)の定義です。 ポリペプチド主鎖の二面角、φ、ψ、ω。 ラマチャンドランプロット
生体分子がとるコンフォメーションは、生体系で示す物理的、化学的特性を決定する。 したがって、生化学で研究される種類の分子について観察されるコンフォメーションを記述する方法が必要である。 ここでは、タンパク質の構造-機能相関を理解するための準備として、ポリペプチドのコンフォメーションに主に焦点を当てます
二面角(ねじれ角ともいう)は、4つの連続的に結合した原子で定義されます。 下図ではA-B-C-Dという構造で表現されています(2枚目、結合角とねじれ角の違いに注意してください)。 B原子とC原子の結合(矢印で示す)を見てみましょう。 この結合が、定義された3つの結合のうち、中心的な結合である。 最初は、図の平面上にB-C結合が見え、B-A結合は平面から見て左上、C-D結合は右下を向いているように見えます。 次に、この構造を手に取り、B-C結合を真下に見るように回転させ始めます(3枚目)。 最終的には、最後のパネルにあるNewmanの投影図と同じようになります。 この図から、二面角τは、Aに対してDが引いた見かけ上の角度になります。 二面角の値の範囲を , と定義すると、τの値は約-150°です(範囲の負の部分は、DがAに対して反時計回りのときに対応します)
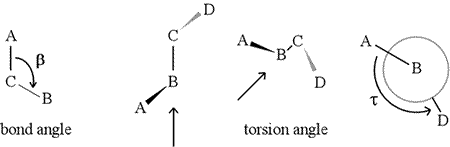
もちろん、BとCには他の原子がついていてもよいし、通常はついています。 二面角を明確に定義するためには、A、B、C、Dに対応する原子を特定する必要がある。 タンパク質のような分岐のない長いポリマーでは、AからDがすべて主鎖の原子であることを要求するのが理にかなっている。 以下は、上記のスケッチに対応する分子グラフィックス画像で、ポリペプチド主鎖二面角Phi (φ) の定義を説明する。
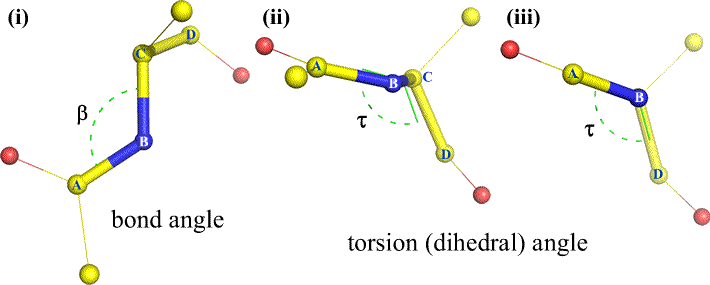
Polypeptide main chain dihedral angles: Phi (φ), Psi (ψ), and Omega (ω)
二面角は4つの原子で定義されます。 これは中心結合(すなわち原子2から原子3への結合)を見下ろすことによって視覚化することができる。 ポリペプチド鎖に沿った二面角は3種類あります。
Phi (φ) – N(i) と C(alpha, i) の間の中心結合。 N(i)-Cα(i)結合を見下ろし、前の残基からのアシル炭素C(i-1)に対してアシル炭素C(i)が引く角度に注意してください。
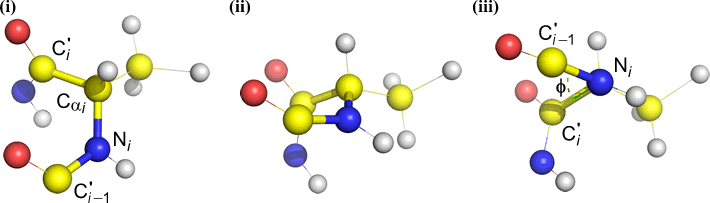
Psi (ψ) – C(alpha, i) と C(i) の間の中心結合。 Cα(i)-C(i) 結合を見下ろして、N(i) に対して N(i + 1) が引く角度に注意してください。
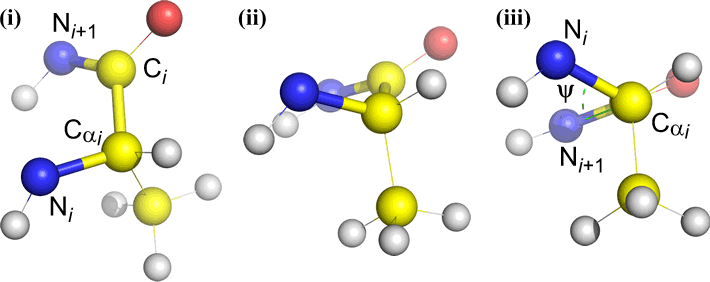
Omega (ω) – アシル炭素 C(i) と N(i+1) 間のペプチド結合は、中心結合であります。
Phi(φ)とpsi(ψ)は、ラマチャンドランプロットという主鎖二面角の二次元プロット(後述)で使われるので、ラマチャンドラン角と呼ばれることもあります。
Ramachandran plot
Ramachandran plotはポリペプチド鎖の主鎖二面角phi (φ) and psi (ψ) のグラフで、x軸にphi (φ) 値、y軸に psi (ψ) 値をとったもので、主鎖二面角はφ(ψ)、ψ(ψ)はy軸になります。
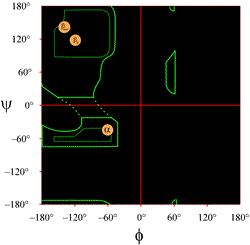
教科書によく出てくるラマチャンドランプロットのレイアウトを左に示す(図をクリックすると拡大表示されます)。 等高線は(φ, ψ)の組み合わせが許される範囲(薄緑)と最も好まれる範囲(濃緑)を示している。 オレンジ色の円は、最も一般的な規則的二次構造の特徴であるβストランド(反平行シートと平行シート)とαヘリックスに対する理想的なphi, psi値の位置を示している。 この円の外では、対応するコンフォーメーションは好ましくない、あるいは許されない。 有利な領域と許容される領域は残基の同一性に依存するので、countoursの正確な位置はあまり文字通りには受け取らない方がよい。 特にグリシンはここで示したよりもはるかに大きな許容領域を持っている。 これについては後述する。
「本当の」ラマチャンドランプロット
タンパク質構造決定の「最終段階」では、実験的に決定されたモデルを立体化学的に分析する必要があります。 主鎖の二面角が許容範囲外にある非Gly残基が存在する場合、あるいは残基の割合が多すぎて最有利領域外にある場合、モデルに重大な問題があることが示唆される。 190残基のタンパク質のラマチャンドランプロットの例を添付の図に示す。
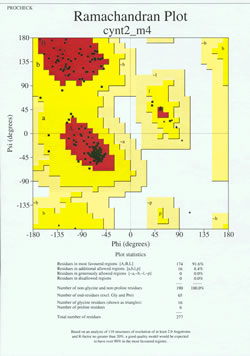
図はX線結晶構造解析によって決定されたタンパク質構造に対するラマチャンドランプロットである。 (各黒四角はタンパク質の1残基における主鎖のコンフォメーションを表しています。 残基のphi, psi値が赤い「最も好ましい」領域にどのように集まっているかを見てください。 左上の赤い領域(図では “B “とラベルされている)は主鎖のβストランド構造の残基に対応し、中央付近の大きな領域(”A “とラベルされている)はαヘリックスに対応する。 3番目の小さな赤い領域は、左巻き(”L”)αヘリックスを採用する残基が配置された場所である。 いくつかの残基は、最も好ましい領域と境界をなす「追加許可領域」(明るい黄色)にある。 グリシン残基(三角形で示す)が、場合によっては「不許可領域」にあることに注意してほしい。 これは、グリシンは小さな水素原子を「側鎖」として持っているため、他のアミノ酸に比べて立体障害に乏しいからである。 Glyは他のどの残基にも許されないφ、psi角のペアを採用することができる
。