Mark B. Abelson, MD, CM FRCSC, Daniel Dewey-Mattia y Aron Shapiro, North Andover, Mass.
La queratitis por Acanthamoeba es una enfermedad rara que pone en peligro la vista y que, en Estados Unidos y Europa, se da predominantemente entre los usuarios de lentes de contacto.1,2 La enfermedad está causada por la infección del protozoo Acanthamoeba y suele confundirse con una de las formas más comunes de queratitis fúngica o vírica, especialmente el herpes ocular.3 El traumatismo corneal accidental, más frecuente en los países en desarrollo, y el uso de lentes de contacto son los principales factores de riesgo de la QA. Los métodos de tratamiento tienen más éxito en las fases tempranas, por lo que un diagnóstico rápido es crucial para detener la progresión de la enfermedad. Los pacientes que se encuentran en las últimas fases se enfrentan a menudo a un trasplante de córnea como único medio para recuperar una agudeza visual superior a los simples movimientos de la mano;4 por lo tanto, la QA debería ser una preocupación importante entre los usuarios de lentes de contacto y las personas que han sufrido recientemente abrasiones corneales quirúrgicas o accidentales. La prevención es la mejor arma contra la QA, ya que la mayoría de los casos pueden atribuirse directamente a una mala higiene de las lentes de contacto o al contacto directo de los ojos con agua contaminada.
Ecología de la Acanthamoeba
La Acanthamoeba es uno de los protozoos más abundantes del planeta. Los miembros del género Acanthamoeba son casi omnipresentes y se han aislado del suelo, el polvo, el aire, el agua del grifo tratada y no tratada, las piscinas, los aparatos de aire acondicionado y otros numerosos entornos domésticos y exteriores.5 El ciclo vital de los protozoos consiste en una fase de trofozoíto de alimentación activa y una fase de quiste latente, que se activa por condiciones desfavorables, como la exposición a temperaturas extremas, pH alto o bajo, sequedad o inanición.5 La resistencia a las condiciones adversas (los quistes pueden permanecer viables durante 24 años o más)6 permite a Acanthamoeba un amplio rango ecológico y también la convierte en un parásito formidable en los seres humanos.
Dado que la Acanthamoeba está tan presente en nuestro entorno, es sorprendente que las infecciones sean tan poco frecuentes. Se desconoce cómo nuestro sistema inmunitario nos protege de la infección, aunque se han descubierto anticuerpos específicos contra la Acanthamoeba en los seres humanos.3 Se han encontrado indicios de Acanthamoeba en el tejido pulmonar y nasal de individuos tanto enfermos como sanos7 y, como patógeno oportunista, se sabe que la Acanthamoeba causa una encefalitis mortal en pacientes inmunodeprimidos.5 Sin embargo, en la QA, la infección suele producirse en individuos inmunocompetentes, aunque algunas investigaciones sugieren que algunos pacientes con QA pueden ser susceptibles al patógeno debido a la falta de anticuerpos específicos contra el antígeno.3
Queratitis amebiana
Se calcula que en 2006 se produjeron unos 5.000 casos de queratitis por Acanthamoeba en los Estados Unidos, pero como la QA suele diagnosticarse erróneamente y no es necesario notificar la enfermedad a los Centros para el Control y la Prevención de Enfermedades, el número real podría ser mucho mayor.3 Los países en desarrollo de Asia y África, donde la QA no suele estar asociada al uso de lentes, presentan una tasa excepcionalmente alta de queratitis infecciosa. Un estudio de pacientes que no usan lentes de contacto en la India informó de un resultado visual final muy pobre en comparación con investigaciones anteriores entre usuarios de lentes en países occidentales.8 Esto puede deberse a la variación entre las cepas de Acanthamoeba geográficamente distintas o simplemente al menor nivel socioeconómico y a la falta de recursos médicos disponibles para los participantes en el estudio.8
La QA se documentó por primera vez en Estados Unidos en 1973, después de que un agricultor se rascara la córnea con alambre y heno, y luego lavara la herida con agua de riego.5 La información diagnóstica y clínica relativa a la enfermedad siguió siendo escasa hasta la década de 1980; sin embargo, empezaron a surgir investigaciones que implicaban el uso de lentes de contacto como factor de riesgo predominante. De los 208 casos de QA notificados en los Estados Unidos entre 1973 y 1988, el 85% eran usuarios de lentes de contacto.9 Los primeros casos documentados de QA relacionada con las lentes se encontraron exclusivamente entre personas que guardaban sus lentes de contacto en soluciones salinas caseras hechas con sal de mesa.9 Desde entonces, la infección se ha detectado entre usuarios de lentes que utilizan soluciones multiuso y desinfectantes comprados en tiendas, la mayoría de los cuales matan eficazmente los trofozoitos de Acanthamoeba, pero no los quistes.10
A partir de mediados de la década de 1990, los Estados Unidos han experimentado un aumento del número de casos de QA relacionada con las lentes, especialmente en determinadas poblaciones. Entre julio de 1993 y diciembre de 1994, un brote dio lugar a 43 casos presentados en los Hospitales y Clínicas de la Universidad de Iowa.11 Se cree que la epidemia está asociada a las inundaciones regionales y a la subsiguiente contaminación del suministro de agua, ya que 29 de los 30 pacientes de un estudio vivían en condados afectados por las inundaciones.2 De forma similar, en la zona de Chicago se ha producido un aumento significativo de los casos de QA desde junio de 2003, con 63 casos notificados a finales de 200611 entre una población de la que sólo se esperarían unos dos casos al año.12 El número de pacientes con queratocono también ha aumentado en Portland,13 San Francisco,14 Boston4 y Filadelfia.4 La investigación epidemiológica descubrió que alrededor de la mitad de los pacientes con queratocono de la zona de Chicago habían utilizado la solución «sin frotar» Complete Moisture Plus Multi-Purpose (Advanced Medical Optics) para limpiar y guardar sus lentes de contacto.15 Este hallazgo dio lugar a una investigación de la Administración de Alimentos y Medicamentos de EE.UU. y a una retirada voluntaria del mercado por parte de AMO. Las investigaciones sobre las soluciones comerciales para contactos «sin frotar» han demostrado que estos productos tienen una eficacia mínima para eliminar la Acanthamoeba.16 Tanto las soluciones de peróxido de hidrógeno de un paso como las de dos pasos, que implican una segunda solución neutralizadora, han demostrado ser una alternativa más segura a la solución de almacenamiento «sin frotar».10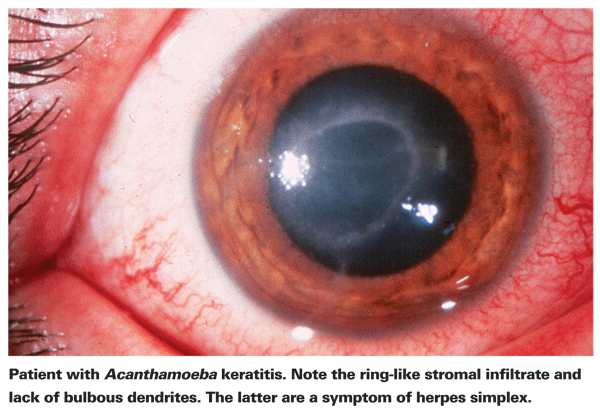
Los estudios han empezado a demostrar que el almacenamiento y el tratamiento del agua de la comunidad también pueden desempeñar un papel importante en los brotes de QA. En Inglaterra, donde la incidencia de la QA es 15 veces superior a la de los Estados Unidos, los depósitos de agua de los tejados, que se vacían con poca frecuencia, pueden ser un medio excelente para el crecimiento de la Acanthamoeba y pueden explicar las elevadas tasas de QA del país.17 La investigación realizada tras el brote del área de Chicago descubrió que no sólo el aumento de la QA se correspondía con la reducción de la cloración del agua de la ciudad a raíz de un mandato de la Agencia de Protección del Medio Ambiente en relación con los subproductos cancerígenos, sino que las distancias excepcionalmente largas del viaje del agua municipal en la zona pueden haber dado tiempo a una decloración adicional y a la colonización de la Acanthamoeba.12 Aunque muchos procedimientos de tratamiento del agua no son eficaces para destruir los quistes, los desinfectantes como el cloro sí destruyen eficazmente los trofozoítos libres e inhiben el crecimiento y la reproducción de los protozoos.12
El uso de lentes de contacto y el desgarro corneal
Los traumatismos corneales, la cirugía ocular y el uso de lentes de contacto son factores de riesgo para el desarrollo de queratitis infecciosa.17 Cuando la capa epitelial de la córnea se daña, queda susceptible de ser infectada por hongos, bacterias o protozoos.18 Antes del uso generalizado de las lentes de contacto, las abrasiones corneales y la exposición a agua o tierra contaminada eran los factores de riesgo más destacados para la QA.
Las lentes de contacto pueden ayudar a que la Acanthamoeba llegue a la córnea y agrave la progresión de la enfermedad. Las lentes sirven como vía física de paso desde una fuente contaminada (es decir, el estuche de las lentes o el agua del grifo) directamente a la córnea. Las lentes, especialmente cuando se usan de forma inadecuada o durante más tiempo del recomendado, erosionan el epitelio corneal, permitiendo la entrada de los microbios.19
El uso de las lentes también se asocia con el aumento de las proteínas receptoras mannosiladas en la superficie epitelial que aumentan la capacidad de Acanthamoeba para corroer el tejido corneal.19 Las biopelículas y los depósitos de proteínas mannosiladas que se acumulan en la superficie de la lente hacen que los trofozoítos produzcan mayores cantidades de mediadores de apoptosis epitelial y proteasas que degradan la matriz del estroma corneal.19
La susceptibilidad a la infección por Acanthamoeba también depende del tipo de lente de contacto que utilice un individuo. Las lentes de contacto nocturnas exponen a los usuarios a un riesgo drásticamente mayor de desarrollar una QA, ya que una revisión descubrió una prevalencia del 30 por ciento de la enfermedad entre los usuarios.20 Mientras que las lentes diarias desechables son el tipo de lente con menos probabilidades de provocar una infección,21 los individuos que usan lentes rígidas son menos propensos a la QA que los usuarios de lentes blandas.22 Aproximadamente el 88 por ciento de los casos de QA relacionados con las lentes de contacto se producen en usuarios de lentes blandas y el 12 por ciento en usuarios de lentes rígidas.23 Las cada vez más populares lentes de hidrogel de silicona de uso continuo también son un objetivo más fácil para la adhesión de Acanthamoeba que los hidrogeles convencionales.21
Signos y síntomas clínicos
Los afectados por la QA suelen quejarse de enrojecimiento, dolor, disminución de la agudeza visual y sensibilidad a la luz.5 La característica clínica más distintiva de la QA es un pronunciado infiltrado estromal en forma de anillo, que se cree que está compuesto por células inflamatorias.5 Los signos de escleritis, inflamación corneal e hiperemia conjuntival comienzan a aparecer a medida que la enfermedad progresa.5 Si no se trata, la Acanthamoeba puede extenderse a la retina y causar una coriorretinitis grave,5 y los pacientes suelen quedar reducidos a una agudeza visual de movimiento de la mano o a la ceguera en estas últimas fases. El diagnóstico tardío, un infiltrado anular pronunciado y una infección estromal profunda se asocian a un peor resultado visual final.24 Los pacientes que desarrollan queratitis estromal también tienen más probabilidades de tener un mal resultado visual después del tratamiento que aquellos con una infección epitelial más superficial.4
Diagnóstico
Un diagnóstico adecuado en la fase inicial es esencial antes de que la Acanthamoeba invada más profundamente la córnea y cause daños permanentes en el tejido. Desgraciadamente, en la visita inicial la enfermedad se diagnostica con más frecuencia como queratitis por herpes simple que como QA. Esta identificación errónea puede conducir al uso de medicamentos antivirales, que sólo empeoran los síntomas del paciente. Durante el diagnóstico, a menudo se considera la Acanthamoeba como causa de la infección cuando las úlceras corneales no responden a los antibióticos. Este retraso en el diagnóstico adecuado permite que el parásito tenga tiempo suficiente para progresar en el ojo.
El primer paso hacia el diagnóstico adecuado es un examen preciso con lámpara de hendidura. La lámpara de hendidura puede mostrar evidencia de Acanthamoeba, ya sea por su presencia directa o por la respuesta inmune asociada.24 La falta de dendritas bulbosas típicas en pacientes con herpes es un buen indicador de que un paciente podría tener QA. El examen temprano y preciso con lámpara de hendidura es importante en los pacientes con úlcera corneal, ya que el estadio de la enfermedad en el momento del diagnóstico de la QA es un fuerte predictor del resultado visual final.24
Cuando se dispone de él, el diagnóstico directo in vivo puede realizarse utilizando un microscopio confocal de barrido en tándem avanzado y un tomógrafo de retina Heidelberg II (HRT-II) con módulo de córnea.7 La reacción en cadena de la polimerasa también puede utilizarse como herramienta de diagnóstico cuando se dispone de muy pocas células para una determinación visual precisa.5 Si el examen in vivo y la reacción en cadena de la polimerasa no son factibles, el cultivo de raspados corneales puede ser una herramienta inestimable para el diagnóstico de la Acanthamoeba y para diferenciarla del herpes ocular.
Se debe utilizar el raspado corneal con una preparación de hidróxido de potasio para el montaje en húmedo si es posible el examen microscópico.25 Se deben realizar raspados adicionales utilizando equipo estéril hasta que haya suficiente material para las placas de cultivo. Las muestras deben incubarse a aproximadamente 37 C en una placa de agar sin nutrientes recubierta de Escherichia coli.24 En pocos días, un cultivo positivo estará cubierto de Acanthamoeba alimentándose de la superposición bacteriana.3
Tratamiento
La Acanthamoeba es difícil de tratar, pero un manejo eficaz puede evitar que el paciente se quede ciego en (al menos) un ojo. Los antiinfecciosos tópicos normalmente sólo funcionan en los pacientes en fase inicial, mientras que la intervención quirúrgica es necesaria en las fases posteriores. En 1985, se informó del primer tratamiento exitoso de la QA con el uso de propamidina al 0,1% y neomicina al 1%.26 Desde entonces, la terapia combinada ha seguido siendo el pilar del tratamiento, con la aplicación de dos o más antiamebianos tópicos a lo largo del día.
Los antisépticos catiónicos eficaces, sobre todo la polihexametilenbiguanida (PHMB, 0,02%) y la clorhexidina (0,02%), han demostrado su eficacia tanto en monoterapia como en terapia combinada con una diamidina26 como Brolene (isetionato de propamidina e isetionato de dibromopropamidina).8 Los antisépticos catiónicos son bases fuertes cuyo potencial antiamebiano se deriva de su capacidad para lisar las células uniéndose a la bicapa de fosfolípidos y causando un daño mortal en la membrana.27 El uso de estos antisépticos ha aportado grandes mejoras tanto en los pacientes con QA que no usan lentes de contacto como en los que sí las usan.8 Las diamidinas actúan interfiriendo en la transferencia del grupo metilo o perturbando directamente los ácidos nucleicos amebianos.28 La aplicación horaria de isetionato de propamidina al 0,1% y de dibromopropamidina al 0,15% sólo ha tenido éxito en las primeras fases de la enfermedad. Los corticosteroides también se prescriben a veces para reducir la inflamación y el dolor, pero pueden aumentar simultáneamente la patogenicidad de las amebas al suprimir la respuesta inmunitaria del paciente.29
El tratamiento quirúrgico sigue siendo una opción necesaria cuando la infección ha progresado más allá del punto de viabilidad antiinfecciosa. La queratoplastia penetrante se utiliza para eliminar y reemplazar el tejido infectado, y se continúa con un régimen antiséptico/diamidina.
La queratitis por Canthamoeba es una enfermedad rara que, si no se detecta, puede dañar permanentemente la córnea y los tejidos anteriores, dejando al paciente ciego en uno o ambos ojos. La amenaza de la QA debe tenerse en cuenta a la hora de tomar la decisión de utilizar o no lentes de contacto, así como el tipo de lente que se debe utilizar. No se puede exagerar la importancia del cuidado adecuado de las lentes, ya que es una forma segura de prevenir no sólo la infección por Acanthamoeba, sino una serie de otras infecciones desagradables y más comunes. La concienciación de la comunidad sobre los peligros asociados a la decloración y el almacenamiento de agua estancada, la adopción más generalizada de hábitos adecuados en el uso de las lentes de contacto y un diagnóstico informado son las únicas formas de tratar eficazmente la Acanthamoeba y detener su creciente prevalencia.
El Dr. Abelson, profesor clínico asociado de oftalmología en la Escuela de Medicina de Harvard y científico clínico principal en el Instituto de Investigación Ocular Schepens, es consultor en productos farmacéuticos oftálmicos. El Sr. Dewey-Mattia es redactor médico en ORA Clinical Research and Development en North Andover, y el Sr. Shapiro es director de antiinfecciosos y antiinflamatorios en la ORA.
1. Moore MB, McCulley JP, Luckenbach M, Gelender H, Newton C, McDonald MB, Visvesvara GS. Acanthamoeba keratitis associated with soft contact lenses. Am J Ophthalmol 1985;100:3:396.
2. Meier PA, Mathers WD, Sutphin JE, Folberg R, Hwang T, Wenzel RP. Una epidemia de presunta queratitis por Acanthamoeba que siguió a una inundación regional. Arch Ophthalmol 1998;116:8:1090-4.
3. Visvesvara GS, Moura H, Schuster FL. Amebas patógenas y oportunistas de vida libre: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, y Sappinia diploidea. FEMS Immunol Med Microbiol 2007;50:1-26.
4. Thebpatiphat N, Hammersmith KM, Rocha FN, Rapuano CJ, Ayres BD, Laibson PR, Eagle RC, Cohen EJ. Acanthamoeba keratitis: Un parásito en aumento. Cornea 2007;26:6:701-6.
5. Marciano-Cabral F, Cabral G. Acanthamoeba spp. como agentes de enfermedad en humanos. Clin Microbiol Rev 2003;16:2:273-307.
6. Mazur T, Hadás E, Iwanicka I. The duration of the cyst stage and the viability and virulence of Acanthamoeba isolates. Trop Med and Parasitol 1995;46:2:106-8.
7. Schuster FL, Visvesvara GS. Free-living amoebae as opportunistic and non-opportnistic pathogens of humans and animals. Int J Parasitology 2004;34:9:1001-27.
8. Sharma S, Garg P, Rao GN. Patient characteristics, diagnosis, and treatment of non-contact lens related Acanthamoeba keratitis. Br J Ophthalmol 2000;84:1103-8.
9. Stehr-Green JK, Bailey TM, Brandt FH, Carr JH, Bond WW, Visvesvara GS. Acanthamoeba keratitis in soft contact lens wearers. Un estudio de casos y controles. JAMA 1987;258:1:57-60.
10. Hiti K, Walochnik J, Haller-Schober EM, Faschinger C, Aspöck H. Viability of Acanthamoeba after exposure to a multipurpose disinfecting contact lens solution and two hydrogen peroxide systems. Br J Ophthalmol 2002;86:2:144-6.
11. Shoff ME, Joslin CE, Tu EY, Kubatko L, Fuerst PA. Eficacia de los sistemas de lentes de contacto contra aislamientos recientes de Acanthamoeba clínicos y de agua del grifo. Cornea 2008;27:6:713-9.
12. Joslin CE, Tu EY, McMahon TT, Passaro DJ, Stayner LT, Sugar J. Epidemiological characteristics of a Chicago-area Acanthamoeba keratitis outbreak. Am J Ophthalmol 2006;142:2:212-217.
13. Mathers W. Uso de mayores concentraciones de medicamentos en el tratamiento de la queratitis por Acanthamoeba. Arch Ophthalmol 2006;124:6:923.
14. Sansanayudh W, Cevallos V, Porco TC, Margolis TP, Lietman TM, Acharya NR. Queratitis por Fusarium y Acanthamoeba: ¿Puede un solo centro detectar los brotes? Br J Ophthalmol 2008;95:5:720-1.
15. Joslin CE, Tu EY, Shoff ME, Booton GC, Fuerst PA, Mchahon TT, Anderson RJ, Dworkin MS, Sugar J, Davis FG, Stayner LT. The association of contact lens solution use and Acanthamoeba keratitis. Am J Ophthalmol 2007;144:2:169-180.
16. Butcko V, McMahon TT, Joslin CE, Jones L. Microbial keratitis and the role of rub and rinsing. Eye Contact Lens 2007;33:6:421-3.
17. Kilvington S, Gray T, Dart J, Morlet N, Beeching JR, Frazer DG, Matheson M. Acanthamoeba keratitis: El papel del agua del grifo doméstica en el Reino Unido. IOVS 2004;45:1:165-169.
18.Thomas PA, Geraldine P. Infectious keratitis. Curr Opin Infect Dis 2007;20:2:129-41.
19.Alizadeth H, Neelam S, Hurt M, Niederkorn JY. Role of contact lens wear, bacterial flora, and mannose-induced pathogenic protease in the pathogenesis of amoebic keratitis. Infect Immun 2005;73:2:1061-8.
20.Watt K, Swarbrick HA. Queratitis microbiana en ortoqueratología nocturna: Revisión de los primeros 50 casos. Eye Contact Lens 2005;31:5:201-8.
21. Hammersmith KM. Diagnóstico y tratamiento de la queratitis por Acanthamoeba. Curr Opin Ophthalmol 2006;17:4:327-31.
22. Lam DS, Houang E, Fan DS, Lyon D, Seal D, Wong E; Hong Kong Microbial Keratitis Study Group. Incidencia y factores de riesgo de queratitis microbiana en Hong Kong: Comparación con Europa y Norteamérica. Eye 2002;16:5:608-18.
23. Seal DV. Acanthamoeba keratitis update – incidence, molecular epidemiology and new drugs for treatment. Eye 2003;17:8:893-905.
24. Tu EY, Joslin CE, Sugar J, Booton GC, Shoff ME, Fuerst PA. The relative value of confocal microscopy and superficial corneal scrapings in the diagnosis of Acanthamoeba keratitis. Cornea 2008;27:7:764-72.
25. Gupta N, Tandom R. Investigative modalities in infectious keratitis. Indian Journal of Ophthalmology 2008;56:3:209-1.3
26. Wright P, Warhurst D, Jones BR. Acanthamoeba keratitis successfully treated medically. Br J Ophthalmol 1985;69:778-782.
27. Lim N, Goh D, Bunce C, Xing W, Fraenkel G, Poole TRG, Ficker L. Comparison of polyhexamethylene biguanide and chlorhexidine as monotherapy agents in the treatment of Acanthamoeba keratitis. Amer J Ophthalmol 2008;145:130.
28. Wysenbeek YS, Blank-Porat D, Harizman N, Wygnanski-Jaffe T, Keller N, Avni I. The reculture technique: Individualización del tratamiento de la queratitis por acanthamoeba. Cornea 2000;19:4:464-7.
29. Berger ST, Mondino BJ, Hoft RH, Donzis PB, Holland GN, Farley MK, Levenson JE, Successful medical management of Acanthamoeba keratitis. Amer J Ophthalmol 1990;110:4:395-403.