Mark B. Abelson, MD, CM FRCSC, Daniel Dewey-Mattia, and Aron Shapiro, North Andover, Mass.
La cheratite da Acanthamoeba è una rara malattia pericolosa per la vista che, negli Stati Uniti e in Europa, si trova prevalentemente tra i portatori di lenti a contatto.1,2 La condizione è causata dall’infezione del protozoo Acanthamoeba ed è comunemente erroneamente identificata come una delle forme più comuni di cheratite fungina o virale, specialmente l’herpes oculare.3 Il trauma corneale accidentale, che è più comune nei paesi in via di sviluppo, e l’uso di lenti a contatto sono i principali fattori di rischio per la AK. I metodi di trattamento hanno più successo durante le fasi iniziali, quindi una diagnosi tempestiva è fondamentale per fermare la progressione della malattia. I pazienti in fase avanzata si trovano spesso a dover affrontare un trapianto di cornea come unico mezzo per riacquistare un’acuità visiva superiore ai semplici movimenti della mano;4 quindi, la AK dovrebbe essere una preoccupazione significativa tra i portatori di lenti a contatto e gli individui che hanno recentemente subito abrasioni corneali chirurgiche o accidentali. La prevenzione è l’arma migliore contro l’AK, poiché la maggior parte dei casi può essere attribuita direttamente alla scarsa igiene delle lenti a contatto o al contatto diretto degli occhi con acqua contaminata.
Acanthamoeba Ecologia
Acanthamoeba è uno dei protozoi più abbondanti sulla terra. I membri del genere Acanthamoeba sono quasi onnipresenti e sono stati isolati dal suolo, dalla polvere, dall’aria, dall’acqua di rubinetto trattata e non trattata, dalle piscine, dalle unità di aria condizionata e da numerosi altri ambienti domestici ed esterni.5 Il ciclo di vita del protozoo consiste in una fase attiva di alimentazione dei trofozoiti e in una fase dormiente delle cisti, che viene attivata da condizioni sfavorevoli, come l’esposizione a temperature estreme, pH alto o basso, secchezza o fame.5 La resilienza attraverso condizioni avverse (le cisti possono rimanere vitali per 24 anni o più)6 permette all’Acanthamoeba un’ampia gamma ecologica e lo rende anche un parassita formidabile nell’uomo.
Siccome l’Acanthamoeba è così prevalente nel nostro ambiente, è sorprendente che le infezioni siano così rare. Non è noto come il nostro sistema immunitario ci protegga dall’infezione, anche se sono stati scoperti anticorpi specifici per l’Acanthamoeba negli esseri umani.3 Prove di Acanthamoeba sono state trovate nel tessuto polmonare e nasale sia di individui malati che sani7 e come patogeno opportunistico l’Acanthamoeba è stato conosciuto per causare encefalite fatale in pazienti immunocompromessi.5 Nella AK, tuttavia, l’infezione si verifica tipicamente in individui immunocompetenti, anche se alcune ricerche suggeriscono che alcuni pazienti AK possono essere suscettibili al patogeno a causa di una mancanza di anticorpi antigene-specifici.3
Ceratite amobica
Si stima che negli Stati Uniti si siano verificati 5.000 casi di cheratite da Acanthamoeba a partire dal 2006, ma poiché la AK è comunemente diagnosticata in modo errato e la malattia non deve essere segnalata ai Centers for Disease Control and Prevention, il numero effettivo potrebbe essere molto più alto.3 Le nazioni in via di sviluppo in Asia e in Africa, dove la AK non è solitamente associata all’uso delle lenti, hanno un tasso eccezionalmente alto di cheratite infettiva. Uno studio su pazienti che portano lenti senza contatto in India ha riportato un risultato visivo finale molto scarso rispetto a ricerche precedenti tra i portatori di lenti nei paesi occidentali.8 Questo potrebbe essere dovuto alla variazione tra ceppi di Acanthamoeba geograficamente distinti o semplicemente al più basso stato socioeconomico e alla mancanza di risorse mediche disponibili per i partecipanti allo studio.8
L’AK è stata documentata per la prima volta negli Stati Uniti nel 1973, dopo che un contadino si graffiò la cornea con filo di ferro e fieno, poi lavò la ferita con acqua di irrigazione.5 Le informazioni diagnostiche e cliniche riguardanti la malattia rimasero scarse fino agli anni ’80; tuttavia, iniziarono ad emergere ricerche che implicavano l’uso di lenti a contatto come fattore di rischio predominante. Dei 208 casi di AK riportati negli Stati Uniti tra il 1973 e il 1988, l’85% erano portatori di lenti a contatto.9 I primi casi documentati di AK legata alle lenti sono stati trovati esclusivamente tra individui che conservavano i loro contatti in soluzioni saline fatte in casa con sale da cucina.9 Da allora l’infezione è stata riscontrata tra i portatori di lenti che utilizzavano soluzioni multiuso e disinfettanti acquistati in negozio, la maggior parte dei quali uccidono efficacemente i trofozoiti di Acanthamoeba ma non le cisti.10
A partire dalla metà degli anni ’90 gli Stati Uniti hanno visto un picco nel numero di casi di AK correlati alle lenti, soprattutto all’interno di alcune popolazioni. Tra il luglio 1993 e il dicembre 1994, un’epidemia ha portato a 43 casi presentati all’University of Iowa Hospitals and Clinics.11 Si ritiene che l’epidemia sia stata associata a inondazioni regionali e alla conseguente contaminazione delle forniture idriche, poiché 29 dei 30 pazienti in uno studio vivevano in contee colpite da inondazioni.2 Analogamente, l’area di Chicago ha visto un aumento significativo di casi di AK dal giugno 2003, con 63 casi riportati entro la fine del 200611 tra una popolazione che dovrebbe avere solo circa due casi all’anno.12 Il numero di pazienti affetti da AK è cresciuto anche a Portland,13 San Francisco,14 Boston4 e Philadelphia.4 La ricerca epidemiologica ha scoperto che circa la metà di tutti i pazienti affetti da AK nell’area di Chicago aveva utilizzato la soluzione “no-rub” Complete Moisture Plus Multi-Purpose (Advanced Medical Optics) per la pulizia e la conservazione dei loro contatti.15 Questa scoperta ha portato a un’indagine della U.S. Food and Drug Administration e a un ritiro volontario da parte di AMO. La ricerca riguardante le soluzioni commerciali “no-rub” per contatti ha dimostrato che questi prodotti hanno un’efficacia minima nell’uccidere l’Acanthamoeba.16 Sia le soluzioni di perossido di idrogeno in una fase che quelle in due fasi, che coinvolgono una seconda soluzione neutralizzante, hanno dimostrato di essere un’alternativa più sicura alle soluzioni di conservazione “no-rub”.10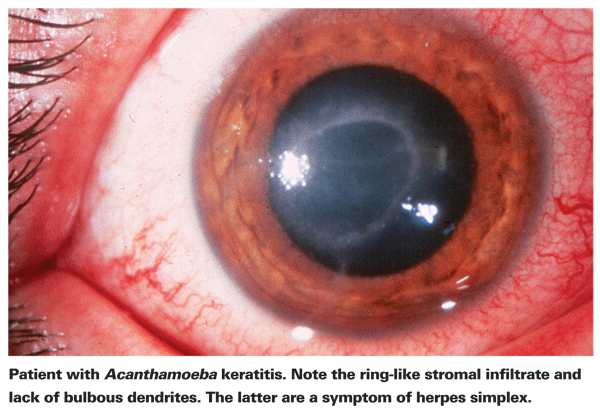
Gli studi hanno iniziato a dimostrare che anche la conservazione e il trattamento dell’acqua della comunità possono giocare un ruolo importante nelle epidemie di AK. In Inghilterra, dove l’incidenza di AK è 15 volte quella degli Stati Uniti, i serbatoi d’acqua sul tetto, raramente sciacquati, possono servire come mezzi eccellenti per la crescita di Acanthamoeba e possono spiegare i tassi gonfiati di AK del paese.17 Un’indagine dopo l’epidemia nell’area di Chicago ha scoperto che non solo l’aumento di AK corrispondeva ad un abbassamento della clorazione dell’acqua della città in seguito ad un mandato dell’Agenzia per la Protezione Ambientale riguardante i sottoprodotti cancerogeni, ma le distanze eccezionalmente lunghe del viaggio dell’acqua comunale nella zona possono aver permesso tempo per un’ulteriore declorazione e colonizzazione di Acanthamoeba.12 Anche se molte procedure di trattamento dell’acqua non sono efficaci nel distruggere le cisti, i disinfettanti come il cloro distruggono efficacemente i trofozoiti liberi e inibiscono la crescita e la riproduzione dei protozoi.12
Uso di contatto e lacrimazione corneale
Traumi corneali, chirurgia oculare e uso di lenti a contatto sono tutti fattori di rischio per lo sviluppo di cheratite infettiva.17 Quando lo strato epiteliale della cornea è danneggiato, è lasciato suscettibile all’infezione da parte di funghi, batteri o protozoi.18 Prima della diffusione delle lenti a contatto, le abrasioni corneali e l’esposizione ad acqua o terreno contaminati erano i fattori di rischio più distinguibili per la AK.
Le lenti a contatto possono aiutare l’Acanthamoeba a raggiungere la cornea e ad aggravare la progressione della malattia. Le lenti servono come una via fisica di passaggio da una fonte contaminata (cioè, la custodia delle lenti o l’acqua del rubinetto) direttamente alla cornea. Le lenti, specialmente se indossate in modo improprio o per più tempo di quanto raccomandato, erodono l’epitelio corneale, permettendo l’ingresso dei microbi.19
L’uso delle lenti è anche associato all’upregulation delle proteine recettoriali mannosilate sulla superficie epiteliale che aumentano la capacità dell’Acanthamoeba di divorare il tessuto corneale.19 I biofilm e i depositi di proteine mannosilate che si accumulano sulla superficie della lente inducono i trofozoiti a produrre maggiori quantità di mediatori di apoptosi epiteliale e proteasi che degradano la matrice dello stroma corneale.19
La suscettibilità all’infezione da Acanthamoeba dipende anche dal tipo di lente a contatto che un individuo usa. Le lenti notturne espongono gli utilizzatori a un rischio drasticamente maggiore di sviluppare l’AK, dato che una revisione ha riscontrato una prevalenza del 30% della malattia tra gli utilizzatori.20 Mentre le lenti giornaliere usa e getta sono il tipo di lente che ha meno probabilità di portare all’infezione,21 gli individui che indossano lenti rigide sono meno soggetti all’AK rispetto agli utilizzatori di lenti morbide.22 Circa l’88% dei casi di AK legati alle lenti a contatto si verifica nei portatori di lenti a contatto morbide e il 12% nei portatori di lenti rigide.23 Le sempre più popolari lenti in silicone idrogel ad uso continuo sono anche un obiettivo più facile per l’attacco di Acanthamoeba rispetto agli idrogel tradizionali.21
Segni e sintomi clinici
I portatori di AK lamentano tipicamente arrossamento, dolore, diminuzione dell’acuità visiva e sensibilità alla luce.5 La caratteristica clinica più distintiva della AK è un pronunciato infiltrato stromale ad anello, ritenuto composto da cellule infiammatorie.5 Segni di sclerite, infiammazione corneale e iperemia congiuntivale iniziano a comparire con il progredire della malattia.5 Se non trattata, l’Acanthamoeba può diffondersi nella retina e causare una grave corioretinite,5 e i pazienti sono spesso ridotti a un’acuità visiva pari al movimento della mano o alla cecità in queste ultime fasi. Una diagnosi tardiva, un infiltrato anulare pronunciato e un’infezione stromale profonda sono tutti associati a un risultato visivo finale più scadente.24 I pazienti che sviluppano una cheratite stromale hanno anche maggiori probabilità di avere un risultato visivo scadente dopo il trattamento rispetto a quelli con un’infezione epiteliale più superficiale.4
Diagnosi
Una corretta diagnosi in fase iniziale è essenziale prima che l’Acanthamoeba invada più profondamente la cornea e causi danni permanenti ai tessuti. Purtroppo, alla visita iniziale la malattia è più comunemente diagnosticata come cheratite da herpes simplex che come AK. Questa errata identificazione può portare all’uso di farmaci antivirali, che peggiorano solo i sintomi per il paziente. Durante la diagnosi, l’Acanthamoeba è spesso considerata come causa di infezione quando le ulcere corneali non rispondono agli antibiotici. Questo ritardo nella diagnosi corretta permette al parassita di avere tutto il tempo per progredire ulteriormente nell’occhio.
Il primo passo verso una diagnosi corretta è un accurato esame con la lampada a fessura. La lampada a fessura può mostrare la prova dell’Acanthamoeba attraverso la sua presenza diretta o attraverso la risposta immunitaria associata.24 La mancanza di dendriti bulbosi tipici nei pazienti con herpes è un buon indicatore che un paziente potrebbe avere l’AK. Un esame precoce e accurato alla lampada a fessura è importante nei pazienti con ulcera corneale, poiché lo stadio della malattia al momento della diagnosi di AK è un forte predittore dell’esito visivo finale.24
Quando disponibile, la diagnosi diretta in-vivo può essere eseguita usando un microscopio confocale a scansione tandem avanzato e un tomografo della retina Heidelberg II (HRT-II) con modulo cornea.7 La reazione a catena della polimerasi può anche essere usata come strumento diagnostico quando sono disponibili troppo poche cellule per una determinazione visiva precisa.5 Se l’esame in vivo e la PCR non sono fattibili, la coltura di raschiature corneali può essere uno strumento prezioso nella diagnosi di Acanthamoeba e nella differenziazione dall’herpes oculare.
Il raschiamento corneale con una preparazione wet-mount di idrossido di potassio dovrebbe essere usato se è possibile un esame microscopico.25 Ulteriori raschiature dovrebbero essere eseguite usando attrezzature sterili fino a che non ci sia materiale sufficiente per le piastre di coltura. I campioni dovrebbero essere incubati a circa 37 C su una piastra di agar non nutritivo rivestita con Escherichia coli.24 Entro pochi giorni, una coltura positiva sarà coperta da Acanthamoeba che si nutre della copertura batterica.3
Trattamento
L’Acanthamoeba è difficile da trattare, ma una gestione efficace può evitare che un paziente diventi cieco in (almeno) un occhio. Gli anti-infettivi topici in genere funzionano solo nei pazienti in fase iniziale, mentre l’intervento chirurgico è necessario nelle fasi successive. Nel 1985, il primo trattamento di successo della AK è stato riportato con l’uso di propamidina 0,1% e neomicina 1%.26 Da allora, la terapia combinata è rimasta il pilastro del trattamento, con l’applicazione di due o più antiamoebici topici durante il giorno.
Gli efficaci antisettici cationici, in particolare il poliesametilene biguanide (PHMB, 0,02%) e la clorexidina (0,02%), hanno dimostrato efficacia sia in monoterapia che in terapia combinata con una diamidina26 come il Brolene (isetionato di propamidina e dibromopropamidina isetionata).8 Gli antisettici cationici sono basi forti il cui potenziale anti-amoebico deriva dalla loro capacità di sciogliere le cellule legandosi al bilayer fosfolipidico e causando danni fatali alla membrana.27 L’uso di questi antisettici ha portato grandi miglioramenti sia nei pazienti con AK senza lenti a contatto che in quelli con lenti a contatto.8 Le diammidine agiscono interferendo con il trasferimento del gruppo metile o disturbando direttamente gli acidi nucleici amebici.28 L’applicazione oraria dello 0,1% di propamidina isetionata e dello 0,15% di dibromopropamidina ha avuto successo solo nelle prime fasi della malattia. Anche i corticosteroidi sono talvolta prescritti per ridurre l’infiammazione e il dolore, ma possono contemporaneamente aumentare la patogenicità delle amebe sopprimendo la risposta immunitaria del paziente.29
Il trattamento chirurgico rimane un’opzione necessaria quando l’infezione è progredita oltre il punto di fattibilità anti-infettiva. La cheratoplastica penetrante viene utilizzata per rimuovere e sostituire il tessuto infetto, e si continua con un regime antisettico/diamidina.
La cheratite di Acanthamoeba è una malattia rara che, se non rilevata, può danneggiare permanentemente la cornea e i tessuti anteriori, lasciando il paziente cieco in uno o entrambi gli occhi. La minaccia della AK dovrebbe essere considerata quando si decide se usare o meno le lenti a contatto e quale tipo di lente usare. L’importanza di una corretta cura delle lenti non può essere sopravvalutata, poiché è un modo sicuro per prevenire non solo l’infezione da Acanthamoeba, ma una serie di altre spiacevoli e più comuni infezioni. La consapevolezza della comunità dei pericoli associati alla declorazione e alla conservazione dell’acqua stagnante, l’adozione più diffusa di abitudini corrette per le lenti a contatto e una diagnosi consapevole sono gli unici modi per trattare efficacemente l’Acanthamoeba e arrestare la sua crescente prevalenza.
Il dottor Abelson, professore clinico associato di oftalmologia alla Harvard Medical School e scienziato clinico senior allo Schepens Eye Research Institute, è consulente in prodotti farmaceutici oftalmici. Il sig. Dewey-Mattia è uno scrittore medico presso ORA Clinical Research and Development a North Andover, e il Sig. Shapiro è direttore degli antinfettivi e antinfiammatori all’ORA.
1. Moore MB, McCulley JP, Luckenbach M, Gelender H, Newton C, McDonald MB, Visvesvara GS. Cheratite di Acanthamoeba associata a lenti a contatto morbide. Am J Ophthalmol 1985;100:3:396.
2. Meier PA, Mathers WD, Sutphin JE, Folberg R, Hwang T, Wenzel RP. Un’epidemia di presunta cheratite da Acanthamoeba che ha seguito un’inondazione regionale. Arch Ophthalmol 1998;116:8:1090-4.
3. Visvesvara GS, Moura H, Schuster FL. Amebe patogene e opportunistiche a vita libera: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, e Sappinia diploidea. FEMS Immunol Med Microbiol 2007;50:1-26.
4. Thebpatiphat N, Hammersmith KM, Rocha FN, Rapuano CJ, Ayres BD, Laibson PR, Eagle RC, Cohen EJ. Cheratite da Acanthamoeba: Un parassita in aumento. Cornea 2007;26:6:701-6.
5. Marciano-Cabral F, Cabral G. Acanthamoeba spp. come agenti di malattia nell’uomo. Clin Microbiol Rev 2003;16:2:273-307.
6. Mazur T, Hadás E, Iwanicka I. The duration of the cyst stage and the viability and virulence of Acanthamoeba isolates. Trop Med and Parasitol 1995;46:2:106-8.
7. Schuster FL, Visvesvara GS. Amebe a vita libera come patogeni opportunistici e non opportunistici dell’uomo e degli animali. Int J Parasitology 2004;34:9:1001-27.
8. Sharma S, Garg P, Rao GN. Caratteristiche del paziente, diagnosi e trattamento della cheratite da Acanthamoeba senza contatto. Br J Ophthalmol 2000;84:1103-8.
9. Stehr-Green JK, Bailey TM, Brandt FH, Carr JH, Bond WW, Visvesvara GS. Cheratite di Acanthamoeba nei portatori di lenti a contatto morbide. Uno studio caso-controllo. JAMA 1987;258:1:57-60.
10. Hiti K, Walochnik J, Haller-Schober EM, Faschinger C, Aspöck H. Vitalità di Acanthamoeba dopo l’esposizione ad una soluzione disinfettante multiuso per lenti a contatto e due sistemi di perossido di idrogeno. Br J Ophthalmol 2002;86:2:144-6.
11. Shoff ME, Joslin CE, Tu EY, Kubatko L, Fuerst PA. Efficacia dei sistemi di lenti a contatto contro i recenti isolati di Acanthamoeba clinici e di acqua di rubinetto. Cornea 2008;27:6:713-9.
12. Joslin CE, Tu EY, McMahon TT, Passaro DJ, Stayner LT, Sugar J. Caratteristiche epidemiologiche di un focolaio di cheratite da Acanthamoeba nella zona di Chicago. Am J Ophthalmol 2006;142:2:212-217.
13. Mathers W. Uso di concentrazioni più elevate di farmaci nel trattamento della cheratite da Acanthamoeba. Arch Ophthalmol 2006;124:6:923.
14. Sansanayudh W, Cevallos V, Porco TC, Margolis TP, Lietman TM, Acharya NR. Cheratite da Fusarium e Acanthamoeba: Può un singolo centro rilevare i focolai? Br J Ophthalmol 2008;95:5:720-1.
15. Joslin CE, Tu EY, Shoff ME, Booton GC, Fuerst PA, Mchahon TT, Anderson RJ, Dworkin MS, Sugar J, Davis FG, Stayner LT. L’associazione dell’uso della soluzione per lenti a contatto e la cheratite da Acanthamoeba. Am J Ophthalmol 2007;144:2:169-180.
16. Butcko V, McMahon TT, Joslin CE, Jones L. Cheratite microbica e il ruolo della frizione e del risciacquo. Eye Contact Lens 2007;33:6:421-3.
17. Kilvington S, Gray T, Dart J, Morlet N, Beeching JR, Frazer DG, Matheson M. Cheratite da Acanthamoeba: Il ruolo dell’acqua di rubinetto domestica nel Regno Unito. IOVS 2004;45:1:165-169.
18.Thomas PA, Geraldine P. Cheratite infettiva. Curr Opin Infect Dis 2007;20:2:129-41.
19.Alizadeth H, Neelam S, Hurt M, Niederkorn JY. Ruolo dell’usura delle lenti a contatto, della flora batterica e della proteasi patogena indotta dal mannosio nella patogenesi della cheratite amebica. Infect Immun 2005;73:2:1061-8.
20.Watt K, Swarbrick HA. Cheratite microbica in ortocheratologia notturna: Revisione dei primi 50 casi. Eye Contact Lens 2005;31:5:201-8.
21. Hammersmith KM. Diagnosi e gestione della cheratite da Acanthamoeba. Curr Opin Ophthalmol 2006;17:4:327-31.
22. Lam DS, Houang E, Fan DS, Lyon D, Seal D, Wong E; Hong Kong Microbial Keratitis Study Group. Incidenza e fattori di rischio per la cheratite microbica a Hong Kong: Confronto con l’Europa e il Nord America. Eye 2002;16:5:608-18.
23. Sigillo DV. Aggiornamento sulla cheratite da Acanthamoeba – incidenza, epidemiologia molecolare e nuovi farmaci per il trattamento. Eye 2003;17:8:893-905.
24. Tu EY, Joslin CE, Sugar J, Booton GC, Shoff ME, Fuerst PA. Il valore relativo della microscopia confocale e dei raschietti corneali superficiali nella diagnosi della cheratite da Acanthamoeba. Cornea 2008;27:7:764-72.
25. Gupta N, Tandom R. Modalità investigative nella cheratite infettiva. Indian Journal of Ophthalmology 2008;56:3:209-1.3
26. Wright P, Warhurst D, Jones BR. Cheratite da Acanthamoeba trattata con successo dal punto di vista medico. Br J Ophthalmol 1985;69:778-782.
27. Lim N, Goh D, Bunce C, Xing W, Fraenkel G, Poole TRG, Ficker L. Confronto tra poliesametilene biguanide e clorexidina come agenti monoterapici nel trattamento della cheratite da Acanthamoeba. Amer J Ophthalmol 2008;145:130.
28. Wysenbeek YS, Blank-Porat D, Harizman N, Wygnanski-Jaffe T, Keller N, Avni I. La tecnica della ricultura: Individuare il trattamento della cheratite da acanthamoeba. Cornea 2000;19:4:464-7.
29. Berger ST, Mondino BJ, Hoft RH, Donzis PB, Holland GN, Farley MK, Levenson JE, Successful medical management of Acanthamoeba keratitis. Amer J Ophthalmol 1990;110:4:395-403.