Mark B. Abelson, MD, CM FRCSC, Daniel Dewey-Mattia, et Aron Shapiro, North Andover, Mass.
La kératite à Acanthamoeba est une maladie rare menaçant la vue qui, aux États-Unis et en Europe, se rencontre principalement chez les porteurs de lentilles de contact1,2. Cette affection est causée par une infection par le protozoaire Acanthamoeba et est souvent confondue avec l’une des formes les plus courantes de kératite fongique ou virale, notamment l’herpès oculaire.3 Le traumatisme cornéen accidentel, plus fréquent dans les pays en développement, et le port de lentilles de contact sont les principaux facteurs de risque de la KA. Les méthodes de traitement sont plus efficaces aux stades précoces, et un diagnostic rapide est donc crucial pour arrêter la progression de la maladie. Les patients à un stade avancé sont souvent confrontés à une greffe de cornée, seul moyen de retrouver une acuité visuelle supérieure aux simples mouvements de la main4 ; la KA doit donc être une préoccupation importante chez les porteurs de lentilles de contact et les personnes ayant récemment subi une abrasion chirurgicale ou accidentelle de la cornée. La prévention est la meilleure arme contre la KA, car la plupart des cas peuvent être directement attribués à une mauvaise hygiène des lentilles de contact ou à un contact oculaire direct avec de l’eau contaminée.
Écologie de l’Acanthamoeba
L’Acanthamoeba est l’un des protozoaires les plus abondants sur terre. Les membres du genre Acanthamoeba sont presque omniprésents et ont été isolés dans le sol, la poussière, l’air, l’eau du robinet traitée et non traitée, les piscines, les unités de climatisation et de nombreux autres environnements domestiques et extérieurs5. Le cycle de vie des protozoaires se compose d’une phase trophozoïte active d’alimentation et d’une phase kyste dormante, qui est activée par des conditions défavorables, telles que l’exposition à une température extrême, un pH élevé ou faible, la sécheresse ou la famine.5 La résilience à travers des conditions défavorables (les kystes peuvent rester viables pendant 24 ans ou plus)6 permet à Acanthamoeba une large gamme écologique et en fait également un parasite redoutable chez les humains.
Puisque Acanthamoeba est si répandu dans notre environnement, il est surprenant que les infections soient si peu fréquentes. On ne sait pas comment notre système immunitaire nous protège de l’infection, bien que des anticorps spécifiques à Acanthamoeba aient été découverts chez l’homme.3 Des preuves d’Acanthamoeba ont été trouvées dans les tissus pulmonaires et nasaux de personnes malades et en bonne santé7 et, en tant qu’agent pathogène opportuniste, Acanthamoeba est connu pour provoquer une encéphalite mortelle chez les patients immunodéprimés5. Dans le cas de la KA, cependant, l’infection survient généralement chez des individus immunocompétents, bien que certaines recherches suggèrent que certains patients atteints de KA pourraient être sensibles à l’agent pathogène en raison d’un manque d’anticorps spécifiques de l’antigène3.
Kératite amibienne
On estime à 5 000 le nombre de cas de kératite à Acanthamoeba aux États-Unis en 2006, mais comme la KA est si souvent mal diagnostiquée et que la maladie n’a pas besoin d’être déclarée aux Centers for Disease Control and Prevention, le nombre réel pourrait être beaucoup plus élevé3. Les pays en développement d’Asie et d’Afrique, où la KA n’est généralement pas associée au port de lentilles, présentent un taux exceptionnellement élevé de kératite infectieuse. Une étude portant sur des patients portant des lentilles sans contact en Inde a fait état d’un résultat visuel final très médiocre par rapport aux recherches précédentes menées chez les porteurs de lentilles dans les pays occidentaux.8 Cela peut être dû à la variation entre les souches d’Acanthamoeba géographiquement distinctes ou simplement au statut socio-économique inférieur et au manque de ressources médicales disponibles pour les participants à l’étude8.
La KA a été documentée pour la première fois aux États-Unis en 1973, après qu’un agriculteur se soit gratté la cornée avec du fil de fer et du foin, puis ait lavé la plaie avec de l’eau d’irrigation.5 Les informations diagnostiques et cliniques concernant la maladie sont restées rares jusque dans les années 1980 ; cependant, des recherches ont commencé à émerger, impliquant le port de lentilles de contact comme facteur de risque prédominant. Sur 208 cas de kératose actinique signalés aux États-Unis entre 1973 et 1988, 85 % étaient des porteurs de lentilles de contact.9 Les premiers cas documentés de kératose actinique liée aux lentilles ont été constatés exclusivement chez des personnes stockant leurs lentilles dans des solutions salines faites maison à base de sel de table.9 L’infection a depuis été constatée chez des porteurs de lentilles utilisant des solutions polyvalentes et des désinfectants achetés en magasin, dont la plupart tuent efficacement les trophozoïtes d’Acanthamoeba mais pas les kystes.10
Dès le milieu des années 1990, les États-Unis ont connu un pic du nombre de cas de KA liés aux lentilles, notamment au sein de certaines populations. Entre juillet 1993 et décembre 1994, une épidémie a donné lieu à 43 cas présentés aux hôpitaux et cliniques de l’Université de l’Iowa.11 On pense que l’épidémie était associée à des inondations régionales et à la contamination subséquente de l’approvisionnement en eau, car 29 des 30 patients d’une étude vivaient dans des comtés touchés par les inondations.2 De même, la région de Chicago a connu une augmentation significative des cas de KA depuis juin 2003, avec 63 cas signalés à la fin de 200611 dans une population qui ne devrait avoir que deux cas par an environ.12 Le nombre de patients souffrant de kératoses actiniques a également augmenté à Portland13, San Francisco14, Boston4 et Philadelphie4. Une étude épidémiologique a révélé qu’environ la moitié des patients souffrant de kératoses actiniques dans la région de Chicago avaient utilisé la solution « sans frottement » Complete Moisture Plus Multi-Purpose (Advanced Medical Optics) pour nettoyer et conserver leurs lentilles de contact15. Les recherches concernant les solutions commerciales pour lentilles de contact » sans frottement » ont montré que ces produits ont une efficacité minimale pour tuer l’Acanthamoeba.16 Les solutions de peroxyde d’hydrogène en une étape et en deux étapes, qui impliquent une deuxième solution neutralisante, se sont avérées être une alternative plus sûre à une solution de stockage » sans frottement « .10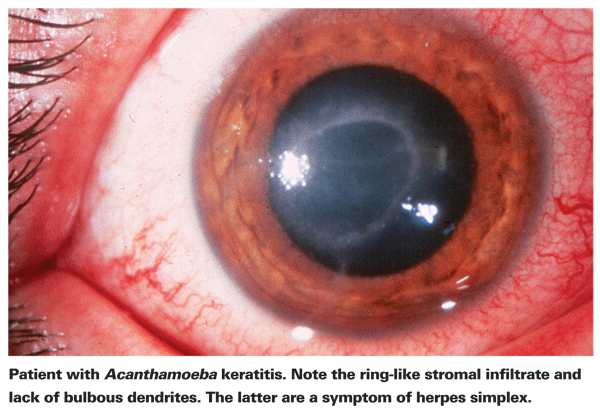
Les études ont commencé à montrer que le stockage et le traitement de l’eau de la communauté peuvent également jouer un rôle important dans les épidémies de KA. En Angleterre, où l’incidence des kératoses actiniques est 15 fois supérieure à celle des Etats-Unis, les réservoirs d’eau sur les toits qui sont rarement vidés peuvent servir d’excellents milieux pour la croissance de l’Acanthamoeba et expliquer les taux élevés de kératoses actiniques dans ce pays.17 Une enquête menée après l’épidémie de la région de Chicago a révélé que non seulement l’augmentation des kératoses actiniques correspondait à une diminution de la chloration de l’eau de la ville à la suite d’un mandat de l’Agence de protection de l’environnement concernant les sous-produits cancérigènes, mais que les distances exceptionnellement longues parcourues par l’eau de la ville dans cette région ont pu laisser le temps à une déchloration supplémentaire et à la colonisation de l’Acanthamoeba.12 Même si de nombreuses procédures de traitement de l’eau ne sont pas efficaces pour détruire les kystes, les désinfectants tels que le chlore détruisent efficacement les trophozoïtes libres et inhibent la croissance et la reproduction des protozoaires.12
Port de contact et déchirure de la cornée
Les traumatismes cornéens, la chirurgie oculaire et l’utilisation de lentilles de contact sont tous des facteurs de risque pour le développement d’une kératite infectieuse.17 Lorsque la couche épithéliale de la cornée est endommagée, elle reste susceptible d’être infectée par des champignons, des bactéries ou des protozoaires.18 Avant la généralisation de l’utilisation des lentilles de contact, les abrasions cornéennes et l’exposition à de l’eau ou à des sols contaminés étaient les facteurs de risque les plus distingués de la KA.
Les lentilles de contact peuvent aider Acanthamoeba à atteindre la cornée et exacerber la progression de la maladie. Les lentilles servent de voie de passage physique depuis une source contaminée (c’est-à-dire l’étui de rangement des lentilles ou l’eau du robinet) directement vers la cornée. Les lentilles, en particulier lorsqu’elles sont portées de manière incorrecte ou pendant une durée supérieure à celle recommandée, érodent l’épithélium cornéen, permettant ainsi l’entrée des microbes.19
Le port de lentilles est également associé à une régulation à la hausse des protéines réceptrices mannosylées sur la surface épithéliale qui augmentent la capacité d’Acanthamoeba à ronger le tissu cornéen.19 Les biofilms et les dépôts de protéines mannosylées qui s’accumulent à la surface de la lentille amènent les trophozoïtes à produire des quantités accrues de médiateurs de l’apoptose épithéliale et de protéases qui dégradent la matrice du stroma cornéen.19
La susceptibilité à l’infection par Acanthamoeba dépend également du type de lentille de contact utilisé par un individu. Les lentilles de nuit exposent les utilisateurs à un risque drastiquement plus élevé de développer une KA, une étude ayant révélé une prévalence de 30 % de la maladie chez les utilisateurs.20 Alors que les lentilles jetables journalières sont le type de lentilles le moins susceptible d’entraîner une infection,21 les personnes qui portent des lentilles rigides sont moins sujettes à la KA que les utilisateurs de lentilles souples.22 Environ 88 % des cas de KA liés aux lentilles de contact surviennent chez les porteurs de lentilles souples et 12 % chez les porteurs de lentilles rigides.23 Les lentilles en silicone hydrogel à port continu, de plus en plus populaires, sont également une cible plus facile pour la fixation d’Acanthamoeba que les hydrogels conventionnels.21
Signes et symptômes cliniques
Les personnes souffrant de KA se plaignent généralement de rougeurs, de douleurs, d’une baisse de l’acuité visuelle et d’une sensibilité à la lumière.5 La caractéristique clinique la plus distinctive de la KA est un infiltrat stromal annulaire prononcé, que l’on pense être composé de cellules inflammatoires.5 Des signes de sclérite, d’inflammation cornéenne et d’hyperémie conjonctivale commencent à apparaître à mesure que la maladie progresse.5 En l’absence de traitement, l’Acanthamoeba peut se propager dans la rétine et provoquer une choriorétinite grave,5 et les patients sont souvent réduits à une acuité visuelle du mouvement de la main ou à la cécité à ces stades ultérieurs. Un diagnostic tardif, un infiltrat annulaire prononcé et une infection stromale profonde sont tous associés à un moins bon résultat visuel final.24 Les patients qui développent une kératite stromale sont également plus susceptibles d’avoir un mauvais résultat visuel après traitement que ceux qui présentent une infection épithéliale plus superficielle4.
Diagnostic
Un diagnostic approprié à un stade précoce est essentiel avant que l’Acanthamoeba n’envahisse plus profondément la cornée et ne cause des dommages permanents aux tissus. Malheureusement, lors de la visite initiale, la maladie est plus souvent diagnostiquée comme une kératite herpès simplex que comme une AK. Cette erreur d’identification peut conduire à l’utilisation de médicaments antiviraux, qui ne font qu’aggraver les symptômes du patient. Lors du diagnostic, l’Acanthamoeba est souvent considéré comme une cause d’infection lorsque les ulcères cornéens ne répondent pas aux antibiotiques. Ce retard dans le diagnostic approprié laisse au parasite tout le temps de progresser davantage dans l’œil.
La première étape vers un diagnostic approprié est un examen précis à la lampe à fente. La lampe à fente peut mettre en évidence la présence d’Acanthamoeba soit par sa présence directe, soit par la réponse immunitaire associée.24 L’absence de dendrites bulbeuses typiques des patients atteints d’herpès est un bon indicateur qu’un patient pourrait être atteint de KA. Un examen précoce et précis à la lampe à fente est important chez les patients souffrant d’un ulcère de la cornée, car le stade de la maladie au moment du diagnostic de la KA est un facteur prédictif important du résultat visuel final.24
Lorsqu’il est disponible, le diagnostic in-vivo direct peut être réalisé à l’aide d’un microscope confocal à balayage en tandem avancé et du tomographe rétinien Heidelberg II (HRT-II) avec module cornéen.7 La réaction en chaîne par polymérase peut également être utilisée comme outil de diagnostic lorsque trop peu de cellules sont disponibles pour une détermination visuelle précise.5 Si l’examen in vivo et la PCR ne sont pas réalisables, la mise en culture de raclages cornéens peut être un outil précieux pour le diagnostic de l’Acanthamoeba et pour le différencier de l’herpès oculaire.
Le raclage cornéen avec une préparation humide d’hydroxyde de potassium doit être utilisé si un examen microscopique est possible.25 Des raclages supplémentaires doivent être effectués en utilisant un équipement stérile jusqu’à ce qu’il y ait suffisamment de matériel pour les plaques de culture. Les échantillons doivent être incubés à environ 37 C sur une plaque de gélose non nutritive recouverte d’Escherichia coli.24 En quelques jours, une culture positive sera recouverte d’Acanthamoeba se nourrissant de la superposition bactérienne3.
Traitement
L’Acanthamoeba est difficile à traiter, mais une gestion efficace peut empêcher un patient de devenir aveugle d’un œil (au moins). Les anti-infectieux topiques ne sont généralement efficaces qu’aux premiers stades, tandis qu’une intervention chirurgicale est nécessaire aux stades ultérieurs. En 1985, le premier traitement réussi de l’AK a été rapporté avec l’utilisation de propamidine 0,1% et de néomycine 1%.26 Depuis lors, la thérapie combinée est restée le pilier du traitement, avec l’application de deux ou plusieurs anti-amibiens topiques tout au long de la journée.
Les antiseptiques cationiques efficaces, plus particulièrement le polyhexaméthylène biguanide (PHMB, 0,02%) et la chlorhexidine (0,02%), ont montré leur efficacité en monothérapie et en thérapie combinée avec une diamidine26 telle que le Brolene (iséthionate de propamidine et iséthionate de dibromopropamidine).8 Les antiseptiques cationiques sont des bases fortes dont le potentiel anti-amibien provient de leur capacité à lyser les cellules en se liant à la bicouche phospholipidique et en provoquant des lésions membranaires fatales27. L’utilisation de ces antiseptiques a permis d’améliorer considérablement la situation des patients atteints de kératoconjonctivite, qu’ils portent ou non des lentilles de contact.8 Les diamidines agissent soit en interférant avec le transfert des groupes méthyles, soit en perturbant directement les acides nucléiques amibiens.28 L’application horaire d’iséthionate de propamidine à 0,1 % et de dibromopropamidine à 0,15 % n’a donné de bons résultats que dans les premiers stades de la maladie. Les corticostéroïdes sont également parfois prescrits pour réduire l’inflammation et la douleur, mais peuvent simultanément augmenter la pathogénicité des amibes en supprimant la réponse immunitaire du patient.29
Le traitement chirurgical reste une option nécessaire lorsque l’infection a progressé au-delà du point de viabilité des anti-infectieux. Une kératoplastie pénétrante est utilisée pour retirer et remplacer le tissu infecté, et un régime antiseptique/diamidine est poursuivi.
La kératite à Acanthamoeba est une maladie rare qui, si elle n’est pas détectée, peut endommager de façon permanente la cornée et les tissus antérieurs, laissant le patient aveugle d’un ou des deux yeux. La menace de la KA doit être prise en compte lorsque l’on décide d’utiliser ou non des lentilles de contact, ainsi que le type de lentilles à utiliser. On ne saurait trop insister sur l’importance d’un bon entretien des lentilles, car c’est un moyen infaillible de prévenir non seulement l’infection à Acanthamoeba, mais aussi une foule d’autres infections désagréables et plus courantes. La sensibilisation de la communauté aux dangers associés à la déchloration et au stockage de l’eau stagnante, l’adoption plus généralisée de bonnes habitudes en matière de lentilles de contact et un diagnostic bien informé sont les seuls moyens de traiter efficacement l’Acanthamoeba et de mettre fin à sa prévalence croissante.
Le Dr Abelson, professeur clinique associé d’ophtalmologie à la Harvard Medical School et scientifique clinique principal au Schepens Eye Research Institute, est consultant en produits pharmaceutiques ophtalmiques. M. Dewey-Mattia est rédacteur médical chez ORA Clinical Research and Development à North Andover, et M.. Shapiro est directeur des anti-infectieux et des anti-inflammatoires à l’ORA.
1. Moore MB, McCulley JP, Luckenbach M, Gelender H, Newton C, McDonald MB, Visvesvara GS. Acanthamoeba keratitis associated with soft contact lenses. Am J Ophthalmol 1985;100:3:396.
2. Meier PA, Mathers WD, Sutphin JE, Folberg R, Hwang T, Wenzel RP. Une épidémie de kératite Acanthamoeba présumée qui a suivi une inondation régionale. Arch Ophthalmol 1998;116:8:1090-4.
3. Visvesvara GS, Moura H, Schuster FL. Amibes libres pathogènes et opportunistes : Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, et Sappinia diploidea. FEMS Immunol Med Microbiol 2007;50:1-26.
4. Thebpatiphat N, Hammersmith KM, Rocha FN, Rapuano CJ, Ayres BD, Laibson PR, Eagle RC, Cohen EJ. Acanthamoeba keratitis : A parasite on the rise. Cornea 2007;26:6:701-6.
5. Marciano-Cabral F, Cabral G. Acanthamoeba spp. as agents of disease in humans. Clin Microbiol Rev 2003;16:2:273-307.
6. Mazur T, Hadás E, Iwanicka I. La durée du stade du kyste et la viabilité et la virulence des isolats d’Acanthamoeba. Trop Med and Parasitol 1995;46:2:106-8.
7. Schuster FL, Visvesvara GS. Les amibes libres comme pathogènes opportunistes et non-opportunes des humains et des animaux. Int J Parasitology 2004;34:9:1001-27.
8. Sharma S, Garg P, Rao GN. Caractéristiques des patients, diagnostic et traitement de la kératite à Acanthamoeba liée aux lentilles non-contact. Br J Ophthalmol 2000;84:1103-8.
9. Stehr-Green JK, Bailey TM, Brandt FH, Carr JH, Bond WW, Visvesvara GS. Acanthamoeba keratitis in soft contact lens wearers. A case-control study. JAMA 1987;258:1:57-60.
10. Hiti K, Walochnik J, Haller-Schober EM, Faschinger C, Aspöck H. Viabilité d’Acanthamoeba après exposition à une solution désinfectante polyvalente pour lentilles de contact et à deux systèmes de peroxyde d’hydrogène. Br J Ophthalmol 2002;86:2:144-6.
11. Shoff ME, Joslin CE, Tu EY, Kubatko L, Fuerst PA. Efficacité des systèmes de lentilles de contact contre les isolats récents d’Acanthamoeba cliniques et de l’eau du robinet. Cornea 2008;27:6:713-9.
12. Joslin CE, Tu EY, McMahon TT, Passaro DJ, Stayner LT, Sugar J. Epidemiological characteristics of a Chicago-area Acanthamoeba keratitis outbreak. Am J Ophthalmol 2006;142:2:212-217.
13. Mathers W. Utilisation de concentrations plus élevées de médicaments dans le traitement de la kératite à Acanthamoeba. Arch Ophthalmol 2006;124:6:923.
14. Sansanayudh W, Cevallos V, Porco TC, Margolis TP, Lietman TM, Acharya NR. Kératite à Fusarium et Acanthamoeba : Un seul centre peut-il détecter des épidémies ? Br J Ophthalmol 2008;95:5:720-1.
15. Joslin CE, Tu EY, Shoff ME, Booton GC, Fuerst PA, Mchahon TT, Anderson RJ, Dworkin MS, Sugar J, Davis FG, Stayner LT. The association of contact lens solution use and Acanthamoeba keratitis. Am J Ophthalmol 2007;144:2:169-180.
16. Butcko V, McMahon TT, Joslin CE, Jones L. Microbial keratitis and the role of rub and rinsing. Eye Contact Lens 2007;33:6:421-3.
17. Kilvington S, Gray T, Dart J, Morlet N, Beeching JR, Frazer DG, Matheson M. Acanthamoeba keratitis : The role of domestic tap water in the United Kingdom. IOVS 2004;45:1:165-169.
18.Thomas PA, Geraldine P. Infectious keratitis. Curr Opin Infect Dis 2007;20:2:129-41.
19.Alizadeth H, Neelam S, Hurt M, Niederkorn JY. Rôle du port de lentilles de contact, de la flore bactérienne et de la protéase pathogène induite par le mannose dans la pathogenèse de la kératite amibienne. Infect Immun 2005;73:2:1061-8.
20.Watt K, Swarbrick HA. Kératite microbienne en orthokératologie de nuit : Examen des 50 premiers cas. Eye Contact Lens 2005;31:5:201-8.
21. Hammersmith KM. Diagnostic et gestion de la kératite à Acanthamoeba. Curr Opin Ophthalmol 2006;17:4:327-31.
22. Lam DS, Houang E, Fan DS, Lyon D, Seal D, Wong E ; Hong Kong Microbial Keratitis Study Group. Incidence et facteurs de risque de la kératite microbienne à Hong Kong : Comparaison avec l’Europe et l’Amérique du Nord. Eye 2002;16:5:608-18.
23. Seal DV. Mise à jour de la kératite à Acanthamoeba – incidence, épidémiologie moléculaire et nouveaux médicaments pour le traitement. Eye 2003;17:8:893-905.
24. Tu EY, Joslin CE, Sugar J, Booton GC, Shoff ME, Fuerst PA. La valeur relative de la microscopie confocale et des raclages cornéens superficiels dans le diagnostic de la kératite à Acanthamoeba. Cornea 2008;27:7:764-72.
25. Gupta N, Tandom R. Modalités d’investigation dans les kératites infectieuses. Indian Journal of Ophthalmology 2008;56:3:209-1.3
26. Wright P, Warhurst D, Jones BR. Kératite d’Acanthamoeba traitée médicalement avec succès. Br J Ophthalmol 1985;69:778-782.
27. Lim N, Goh D, Bunce C, Xing W, Fraenkel G, Poole TRG, Ficker L. Comparaison du polyhexaméthylène biguanide et de la chlorhexidine comme agents de monothérapie dans le traitement de la kératite à Acanthamoeba. Amer J Ophthalmol 2008;145:130.
28. Wysenbeek YS, Blank-Porat D, Harizman N, Wygnanski-Jaffe T, Keller N, Avni I. La technique de reculture : Individualizing the treatment of acanthamoeba keratitis. Cornea 2000;19:4:464-7.
29. Berger ST, Mondino BJ, Hoft RH, Donzis PB, Holland GN, Farley MK, Levenson JE, Successful medical management of Acanthamoeba keratitis. Amer J Ophthalmol 1990;110:4:395-403.