Mark B. Abelson, MD, CM FRCSC, Daniel Dewey-Mattia, and Aron Shapiro, North Andover, Mass.
Acanthamoeba keratitis is a rare sight-threatening disease which, in the United States and Europe, is found predominantly among contact lens wearers.1,2 Choroba ta jest spowodowana zakażeniem pierwotniakiem Acanthamoeba i jest często błędnie rozpoznawana jako jedna z bardziej powszechnych grzybiczych lub wirusowych postaci zapalenia rogówki, zwłaszcza opryszczki ocznej.3 Przypadkowy uraz rogówki, który jest częstszy w krajach rozwijających się, oraz noszenie soczewek kontaktowych są głównymi czynnikami ryzyka AK. Metody leczenia są najskuteczniejsze we wczesnych stadiach, dlatego szybka diagnoza jest kluczowa dla zatrzymania postępu choroby. Pacjenci w późniejszym stadium choroby często stają przed koniecznością przeszczepu rogówki jako jedynego sposobu na odzyskanie ostrości wzroku nie tylko w zakresie ruchów ręki4; dlatego AK powinna być istotnym problemem dla osób noszących soczewki kontaktowe i osób, które niedawno doświadczyły chirurgicznego lub przypadkowego otarcia rogówki. Zapobieganie jest najlepszą bronią przeciwko AK, ponieważ większość przypadków można bezpośrednio przypisać złej higienie soczewek kontaktowych lub bezpośredniemu kontaktowi oka z zanieczyszczoną wodą.
Acanthamoeba Ecology
Acanthamoeba jest jednym z bardziej obfitych pierwotniaków na Ziemi. Członkowie rodzaju Acanthamoeba są niemal wszechobecni i zostali wyizolowani z gleby, kurzu, powietrza, oczyszczonej i nie oczyszczonej wody wodociągowej, basenów, klimatyzatorów i wielu innych środowisk domowych i zewnętrznych.5 Cykl życiowy pierwotniaków składa się z aktywnej fazy trofozoitu żerującego i fazy uśpionej cysty, która jest aktywowana przez niekorzystne warunki, takie jak ekspozycja na ekstremalną temperaturę, wysokie lub niskie pH, wysuszenie lub głód.5 Odporność na niekorzystne warunki (cysty mogą pozostać żywotne przez 24 lata lub dłużej)6 pozwala Acanthamoeba na szeroki zakres ekologiczny i czyni ją groźnym pasożytem u ludzi.
Ponieważ Acanthamoeba jest tak powszechna w naszym środowisku, zaskakujące jest to, że zakażenia są tak rzadkie. Nie wiadomo, w jaki sposób nasz układ odpornościowy chroni nas przed zakażeniem, chociaż u ludzi wykryto przeciwciała specyficzne dla Acanthamoeba.3 Dowody obecności Acanthamoeba znaleziono w tkance płuc i nosa zarówno osób chorych, jak i zdrowych7 , a jako patogen oportunistyczny Acanthamoeba była znana z wywoływania śmiertelnego zapalenia mózgu u pacjentów z obniżoną odpornością.5. Jednak w AK do zakażenia dochodzi zwykle u osób z prawidłową odpornością, chociaż niektóre badania sugerują, że niektórzy pacjenci z AK mogą być podatni na ten patogen z powodu braku przeciwciał swoistych dla antygenu.3
Amoebic Keratitis
Oszacowano, że w 2006 roku w Stanach Zjednoczonych wystąpiło 5000 przypadków zapalenia rogówki wywołanego przez Acanthamoeba, ale ponieważ AK jest tak powszechnie błędnie diagnozowana, a choroba nie musi być zgłaszana do Centers for Disease Control and Prevention, rzeczywista liczba może być znacznie wyższa.3 Kraje rozwijające się w Azji i Afryce, gdzie AK zazwyczaj nie jest związane z noszeniem soczewek, mają wyjątkowo wysoki wskaźnik infekcyjnego zapalenia rogówki. W jednym z badań nad pacjentami noszącymi soczewki bezkontaktowe w Indiach odnotowano bardzo zły końcowy wynik wizualny w porównaniu z wcześniejszymi badaniami przeprowadzonymi wśród użytkowników soczewek w krajach zachodnich.8 Może to być spowodowane różnicami pomiędzy geograficznie odrębnymi szczepami Acanthamoeba lub po prostu niższym statusem socjoekonomicznym i brakiem środków medycznych dostępnych dla uczestników badania.8
AK została po raz pierwszy udokumentowana w Stanach Zjednoczonych w 1973 roku, po tym jak rolnik zadrapał rogówkę drutem i sianem, a następnie przemył ranę wodą do nawadniania.5 Informacje diagnostyczne i kliniczne dotyczące tej choroby pozostawały skąpe aż do lat 80-tych; zaczęły się jednak pojawiać badania wskazujące na noszenie soczewek kontaktowych jako dominujący czynnik ryzyka. Spośród 208 przypadków AK zgłoszonych w Stanach Zjednoczonych w latach 1973-1988, 85 procent stanowiły osoby noszące soczewki kontaktowe.9 Wczesne udokumentowane przypadki AK związanej z soczewkami znaleziono wyłącznie wśród osób przechowujących swoje kontakty w domowych roztworach soli wykonanych z soli kuchennej.9 Od tego czasu zakażenie stwierdzono wśród użytkowników soczewek używających kupowanych w sklepach płynów wielofunkcyjnych i środków dezynfekujących, z których większość skutecznie zabija trofozoity Acanthamoeba, ale nie cysty.10
Począwszy od połowy lat dziewięćdziesiątych w Stanach Zjednoczonych zaobserwowano gwałtowny wzrost liczby przypadków AK związanej z soczewkami, zwłaszcza w pewnych populacjach. W okresie od lipca 1993 do grudnia 1994 roku epidemia doprowadziła do 43 przypadków zgłoszonych do University of Iowa Hospitals and Clinics.11 Uważa się, że epidemia była związana z regionalną powodzią i następującym po niej skażeniem wodociągów, ponieważ 29 z 30 pacjentów w jednym z badań mieszkało w hrabstwach dotkniętych powodzią.2 Podobnie w rejonie Chicago od czerwca 2003 roku zaobserwowano znaczny wzrost liczby przypadków AK – do końca 2006 roku zgłoszono 63 przypadki11 w populacji, w której spodziewano się tylko około dwóch przypadków rocznie.12 Liczba pacjentów z AK wzrosła również w Portland,13 San Francisco,14 Bostonie4 i Filadelfii.4 Badania epidemiologiczne wykazały, że około połowa wszystkich pacjentów z AK w rejonie Chicago używała do czyszczenia i przechowywania kontaktów roztworu „no-rub” Complete Moisture Plus Multi-Purpose (Advanced Medical Optics).15 To odkrycie doprowadziło do dochodzenia U.S. Food and Drug Administration i dobrowolnego wycofania produktu z rynku przez AMO. Badania dotyczące komercyjnych roztworów do kontaktu typu „no-rub” wykazały, że produkty te mają minimalną skuteczność w zabijaniu Acanthamoeba.16 Wykazano, że zarówno jedno-, jak i dwuetapowe roztwory nadtlenku wodoru, które zawierają drugi roztwór neutralizujący, są bezpieczniejszą alternatywą dla roztworów do przechowywania typu „no-rub”.10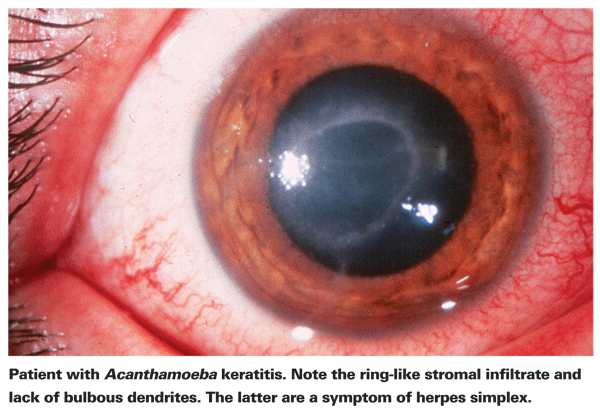
Badania zaczęły wykazywać, że przechowywanie i uzdatnianie wody w społeczności lokalnej może również odgrywać dużą rolę w powstawaniu ognisk AK. W Anglii, gdzie częstość występowania AK jest 15 razy większa niż w Stanach Zjednoczonych, rzadko wypłukiwane dachowe zbiorniki na wodę mogą służyć jako doskonałe pożywki dla rozwoju Acanthamoeba i wyjaśniać tak wysokie wskaźniki zachorowań na AK.17 Badania przeprowadzone po wybuchu epidemii w Chicago wykazały, że wzrost liczby zachorowań na AK nie tylko był związany z obniżeniem poziomu chlorowania wody miejskiej w następstwie nakazu Agencji Ochrony Środowiska dotyczącego rakotwórczych produktów ubocznych, ale również wyjątkowo długie dystanse przemieszczania się wody miejskiej w tym rejonie mogły dać czas na dodatkową dechlorację i kolonizację Acanthamoeba.12 Nawet jeśli wiele procedur uzdatniania wody nie jest skutecznych w niszczeniu cyst, środki dezynfekujące takie jak chlor skutecznie niszczą wolne trofozoity i hamują wzrost i rozmnażanie pierwotniaków.12
Nużywanie soczewek kontaktowych i rogówki
Uraz rogówki, operacje okulistyczne i używanie soczewek kontaktowych są czynnikami ryzyka rozwoju infekcyjnego zapalenia rogówki.17 Kiedy warstwa nabłonkowa rogówki zostaje uszkodzona, staje się ona podatna na zakażenie przez grzyby, bakterie lub pierwotniaki.18 Przed rozpowszechnieniem soczewek kontaktowych najbardziej charakterystycznymi czynnikami ryzyka AK były otarcia rogówki i kontakt ze skażoną wodą lub ziemią.
Soczewki kontaktowe mogą ułatwić Acanthamoebie dotarcie do rogówki i nasilić postęp choroby. Soczewki służą jako fizyczna droga przejścia z zanieczyszczonego źródła (np. pojemnika do przechowywania soczewek lub wody z kranu) bezpośrednio do rogówki. Soczewki, zwłaszcza jeśli są noszone nieprawidłowo lub dłużej niż jest to zalecane, powodują erozję nabłonka rogówki, umożliwiając wniknięcie drobnoustrojów.19
Zużywanie soczewek wiąże się również ze wzrostem stężenia mannozylowanych białek receptorowych na powierzchni nabłonka, które zwiększają zdolność Acanthamoeby do zjadania tkanki rogówki.19 Biofilmy i złogi mannozylowanych białek, które gromadzą się na powierzchni soczewki powodują, że trofozoity produkują zwiększone ilości mediatorów apoptozy nabłonka i proteaz, które degradują macierz zrębu rogówki.19
Podatność na zakażenie Acanthamoeba zależy również od rodzaju soczewek kontaktowych, jakie dana osoba używa. Soczewki jednodniowe stanowią drastycznie większe ryzyko rozwoju AK – w jednym z przeglądów stwierdzono 30-procentową częstość występowania tej choroby wśród użytkowników.20 Soczewki jednodniowe są najmniej podatne na zakażenie,21 natomiast osoby noszące soczewki sztywne są mniej podatne na AK niż użytkownicy soczewek miękkich.22 Około 88% przypadków AK związanych z soczewkami kontaktowymi występuje u użytkowników soczewek miękkich, a 12% u użytkowników soczewek sztywnych.23 Coraz bardziej popularne silikonowo-hydrożelowe soczewki noszone w trybie ciągłym są również łatwiejszym celem dla przyczepienia się Acanthamoeby niż konwencjonalne hydrożele.21
Objawy kliniczne i symptomy
Cierpiący na AK zazwyczaj skarżą się na zaczerwienienie, ból, obniżenie ostrości wzroku i wrażliwość na światło.5 Najbardziej charakterystyczną cechą kliniczną AK jest wyraźny pierścieniowy naciek zrębu, który, jak się uważa, składa się z komórek zapalnych.5 W miarę postępu choroby pojawiają się objawy zapalenia twardówki, rogówki i spojówki.5 Nieleczona Acanthamoeba może rozprzestrzenić się na siatkówkę i spowodować poważne zapalenie siatkówki i naczyniówki,5 a pacjenci w późniejszych stadiach choroby często tracą ostrość wzroku umożliwiającą poruszanie ręką lub stają się ślepi. Późna diagnoza, wyraźny naciek pierścieniowy i głębokie zakażenie zrębu są związane z gorszym końcowym wynikiem wizualnym.24 Pacjenci, u których rozwinie się zrębu zapalenie rogówki, są również bardziej narażeni na gorszy wynik wizualny po leczeniu niż pacjenci z bardziej powierzchownym zakażeniem nabłonka.4
Diagnostyka
Właściwa diagnostyka we wczesnym stadium jest niezbędna, zanim Acanthamoeba wniknie głębiej w rogówkę i spowoduje trwałe uszkodzenie tkanek. Niestety, przy pierwszej wizycie choroba ta jest częściej rozpoznawana jako herpes simplex keratitis niż AK. Ta błędna identyfikacja może prowadzić do stosowania leków przeciwwirusowych, które tylko pogarszają objawy u pacjenta. Podczas diagnostyki, Acanthamoeba jest często brana pod uwagę jako przyczyna infekcji, gdy wrzody rogówki nie reagują na antybiotyki. To opóźnienie we właściwym rozpoznaniu daje pasożytowi dużo czasu na dalszy postęp w głąb oka.
Pierwszym krokiem w kierunku właściwego rozpoznania jest dokładne badanie w lampie szczelinowej. Lampa szczelinowa może wykazać obecność Acanthamoeby albo przez jej bezpośrednią obecność, albo przez związaną z nią reakcję immunologiczną.24 Brak bulwiastych dendrytów typowych dla pacjentów z opryszczką jest dobrym wskaźnikiem, że pacjent może mieć AK. Wczesne i dokładne badanie w lampie szczelinowej jest ważne u pacjentów z owrzodzeniem rogówki, ponieważ stadium choroby w momencie rozpoznania AK jest silnym predyktorem ostatecznego wyniku wizualnego.24
Gdy jest dostępne, bezpośrednia diagnostyka in-vivo może być wykonana przy użyciu zaawansowanego tandemowego skanującego mikroskopu konfokalnego i tomografu siatkówki Heidelberga II (HRT-II) z modułem rogówki.7 Łańcuchowa reakcja polimerazy może być również użyta jako narzędzie diagnostyczne, gdy dostępna jest zbyt mała liczba komórek do dokładnego określenia wizualnego.5 Jeśli badanie in-vivo i PCR nie są możliwe, hodowla zeskrobin rogówki może być nieocenionym narzędziem w diagnostyce Acanthamoeba i różnicowaniu jej z opryszczką oczną.
Skrobanie rogówki z preparatem do mokrego montażu z wodorotlenkiem potasu powinno być stosowane, jeśli możliwe jest badanie mikroskopowe.25 Dodatkowe zeskrobiny powinny być wykonywane przy użyciu sterylnego sprzętu, aż do uzyskania wystarczającej ilości materiału na płytki do hodowli. Próbki powinny być inkubowane w temperaturze około 37 C na płytce agarowej nie zawierającej substancji odżywczych, pokrytej Escherichia coli.24 W ciągu kilku dni dodatnia hodowla zostanie pokryta Acanthamoeba żerującą na podłożu bakteryjnym.3
Leczenie
Acanthamoeba jest trudna do leczenia, ale skuteczne postępowanie może uchronić pacjenta przed ślepotą w (co najmniej) jednym oku. Miejscowe środki przeciwinfekcyjne zwykle działają tylko u pacjentów we wczesnym stadium, podczas gdy interwencja chirurgiczna jest konieczna w późniejszych stadiach. W 1985 roku opisano pierwsze skuteczne leczenie AK z zastosowaniem propamidyny 0,1% i neomycyny 1%.26 Od tego czasu terapia skojarzona pozostaje podstawą leczenia, z zastosowaniem dwóch lub więcej miejscowych leków przeciwamoebiczych w ciągu dnia.
Skuteczne kationowe środki antyseptyczne, przede wszystkim biguanid poliheksametylenu (PHMB, 0,02%) i chlorheksydyna (0,02%), wykazały skuteczność zarówno w monoterapii, jak i w terapii skojarzonej z diamidyną26 , taką jak Brolene (izetionian propamidyny i izetionian dibromopropamidyny).8 Kationowe środki antyseptyczne są silnymi zasadami, których potencjał anty-amebowy wynika z ich zdolności do liasu komórek poprzez wiązanie się z dwuwarstwą fosfolipidową i powodowanie śmiertelnego uszkodzenia błony.27 Stosowanie tych antyseptyków przyniosło dużą poprawę zarówno u pacjentów z AK nie noszących soczewek kontaktowych, jak i noszących soczewki kontaktowe.8 Diamidyny działają poprzez zakłócanie przenoszenia grup metylowych lub bezpośrednie zakłócanie działania kwasów nukleinowych ameb.28 Godzinne stosowanie 0,1% izetionianu propamidyny i 0,15% dibromopropamidyny wykazało sukces tylko we wczesnych stadiach choroby. Czasami przepisuje się również kortykosteroidy w celu zmniejszenia stanu zapalnego i bólu, ale mogą one jednocześnie zwiększać patogenność ameb poprzez tłumienie odpowiedzi immunologicznej pacjenta.29
Leczenie chirurgiczne pozostaje konieczną opcją, gdy zakażenie rozwinęło się poza punkt żywotności leków przeciwinfekcyjnych. W celu usunięcia i zastąpienia zakażonej tkanki stosuje się keratoplastykę penetrującą, a następnie kontynuuje się leczenie antyseptyczne z zastosowaniem diamidyny.
Acanthamoeba keratitis jest rzadką chorobą, która, jeśli nie zostanie wykryta, może trwale uszkodzić rogówkę i tkanki przednie, powodując ślepotę w jednym lub obu oczach. Zagrożenie AK powinno być brane pod uwagę przy podejmowaniu decyzji czy używać soczewek kontaktowych czy nie, a także jakiego typu soczewek używać. Znaczenie właściwej pielęgnacji soczewek jest nie do przecenienia, ponieważ jest to niezawodny sposób zapobiegania nie tylko zakażeniu Acanthamoeba, ale także wielu innym nieprzyjemnym i bardziej powszechnym infekcjom. Społeczna świadomość zagrożeń związanych z odchlorowywaniem i przechowywaniem wody stojącej, bardziej powszechne przyjęcie właściwych nawyków dotyczących soczewek kontaktowych oraz kompetentna diagnostyka są jedynymi sposobami skutecznego leczenia Acanthamoeby i powstrzymania jej rosnącego rozpowszechnienia.
Dr Abelson, profesor kliniczny okulistyki w Harvard Medical School i starszy naukowiec kliniczny w Schepens Eye Research Institute, konsultuje się w zakresie farmaceutyków okulistycznych. Pan Dewey-Mattia jest autorem tekstów medycznych w ORA Clinical Research and Development w North Andover, a Pan Dewey-Mattia jest autorem tekstów medycznych w ORA Clinical Research and Development w North Andover. Shapiro jest dyrektorem ds. leków przeciwzakaźnych i przeciwzapalnych w ORA.
1. Moore MB, McCulley JP, Luckenbach M, Gelender H, Newton C, McDonald MB, Visvesvara GS. Acanthamoeba keratitis associated with soft contact lenses. Am J Ophthalmol 1985;100:3:396.
2. Meier PA, Mathers WD, Sutphin JE, Folberg R, Hwang T, Wenzel RP. An epidemic of presumed Acanthamoeba keratitis that followed regional flooding. Arch Ophthalmol 1998;116:8:1090-4.
3. Visvesvara GS, Moura H, Schuster FL. Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea. FEMS Immunol Med Microbiol 2007;50:1-26.
4. Thebpatiphat N, Hammersmith KM, Rocha FN, Rapuano CJ, Ayres BD, Laibson PR, Eagle RC, Cohen EJ. Acanthamoeba keratitis: A parasite on the rise. Cornea 2007;26:6:701-6.
5. Marciano-Cabral F, Cabral G. Acanthamoeba spp. jako czynniki chorobotwórcze u ludzi. Clin Microbiol Rev 2003;16:2:273-307.
6. Mazur T, Hadás E, Iwanicka I. Czas trwania stadium cysty a żywotność i wirulencja izolatów Acanthamoeba. Trop Med and Parasitol 1995;46:2:106-8.
7. Schuster FL, Visvesvara GS. Free-living amoebae as opportunistic and non-opportnistic pathogens of humans and animals. Int J Parasitology 2004;34:9:1001-27.
8. Sharma S, Garg P, Rao GN. Patient characteristics, diagnosis, and treatment of non-contact lens related Acanthamoeba keratitis. Br J Ophthalmol 2000;84:1103-8.
9. Stehr-Green JK, Bailey TM, Brandt FH, Carr JH, Bond WW, Visvesvara GS. Acanthamoeba keratitis in soft contact lens users. A case-control study. JAMA 1987;258:1:57-60.
10. Hiti K, Walochnik J, Haller-Schober EM, Faschinger C, Aspöck H. Viability of Acanthamoeba after exposure to a multipurpose disinfecting contact lens solution and two hydrogen peroxide systems. Br J Ophthalmol 2002;86:2:144-6.
11. Shoff ME, Joslin CE, Tu EY, Kubatko L, Fuerst PA. Efficacy of contact lens systems against recent clinical and tap water isolates Acanthamoeba. Cornea 2008;27:6:713-9.
12. Joslin CE, Tu EY, McMahon TT, Passaro DJ, Stayner LT, Sugar J. Epidemiological characteristics of a Chicago-area Acanthamoeba keratitis outbreak. Am J Ophthalmol 2006;142:2:212-217.
13. Mathers W. Use of higher medication concentrations in the treatment of Acanthamoeba keratitis. Arch Ophthalmol 2006;124:6:923.
14. Sansanayudh W, Cevallos V, Porco TC, Margolis TP, Lietman TM, Acharya NR. Fusarium i Acanthamoeba keratitis: Czy pojedynczy ośrodek może wykryć ogniska choroby? Br J Ophthalmol 2008;95:5:720-1.
15. Joslin CE, Tu EY, Shoff ME, Booton GC, Fuerst PA, Mchahon TT, Anderson RJ, Dworkin MS, Sugar J, Davis FG, Stayner LT. The association of contact lens solution use and Acanthamoeba keratitis. Am J Ophthalmol 2007;144:2:169-180.
16. Butcko V, McMahon TT, Joslin CE, Jones L. Microbial keratitis and the role of rub and rinsing. Eye Contact Lens 2007;33:6:421-3.
17. Kilvington S, Gray T, Dart J, Morlet N, Beeching JR, Frazer DG, Matheson M. Acanthamoeba keratitis: The role of domestic tap water in the United Kingdom. IOVS 2004;45:1:165-169.
18.Thomas PA, Geraldine P. Infectious keratitis. Curr Opin Infect Dis 2007;20:2:129-41.
19.Alizadeth H, Neelam S, Hurt M, Niederkorn JY. Role of contact lens wear, bacterial flora, and mannose-induced pathogenic protease in the pathogenesis of amoebic keratitis. Infect Immun 2005;73:2:1061-8.
20.Watt K, Swarbrick HA. Microbial keratitis in overnight orthokeratology: Przegląd pierwszych 50 przypadków. Eye Contact Lens 2005;31:5:201-8.
21. Hammersmith KM. Diagnosis and management of Acanthamoeba keratitis. Curr Opin Ophthalmol 2006;17:4:327-31.
22. Lam DS, Houang E, Fan DS, Lyon D, Seal D, Wong E; Hong Kong Microbial Keratitis Study Group. Incidence and risk factors for microbial keratitis in Hong Kong: Porównanie z Europą i Ameryką Północną. Eye 2002;16:5:608-18.
23. Seal DV. Acanthamoeba keratitis update – incidence, molecular epidemiology and new drugs for treatment. Eye 2003;17:8:893-905.
24. Tu EY, Joslin CE, Sugar J, Booton GC, Shoff ME, Fuerst PA. The relative value of confocal microscopy and superficial corneal scrapings in the diagnosis of Acanthamoeba keratitis. Cornea 2008;27:7:764-72.
25. Gupta N, Tandom R. Investigative modalities in infectious keratitis. Indian Journal of Ophthalmology 2008;56:3:209-1.3
26. Wright P, Warhurst D, Jones BR. Acanthamoeba keratitis successfully treated medically. Br J Ophthalmol 1985;69:778-782.
27. Lim N, Goh D, Bunce C, Xing W, Fraenkel G, Poole TRG, Ficker L. Comparison of polyhexamethylene biguanide and chlorhexidine as monotherapy agents in the treatment of Acanthamoeba keratitis. Amer J Ophthalmol 2008;145:130.
28. Wysenbeek YS, Blank-Porat D, Harizman N, Wygnanski-Jaffe T, Keller N, Avni I. The reculture technique: Individualizing the treatment of acanthamoeba keratitis. Cornea 2000;19:4:464-7.
29. Berger ST, Mondino BJ, Hoft RH, Donzis PB, Holland GN, Farley MK, Levenson JE, Successful medical management of Acanthamoeba keratitis. Amer J Ophthalmol 1990;110:4:395-403.
.