Mark B. Abelson, MD, CM FRCSC, Daniel Dewey-Mattia und Aron Shapiro, North Andover, Mass.
Acanthamoeba-Keratitis ist eine seltene, die Sehkraft bedrohende Erkrankung, die in den Vereinigten Staaten und Europa vorwiegend bei Kontaktlinsenträgern auftritt.1,2 Die Erkrankung wird durch eine Infektion mit dem Protozoon Acanthamoeba verursacht und wird häufig fälschlicherweise für eine der häufigeren Pilz- oder Virusformen der Keratitis gehalten, insbesondere für Herpes oculi.3 Ein unfallbedingtes Hornhauttrauma, das in Entwicklungsländern häufiger vorkommt, und das Tragen von Kontaktlinsen sind die Hauptrisikofaktoren für AK. Die Behandlungsmethoden sind im Frühstadium am erfolgreichsten, daher ist eine schnelle Diagnose entscheidend, um das Fortschreiten der Krankheit aufzuhalten. Bei Patienten in späteren Stadien ist eine Hornhauttransplantation oft die einzige Möglichkeit, eine Sehschärfe wiederzuerlangen, die über einfache Handbewegungen hinausgeht;4 daher sollte AK bei Kontaktlinsenträgern und Personen, die vor kurzem chirurgische oder versehentliche Hornhautabschürfungen erlitten haben, ein wichtiges Anliegen sein. Vorbeugung ist die beste Waffe gegen AK, da die meisten Fälle direkt auf schlechte Kontaktlinsenhygiene oder direkten Augenkontakt mit verunreinigtem Wasser zurückzuführen sind.
Acanthamoeba Ökologie
Acanthamoeba ist einer der häufigsten Protozoen auf der Erde. Mitglieder der Gattung Acanthamoeba sind nahezu allgegenwärtig und wurden aus Erde, Staub, Luft, behandeltem und unbehandeltem Leitungswasser, Schwimmbädern, Klimaanlagen und zahlreichen anderen häuslichen Umgebungen und im Freien isoliert.5 Der Lebenszyklus der Protozoen besteht aus einer aktiven, sich ernährenden Trophozoitenphase und einer ruhenden Zystenphase, die durch ungünstige Bedingungen wie extreme Temperaturen, hohe oder niedrige pH-Werte, Trockenheit oder Hunger aktiviert wird.5 Die Widerstandsfähigkeit gegenüber widrigen Bedingungen (Zysten können 24 Jahre oder länger lebensfähig bleiben)6 ermöglicht Acanthamoeba ein breites ökologisches Spektrum und macht sie auch zu einem gefährlichen Parasiten beim Menschen.
Da Acanthamoeba in unserer Umwelt so häufig vorkommt, ist es überraschend, dass Infektionen so selten sind. Es ist nicht bekannt, wie unser Immunsystem uns vor einer Infektion schützt, obwohl beim Menschen Acanthamoeba-spezifische Antikörper entdeckt wurden.3 Nachweise von Acanthamoeba wurden in Lungen- und Nasengewebe sowohl von kranken als auch von gesunden Menschen gefunden7 , und als opportunistischer Erreger hat Acanthamoeba bei immungeschwächten Patienten bekanntermaßen eine tödliche Enzephalitis verursacht.5 Bei AK tritt die Infektion jedoch typischerweise bei immunkompetenten Personen auf, obwohl einige Untersuchungen darauf hindeuten, dass einige AK-Patienten aufgrund eines Mangels an antigenspezifischen Antikörpern für den Erreger empfänglich sein könnten.3
Amöbenkeratitis
Schätzungsweise 5.000 Fälle von Acanthamoeba-Keratitis sind seit 2006 in den Vereinigten Staaten aufgetreten, aber da AK so häufig fehldiagnostiziert wird und die Krankheit nicht an die Centers for Disease Control and Prevention gemeldet werden muss, könnte die tatsächliche Zahl viel höher sein.3 Entwicklungsländer in Asien und Afrika, wo AK normalerweise nicht mit dem Tragen von Kontaktlinsen in Verbindung gebracht wird, weisen eine außergewöhnlich hohe Rate an infektiöser Keratitis auf. Eine Studie an Patienten, die keine Kontaktlinsen tragen, in Indien berichtete über ein sehr schlechtes visuelles Endergebnis im Vergleich zu früheren Untersuchungen unter Linsenträgern in westlichen Ländern.8 Dies kann auf die Unterschiede zwischen geografisch unterschiedlichen Acanthamoeba-Stämmen oder einfach auf den niedrigeren sozioökonomischen Status und die fehlenden medizinischen Ressourcen der Studienteilnehmer zurückzuführen sein.8
Die AK wurde erstmals 1973 in den Vereinigten Staaten dokumentiert, nachdem ein Landwirt seine Hornhaut mit Draht und Heu zerkratzt und die Wunde anschließend mit Spülwasser ausgespült hatte.5 Bis in die 1980er Jahre gab es nur wenige diagnostische und klinische Informationen über die Krankheit; dann jedoch begannen Untersuchungen, die das Tragen von Kontaktlinsen als Hauptrisikofaktor nahelegten. Von den 208 Fällen von AK, die zwischen 1973 und 1988 in den Vereinigten Staaten gemeldet wurden, waren 85 Prozent Kontaktlinsenträger.9 Die ersten dokumentierten Fälle von AK im Zusammenhang mit Kontaktlinsen wurden ausschließlich bei Personen gefunden, die ihre Kontaktlinsen in selbst hergestellten Kochsalzlösungen aufbewahrten.9 Seitdem wurden Infektionen bei Kontaktlinsenträgern festgestellt, die gekaufte Mehrzwecklösungen und Desinfektionsmittel verwenden, von denen die meisten zwar Acanthamoeba-Trophozoiten, nicht aber Zysten wirksam abtöten.10
Seit Mitte der 1990er Jahre ist in den Vereinigten Staaten ein sprunghafter Anstieg der Zahl der linsenbedingten AK-Fälle zu verzeichnen, insbesondere in bestimmten Bevölkerungsgruppen. Zwischen Juli 1993 und Dezember 1994 führte ein Ausbruch zu 43 Fällen, die den Krankenhäusern und Kliniken der Universität von Iowa gemeldet wurden.11 Es wird vermutet, dass die Epidemie mit regionalen Überschwemmungen und der anschließenden Verunreinigung der Wasserversorgung zusammenhing, da 29 von 30 Patienten in einer Studie in Bezirken lebten, die von den Überschwemmungen betroffen waren.2 In ähnlicher Weise ist die Zahl der AK-Fälle im Großraum Chicago seit Juni 2003 deutlich angestiegen, mit 63 gemeldeten Fällen bis Ende 200611 in einer Bevölkerung, in der nur etwa zwei Fälle pro Jahr zu erwarten wären.12 Auch in Portland,13 San Francisco,14 Boston4 und Philadelphia hat die Zahl der AK-Patienten zugenommen.4 Epidemiologische Untersuchungen ergaben, dass etwa die Hälfte aller AK-Patienten im Großraum Chicago die „No-Rub“-Lösung Complete Moisture Plus Multi-Purpose (Advanced Medical Optics) zur Reinigung und Aufbewahrung ihrer Kontaktlinsen verwendet hatten.15 Dieser Befund führte zu einer Untersuchung durch die US-amerikanische Gesundheitsbehörde Food and Drug Administration und einem freiwilligen Rückruf durch AMO. Untersuchungen zu kommerziellen „No-Rub“-Kontaktlinsenlösungen haben gezeigt, dass diese Produkte nur eine minimale Wirksamkeit bei der Abtötung von Acanthamoeba haben.16 Sowohl einstufige Wasserstoffperoxid- als auch zweistufige Wasserstoffperoxidlösungen, die eine zweite neutralisierende Lösung beinhalten, haben sich als sicherere Alternative zu einer „No-Rub“-Lagerlösung erwiesen.10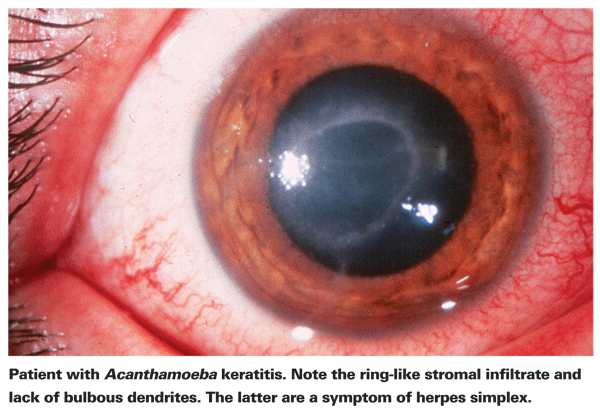
Studien haben begonnen zu zeigen, dass die Wasserlagerung und -aufbereitung in Gemeinden ebenfalls eine große Rolle bei AK-Ausbrüchen spielen kann. In England, wo die AK-Häufigkeit 15-mal so hoch ist wie in den Vereinigten Staaten, können die selten gespülten Wassertanks auf den Dächern als hervorragendes Medium für das Wachstum von Acanthamoeba dienen und die hohen AK-Raten des Landes erklären.17 Untersuchungen nach dem Ausbruch in der Region Chicago ergaben, dass der Anstieg der AK nicht nur mit einer geringeren Chlorierung des städtischen Wassers infolge einer Vorschrift der Umweltschutzbehörde in Bezug auf krebserregende Nebenprodukte zusammenhing, sondern dass die außergewöhnlich weiten Entfernungen, über die das städtische Wasser in der Region fließt, Zeit für eine zusätzliche Dechlorierung und Besiedlung mit Acanthamoeba gelassen haben könnten.12 Obwohl viele Wasseraufbereitungsverfahren die Zysten nicht wirksam zerstören, zerstören Desinfektionsmittel wie Chlor effektiv die freien Trophozoiten und hemmen das Wachstum und die Vermehrung der Protozoen.12
Kontaktlinsentragen und Hornhauttränen
Hornhauttrauma, Augenoperationen und das Tragen von Kontaktlinsen sind allesamt Risikofaktoren für die Entwicklung einer infektiösen Keratitis.17 Wenn die Epithelschicht der Hornhaut geschädigt ist, ist sie anfällig für Infektionen durch Pilze, Bakterien oder Protozoen.18 Vor der weit verbreiteten Verwendung von Kontaktlinsen waren Hornhautabschürfungen und der Kontakt mit kontaminiertem Wasser oder Erde die wichtigsten Risikofaktoren für AK.
Kontaktlinsen können dazu beitragen, dass Acanthamöben die Hornhaut erreichen und das Fortschreiten der Krankheit verschlimmern. Die Linsen dienen als physischer Übertragungsweg von einer kontaminierten Quelle (z. B. Linsenbehälter oder Leitungswasser) direkt zur Hornhaut. Linsen, insbesondere wenn sie unsachgemäß oder länger als empfohlen getragen werden, erodieren das Hornhautepithel und ermöglichen so das Eindringen von Mikroorganismen.19
Das Tragen von Linsen wird auch mit einer Hochregulierung von mannosylierten Rezeptorproteinen auf der Epitheloberfläche in Verbindung gebracht, die die Fähigkeit von Acanthamoeba, das Hornhautgewebe zu zerfressen, verstärken.19 Biofilme und Ablagerungen mannosylierter Proteine, die sich auf der Linsenoberfläche bilden, veranlassen die Trophozoiten, vermehrt epitheliale Apoptose-Mediatoren und Proteasen zu produzieren, die die Matrix des Hornhautstromas abbauen.19
Die Anfälligkeit für Acanthamoeba-Infektionen hängt auch davon ab, welche Art von Kontaktlinsen eine Person verwendet. Bei Nachtlinsen ist das Risiko, an AK zu erkranken, drastisch erhöht, denn in einer Untersuchung wurde eine 30-prozentige Prävalenz der Krankheit bei den Trägern festgestellt.20 Während Tageslinsen der Linsentyp sind, bei dem die Wahrscheinlichkeit einer Infektion am geringsten ist,21 sind Träger von formstabilen Linsen weniger anfällig für AK als Träger von weichen Linsen.22 Etwa 88 Prozent der AK-Fälle bei Kontaktlinsen treten bei Trägern von weichen Kontaktlinsen und 12 Prozent bei Trägern von formstabilen Linsen auf.23 Die immer beliebter werdenden Silikon-Hydrogel-Linsen, die kontinuierlich getragen werden, sind ebenfalls ein leichteres Ziel für Acanthamoeba als herkömmliche Hydrogele.21
Klinische Anzeichen und Symptome
Betroffene von AK klagen typischerweise über Rötung, Schmerzen, verminderte Sehschärfe und Lichtempfindlichkeit.5 Das auffälligste klinische Merkmal von AK ist ein ausgeprägtes ringförmiges Stromainfiltrat, das vermutlich aus Entzündungszellen besteht.5 Mit dem Fortschreiten der Krankheit treten Anzeichen einer Skleritis, einer Hornhautentzündung und einer Bindehauthyperämie auf.5 Unbehandelt kann sich die Acanthamöbe auf die Netzhaut ausbreiten und eine schwere Chorioretinitis verursachen.5 In diesen späteren Stadien sind die Patienten oft auf eine Sehschärfe reduziert, die nur noch eine Handbewegung zulässt, oder erblindet. Eine späte Diagnose, ein ausgeprägtes Ringinfiltrat und eine tiefe Stromainfektion sind mit einem schlechteren endgültigen Sehergebnis verbunden.24 Patienten, die eine Stroma-Keratitis entwickeln, haben auch eher ein schlechtes Sehergebnis nach der Behandlung als Patienten mit einer oberflächlichen Epithelinfektion.4
Diagnose
Eine korrekte Diagnose im Frühstadium ist unerlässlich, bevor die Acanthamoeba tiefer in die Hornhaut eindringt und dauerhafte Gewebeschäden verursacht. Leider wird die Krankheit beim ersten Besuch häufiger als Herpes-simplex-Keratitis als AK diagnostiziert. Diese Fehldiagnose kann dazu führen, dass antivirale Medikamente eingesetzt werden, die die Symptome für den Patienten nur noch verschlimmern. Bei der Diagnose wird Acanthamoeba oft als Infektionsursache in Betracht gezogen, wenn die Hornhautgeschwüre nicht auf Antibiotika ansprechen. Diese Verzögerung bei der richtigen Diagnose gibt dem Parasiten reichlich Zeit, weiter in das Auge vorzudringen.
Der erste Schritt zur richtigen Diagnose ist eine genaue Spaltlampenuntersuchung. Bei der Spaltlampenuntersuchung kann Acanthamoeba entweder direkt oder durch die damit verbundene Immunreaktion nachgewiesen werden.24 Das Fehlen der für Herpes-Patienten typischen knolligen Dendriten ist ein guter Hinweis darauf, dass ein Patient AK haben könnte. Eine frühzeitige und genaue Spaltlampenuntersuchung ist bei Patienten mit Hornhautgeschwüren wichtig, da das Krankheitsstadium zum Zeitpunkt der AK-Diagnose ein starker Prädiktor für das endgültige Sehergebnis ist.24
Wenn verfügbar, kann eine direkte In-vivo-Diagnose unter Verwendung eines fortschrittlichen Tandem-Scanning-Konfokalmikroskops und eines Heidelberg Retina Tomographen II (HRT-II) mit Hornhautmodul durchgeführt werden.7 Die Polymerase-Kettenreaktion kann ebenfalls als diagnostisches Hilfsmittel eingesetzt werden, wenn zu wenige Zellen für eine genaue visuelle Bestimmung verfügbar sind.5 Wenn In-vivo-Untersuchungen und PCR nicht möglich sind, kann die Kultivierung von Hornhautabstrichen ein unschätzbares Hilfsmittel bei der Diagnose von Acanthamoeba und der Unterscheidung von Augenherpes sein.
Hornhautabstriche mit einem Kaliumhydroxid-Nasspräparat sollten verwendet werden, wenn eine mikroskopische Untersuchung möglich ist.25 Weitere Abstriche sollten mit sterilen Geräten durchgeführt werden, bis genügend Material für Kulturplatten vorhanden ist. Die Proben sollten bei etwa 37 C auf einer mit Escherichia coli beschichteten nährstofffreien Agarplatte bebrütet werden.24 Innerhalb weniger Tage wird eine positive Kultur mit Acanthamoeba bedeckt sein, die sich von der bakteriellen Auflage ernähren.3
Behandlung
Acanthamoeba ist schwer zu behandeln, aber eine wirksame Behandlung kann den Patienten davor bewahren, auf (mindestens) einem Auge zu erblinden. Topische Antiinfektiva wirken in der Regel nur bei Patienten im Frühstadium, während in späteren Stadien ein chirurgischer Eingriff erforderlich ist. 1985 wurde über die erste erfolgreiche Behandlung der AK mit Propamidin 0,1 % und Neomycin 1 % berichtet.26 Seitdem ist die Kombinationstherapie die Hauptstütze der Behandlung, wobei zwei oder mehr topische Anti-Amöbika über den Tag verteilt angewendet werden.
Wirksame kationische Antiseptika, vor allem Polyhexamethylenbiguanid (PHMB, 0,02 %) und Chlorhexidin (0,02 %), haben sich sowohl in der Monotherapie als auch in der Kombinationstherapie mit einem Diamidin26 wie Brolene (Propamidinisethionat und Dibrompropamidinisethionat) als wirksam erwiesen.8 Kationische Antiseptika sind starke Basen, deren Anti-Amöben-Potenzial auf ihrer Fähigkeit beruht, Zellen zu lysieren, indem sie sich an die Phospholipid-Doppelschicht binden und eine fatale Membranschädigung verursachen.27 Der Einsatz dieser Antiseptika hat sowohl bei AK-Patienten, die keine Kontaktlinsen tragen, als auch bei AK-Patienten, die Kontaktlinsen tragen, zu großen Verbesserungen geführt.8 Diamidine wirken, indem sie entweder den Methylgruppentransfer stören oder die Nukleinsäuren der Amöben direkt stören.28 Die stündliche Anwendung von 0,1 % Propamidinisethionat und 0,15 % Dibromopropamidin hat nur in den frühen Krankheitsstadien Erfolge gezeigt. Manchmal werden auch Kortikosteroide verschrieben, um die Entzündung und die Schmerzen zu lindern, doch können sie gleichzeitig die Pathogenität der Amöben erhöhen, indem sie die Immunantwort des Patienten unterdrücken.29
Die chirurgische Behandlung bleibt eine notwendige Option, wenn die Infektion über den Punkt hinaus fortgeschritten ist, an dem die Antiinfektiva nicht mehr wirken. Mit einer perforierenden Keratoplastik wird infiziertes Gewebe entfernt und ersetzt, und die Behandlung mit Antiseptika und Diamidin wird fortgesetzt.
Acanthamoeba-Keratitis ist eine seltene Krankheit, die, wenn sie unentdeckt bleibt, die Hornhaut und das vordere Gewebe dauerhaft schädigen kann, so dass der Patient auf einem oder beiden Augen blind wird. Die Gefahr einer AK sollte bei der Entscheidung, ob Kontaktlinsen getragen werden sollen oder nicht, sowie bei der Wahl des Linsentyps berücksichtigt werden. Die Bedeutung der richtigen Pflege von Kontaktlinsen kann gar nicht hoch genug eingeschätzt werden, denn sie ist ein sicherer Weg, um nicht nur eine Acanthamöbeninfektion, sondern auch eine Reihe anderer unangenehmer und häufigerer Infektionen zu verhindern. Die Sensibilisierung der Bevölkerung für die Gefahren, die mit der Entchlorung und der Lagerung von stehendem Wasser verbunden sind, die verstärkte Einführung richtiger Kontaktlinsengewohnheiten und eine sachkundige Diagnose sind die einzigen Möglichkeiten, Acanthamoeba wirksam zu behandeln und seine zunehmende Verbreitung zu stoppen.
Dr. Abelson, außerordentlicher klinischer Professor für Augenheilkunde an der Harvard Medical School und leitender klinischer Wissenschaftler am Schepens Eye Research Institute, ist Berater für ophthalmologische Arzneimittel. Herr Dewey-Mattia ist medizinischer Autor bei ORA Clinical Research and Development in North Andover, und Herr Shapiro ist Direktor für Antiinfektiva und Entzündungshemmer bei ORA.
1. Moore MB, McCulley JP, Luckenbach M, Gelender H, Newton C, McDonald MB, Visvesvara GS. Acanthamoeba-Keratitis in Verbindung mit weichen Kontaktlinsen. Am J Ophthalmol 1985;100:3:396.
2. Meier PA, Mathers WD, Sutphin JE, Folberg R, Hwang T, Wenzel RP. Eine Epidemie von mutmaßlicher Acanthamoeba-Keratitis, die auf eine regionale Überschwemmung folgte. Arch Ophthalmol 1998;116:8:1090-4.
3. Visvesvara GS, Moura H, Schuster FL. Pathogene und opportunistische freilebende Amöben: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea. FEMS Immunol Med Microbiol 2007;50:1-26.
4. Thebpatiphat N, Hammersmith KM, Rocha FN, Rapuano CJ, Ayres BD, Laibson PR, Eagle RC, Cohen EJ. Acanthamoeba-Keratitis: Ein Parasit auf dem Vormarsch. Cornea 2007;26:6:701-6.
5. Marciano-Cabral F, Cabral G. Acanthamoeba spp. as agents of disease in humans. Clin Microbiol Rev 2003;16:2:273-307.
6. Mazur T, Hadás E, Iwanicka I. The duration of the cyst stage and the viability and virulence of Acanthamoeba isolates. Trop Med and Parasitol 1995;46:2:106-8.
7. Schuster FL, Visvesvara GS. Freilebende Amöben als opportunistische und nicht-opportnistische Krankheitserreger von Mensch und Tier. Int J Parasitology 2004;34:9:1001-27.
8. Sharma S, Garg P, Rao GN. Patientencharakteristika, Diagnose und Behandlung der Acanthamoeba-Keratitis bei Nicht-Kontaktlinsen. Br J Ophthalmol 2000;84:1103-8.
9. Stehr-Green JK, Bailey TM, Brandt FH, Carr JH, Bond WW, Visvesvara GS. Acanthamoeba-Keratitis bei Trägern weicher Kontaktlinsen. Eine Fall-Kontroll-Studie. JAMA 1987;258:1:57-60.
10. Hiti K, Walochnik J, Haller-Schober EM, Faschinger C, Aspöck H. Viability of Acanthamoeba after exposure to a multipurpose disinfecting contact lens solution and two hydrogen peroxide systems. Br J Ophthalmol 2002;86:2:144-6.
11. Shoff ME, Joslin CE, Tu EY, Kubatko L, Fuerst PA. Wirksamkeit von Kontaktlinsensystemen gegen aktuelle klinische und Leitungswasser-Acanthamoeba-Isolate. Cornea 2008;27:6:713-9.
12. Joslin CE, Tu EY, McMahon TT, Passaro DJ, Stayner LT, Sugar J. Epidemiological characteristics of a Chicago-area Acanthamoeba keratitis outbreak. Am J Ophthalmol 2006;142:2:212-217.
13. Mathers W. Verwendung höherer Medikamentenkonzentrationen bei der Behandlung von Acanthamoeba-Keratitis. Arch Ophthalmol 2006;124:6:923.
14. Sansanayudh W, Cevallos V, Porco TC, Margolis TP, Lietman TM, Acharya NR. Fusarium and Acanthamoeba keratitis: Kann ein einzelnes Zentrum Ausbrüche erkennen? Br J Ophthalmol 2008;95:5:720-1.
15. Joslin CE, Tu EY, Shoff ME, Booton GC, Fuerst PA, Mchahon TT, Anderson RJ, Dworkin MS, Sugar J, Davis FG, Stayner LT. Der Zusammenhang zwischen der Verwendung von Kontaktlinsenlösungen und Acanthamoeba-Keratitis. Am J Ophthalmol 2007;144:2:169-180.
16. Butcko V, McMahon TT, Joslin CE, Jones L. Microbial keratitis and the role of rub and rinsing. Eye Contact Lens 2007;33:6:421-3.
17. Kilvington S, Gray T, Dart J, Morlet N, Beeching JR, Frazer DG, Matheson M. Acanthamoeba keratitis: Die Rolle des häuslichen Leitungswassers im Vereinigten Königreich. IOVS 2004;45:1:165-169.
18.Thomas PA, Geraldine P. Infectious keratitis. Curr Opin Infect Dis 2007;20:2:129-41.
19.Alizadeth H, Neelam S, Hurt M, Niederkorn JY. Die Rolle des Kontaktlinsentragens, der bakteriellen Flora und der Mannose-induzierten pathogenen Protease in der Pathogenese der Amöbenkeratitis. Infect Immun 2005;73:2:1061-8.
20.Watt K, Swarbrick HA. Microbial keratitis in overnight orthokeratology: Review of the first 50 cases. Eye Contact Lens 2005;31:5:201-8.
21. Hammersmith KM. Diagnose und Behandlung der Acanthamoeba-Keratitis. Curr Opin Ophthalmol 2006;17:4:327-31.
22. Lam DS, Houang E, Fan DS, Lyon D, Seal D, Wong E; Hong Kong Microbial Keratitis Study Group. Inzidenz und Risikofaktoren für mikrobielle Keratitis in Hongkong: Vergleich mit Europa und Nordamerika. Eye 2002;16:5:608-18.
23. Siegel DV. Acanthamoeba keratitis update – incidence, molecular epidemiology and new drugs for treatment. Eye 2003;17:8:893-905.
24. Tu EY, Joslin CE, Sugar J, Booton GC, Shoff ME, Fuerst PA. Der relative Wert von konfokaler Mikroskopie und oberflächlichen Hornhautabstrichen bei der Diagnose von Acanthamoeba-Keratitis. Cornea 2008;27:7:764-72.
25. Gupta N, Tandom R. Investigative modalities in infectious keratitis. Indian Journal of Ophthalmology 2008;56:3:209-1.3
26. Wright P, Warhurst D, Jones BR. Acanthamoeba-Keratitis erfolgreich medikamentös behandelt. Br J Ophthalmol 1985;69:778-782.
27. Lim N, Goh D, Bunce C, Xing W, Fraenkel G, Poole TRG, Ficker L. Comparison of polyhexamethylene biguanide and chlorhexidine as monotherapy agents in the treatment of Acanthamoeba keratitis. Amer J Ophthalmol 2008;145:130.
28. Wysenbeek YS, Blank-Porat D, Harizman N, Wygnanski-Jaffe T, Keller N, Avni I. The reculture technique: Individualisierung der Behandlung von Acanthamoeba-Keratitis. Cornea 2000;19:4:464-7.
29. Berger ST, Mondino BJ, Hoft RH, Donzis PB, Holland GN, Farley MK, Levenson JE, Successful medical management of Acanthamoeba keratitis. Amer J Ophthalmol 1990;110:4:395-403.