Mark B. Abelson, MD, CM FRCSC, Daniel Dewey-Mattia, and Aron Shapiro, North Andover, Mass.
Acanthamoeba keratitis is een zeldzame, het gezichtsvermogen bedreigende ziekte die in de Verenigde Staten en Europa voornamelijk voorkomt bij contactlensdragers.1,2 De aandoening wordt veroorzaakt door infectie van de protozoa Acanthamoeba en wordt vaak verkeerdelijk geïdentificeerd als een van de meer voorkomende schimmel- of virale vormen van keratitis, in het bijzonder oculaire herpes.3 Trauma aan het hoornvlies door een ongeval, dat vaker voorkomt in ontwikkelingslanden, en het dragen van contactlenzen zijn de belangrijkste risicofactoren voor AK. Behandelingsmethoden zijn het meest succesvol in een vroeg stadium, dus een snelle diagnose is van cruciaal belang om de progressie van de ziekte een halt toe te roepen. Patiënten in een later stadium worden vaak geconfronteerd met een hoornvliestransplantatie als hun enige manier om een gezichtsscherpte terug te krijgen die meer is dan alleen handbewegingen;4 daarom moet AK een belangrijk punt van zorg zijn bij contactlensdragers en personen die recent chirurgische of accidentele hoornvliesschaafwonden hebben opgelopen. Preventie is het beste wapen tegen AK, aangezien de meeste gevallen direct kunnen worden toegeschreven aan slechte contactlenshygiëne of direct oogcontact met besmet water.
Acanthamoeba Ecologie
Acanthamoeba is een van de talrijkste protozoa op aarde. Leden van het geslacht Acanthamoeba zijn bijna alomtegenwoordig en zijn geïsoleerd uit aarde, stof, lucht, behandeld en onbehandeld leidingwater, zwembaden, airconditioninginstallaties en tal van andere huishoudelijke en buitenmilieus.5 De levenscyclus van de protozoa bestaat uit een actieve, zich voedende trofozoietfase en een slapende cystefase, die wordt geactiveerd door ongunstige omstandigheden, zoals blootstelling aan extreme temperatuur, hoge of lage pH, droogte of verhongering.5 De veerkracht om ongunstige omstandigheden te weerstaan (cysten kunnen 24 jaar of langer levensvatbaar blijven)6 geeft Acanthamoeba een breed ecologisch bereik en maakt het ook tot een geduchte parasiet bij de mens.
Omdat Acanthamoeba zo wijdverbreid is in onze omgeving, is het verrassend dat infecties zo zeldzaam zijn. Het is niet bekend hoe ons immuunsysteem ons beschermt tegen infectie, hoewel er Acanthamoeba-specifieke antilichamen zijn ontdekt bij mensen.3 Er zijn sporen van Acanthamoeba gevonden in long- en neusweefsel van zowel zieke als gezonde mensen7 en als opportunistische ziekteverwekker is bekend dat Acanthamoeba fatale encefalitis kan veroorzaken bij immuungecompromitteerde patiënten.5 Bij AK treedt de infectie echter meestal op bij immuunincompetente personen, hoewel sommige onderzoeken suggereren dat sommige AK-patiënten vatbaar zijn voor de ziekteverwekker door een gebrek aan antigeenspecifieke antilichamen.3
Amoebische keratitis
Vanaf 2006 zijn er in de Verenigde Staten naar schatting 5.000 gevallen van Acanthamoeba keratitis geweest, maar aangezien AK zo vaak verkeerd wordt gediagnosticeerd en de ziekte niet hoeft te worden gemeld bij de Centers for Disease Control and Prevention, zou het werkelijke aantal veel hoger kunnen liggen.3 In ontwikkelingslanden in Azië en Afrika, waar AK gewoonlijk niet in verband wordt gebracht met het dragen van lenzen, is het aantal gevallen van infectieuze keratitis uitzonderlijk hoog. Eén onderzoek onder patiënten in India die geen contactlenzen droegen, meldde een zeer slecht visueel eindresultaat in vergelijking met eerder onderzoek onder lensdragers in Westerse landen.8 Dit kan te wijten zijn aan variatie tussen geografisch verschillende Acanthamoeba-stammen of louter aan de lagere sociaaleconomische status en het gebrek aan medische middelen waarover de deelnemers aan het onderzoek beschikten.8
AK werd voor het eerst gedocumenteerd in de Verenigde Staten in 1973, nadat een boer zijn hoornvlies had bekrast met ijzerdraad en hooi en de wond vervolgens had uitgespoeld met irrigatiewater.5 Diagnostische en klinische informatie over de ziekte bleef schaars tot de jaren 1980; onderzoek begon echter uit te wijzen dat het dragen van contactlenzen de belangrijkste risicofactor is. Van de 208 gevallen van AK die tussen 1973 en 1988 in de Verenigde Staten gerapporteerd werden, was 85 procent contactlensdrager.9 De eerste gedocumenteerde gevallen van lens-gerelateerde AK werden uitsluitend gevonden bij personen die hun contactlenzen in zelfgemaakte zoutoplossingen op basis van keukenzout bewaarden.9 Sindsdien zijn er infecties aangetroffen bij lensdragers die in de winkel gekochte multifunctionele oplossingen en desinfecterende middelen gebruiken, waarvan de meeste effectief de trofozoieten van Acanthamoeba doden, maar niet de cysten.10
In het midden van de jaren negentig was er in de Verenigde Staten een piek in het aantal lens-gerelateerde AK-gevallen, vooral bij bepaalde bevolkingsgroepen. Tussen juli 1993 en december 1994 leidde een uitbraak tot 43 gevallen in de ziekenhuizen en klinieken van de Universiteit van Iowa.11 Aangenomen werd dat de epidemie verband hield met regionale overstromingen en de daaropvolgende besmetting van de watervoorziening, aangezien 29 van de 30 patiënten in een studie in door overstromingen getroffen districten woonden.2 Ook in de omgeving van Chicago is het aantal AK-gevallen sinds juni 2003 aanzienlijk gestegen, met 63 gemelde gevallen tegen eind 200611 onder een bevolking die naar verwachting slechts ongeveer twee gevallen per jaar zou hebben.12 Het aantal AK-patiënten is ook toegenomen in Portland,13 San Francisco,14 Boston4 en Philadelphia.4 Epidemiologisch onderzoek wees uit dat ongeveer de helft van alle AK-patiënten in de regio Chicago de “no-rub”-oplossing Complete Moisture Plus Multi-Purpose (Advanced Medical Optics) had gebruikt voor het reinigen en bewaren van hun contactlenzen.15 Deze bevinding leidde tot een onderzoek door de U.S. Food and Drug Administration en een vrijwillige terugroeping door AMO. Onderzoek naar commerciële “no-rub”-contactoplossingen heeft aangetoond dat deze producten een minimale doeltreffendheid hebben bij het doden van Acanthamoeba.16 Zowel eenstaps- als tweestaps-waterstofperoxideoplossingen, waarbij een tweede neutraliserende oplossing wordt gebruikt, blijken een veiliger alternatief te zijn voor een “no-rub”-opslagoplossing.10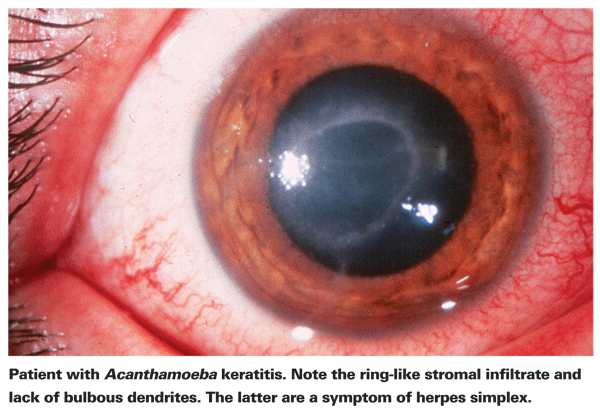
Studies beginnen aan te tonen dat de opslag en behandeling van water in de gemeenschap ook een grote rol kunnen spelen bij AK-uitbraken. In Engeland, waar AK 15 keer zo vaak voorkomt als in de Verenigde Staten, kunnen watertanks op daken, die niet vaak worden schoongespoeld, uitstekend dienen als voedingsbodem voor Acanthamoeba en een verklaring vormen voor de hoge AK-percentages in dat land.17 Uit onderzoek na de uitbraak in de regio Chicago bleek niet alleen dat de toename van AK samenviel met een verlaging van de chloorbehandeling van het stadswater als gevolg van een mandaat van het Environmental Protection Agency met betrekking tot kankerverwekkende bijproducten, maar ook dat de uitzonderlijk lange afstanden waarover het stadswater in het gebied wordt vervoerd, wellicht tijd hebben geboden voor extra dechlorering en kolonisatie van Acanthamoeba.12 Hoewel veel waterbehandelingsprocedures niet effectief zijn in het vernietigen van cysten, vernietigen ontsmettingsmiddelen zoals chloor wel effectief de vrije trofozoieten en remmen ze de groei en reproductie van protozoën.12
Contactslijtage en hoornvliesscheur
Corneaal trauma, oogchirurgie en contactlensgebruik zijn allemaal risicofactoren voor de ontwikkeling van infectieuze keratitis.17 Wanneer de epitheliale laag van het hoornvlies beschadigd is, blijft het vatbaar voor infectie door schimmels, bacteriën of protozoa.18 Vóór het wijdverbreide gebruik van contactlenzen waren schaafwonden aan het hoornvlies en blootstelling aan besmet water of verontreinigde grond de meest opvallende risicofactoren voor AK.
Contactlenzen kunnen Acanthamoeba helpen het hoornvlies te bereiken en de progressie van de ziekte te verergeren. De lenzen fungeren als een fysieke doorgangsroute van een besmette bron (d.w.z. lenshouder of kraanwater) rechtstreeks naar het hoornvlies. Lenzen, vooral wanneer ze verkeerd of langer dan aanbevolen worden gedragen, eroderen het hoornvliesepitheel, waardoor microben kunnen binnendringen.19
Het dragen van lenzen wordt ook geassocieerd met een toename van gemannosyleerde receptoreiwitten op het epitheliale oppervlak die Acanthamoeba’s vermogen om het hoornvliesweefsel weg te eten, vergroten.19 Biofilms en afzettingen van gemannosyleerde eiwitten die zich op het lensoppervlak ophopen, zorgen ervoor dat trofozoieten verhoogde hoeveelheden epitheliale apoptose mediatoren en proteasen produceren die de matrix van het hoornvlies afbreken.19
De gevoeligheid voor Acanthamoeba-infectie hangt ook af van het type contactlens dat een persoon gebruikt. Nachtlenzen geven gebruikers een drastisch hoger risico op het ontwikkelen van AK, aangezien in een onderzoek een prevalentie van 30 procent werd gevonden.20 Terwijl daglenzen het type lens zijn dat de minste kans op infectie geeft,21 hebben mensen die harde lenzen dragen minder kans op AK dan gebruikers van zachte lenzen.22 Ongeveer 88 procent van de gevallen van contactlensgerelateerde AK doet zich voor bij dragers van zachte contactlenzen en 12 procent bij dragers van harde lenzen.23 De steeds populairder wordende silicone-hydrogel-lenzen voor continu gebruik zijn ook een gemakkelijker doelwit voor Acanthamoeba-aanhechting dan conventionele hydrogels.21
Clinische tekenen en symptomen
Lijders aan AK klagen doorgaans over roodheid, pijn, verminderde gezichtsscherpte en gevoeligheid voor licht.5 Het meest kenmerkende klinische kenmerk van AK is een uitgesproken ringvormig stromaal infiltraat, waarvan wordt aangenomen dat het bestaat uit ontstekingscellen.5 Tekenen van scleritis, hoornvliesontsteking en conjunctivale hyperemie beginnen zich te manifesteren naarmate de ziekte vordert.5 Indien onbehandeld, kan Acanthamoeba zich verder verspreiden naar het netvlies en ernstige chorioretinitis veroorzaken,5 en patiënten worden in deze latere stadia vaak gereduceerd tot een gezichtsscherpte van handbewegingen of blindheid. Late diagnose, een uitgesproken ringinfiltraat en diepe stromale infectie zijn alle geassocieerd met een slechter visueel eindresultaat.24 Patiënten die stromale keratitis ontwikkelen hebben ook meer kans op een slecht visueel resultaat na behandeling dan patiënten met een meer oppervlakkige epitheliale infectie.4
Diagnose
Een juiste diagnose in een vroeg stadium is essentieel voordat de Acanthamoeba dieper in het hoornvlies binnendringt en blijvende weefselschade veroorzaakt. Helaas wordt de ziekte bij het eerste bezoek vaker gediagnosticeerd als herpes simplex keratitis dan als AK. Deze verkeerde identificatie kan leiden tot het gebruik van antivirale medicatie, wat de symptomen voor de patiënt alleen maar verergert. Bij de diagnose wordt Acanthamoeba vaak als infectieoorzaak beschouwd wanneer de hoornvlieszweren niet reageren op antibiotica. Dit uitstel van de juiste diagnose geeft de parasiet ruim de tijd om zich verder in het oog te verspreiden.
De eerste stap naar een juiste diagnose is nauwkeurig spleetlamponderzoek. De spleetlamp kan bewijzen van Acanthamoeba aantonen door de directe aanwezigheid ervan of door de bijbehorende immuunrespons.24 Het ontbreken van bolvormige dendrieten die typisch zijn voor herpespatiënten is een goede indicatie dat een patiënt AK zou kunnen hebben. Vroeg en nauwkeurig spleetlamponderzoek is belangrijk bij patiënten met een ulcus cornea, aangezien het ziektestadium op het moment van de diagnose AK een sterke voorspeller is van het uiteindelijke visuele resultaat.24
Wanneer beschikbaar, kan directe in-vivo diagnose worden uitgevoerd met behulp van een geavanceerde tandem scanning confocale microscoop en Heidelberg retina tomograph II (HRT-II) met corneamodule.7 Polymerasekettingreactie kan ook worden gebruikt als diagnostisch hulpmiddel wanneer er te weinig cellen beschikbaar zijn voor een nauwkeurige visuele bepaling.5 Als in-vivo-onderzoek en PCR niet haalbaar zijn, kan het kweken van corneaschraapsel een hulpmiddel van onschatbare waarde zijn bij de diagnose van Acanthamoeba en het onderscheiden van oculaire herpes.
Corneaschraapsel met een kaliumhydroxide nat-mount preparaat moet worden gebruikt als microscopisch onderzoek mogelijk is.25 Aanvullende schraapsel moeten worden uitgevoerd met steriele apparatuur totdat er voldoende materiaal is voor kweekplaten. Monsters moeten worden geïncubeerd bij ongeveer 37 C op een niet-nutriente agarplaat gecoat met Escherichia coli.24 Binnen enkele dagen zal een positieve kweek bedekt zijn met Acanthamoeba die zich voedt op de bacteriële overlay.3
Behandeling
Acanthamoeba is moeilijk te behandelen, maar een effectieve behandeling kan voorkomen dat een patiënt blind wordt aan (ten minste) één oog. Topische anti-infectiemiddelen werken meestal alleen bij patiënten in een vroeg stadium, terwijl in latere stadia chirurgisch ingrijpen noodzakelijk is. In 1985 werd de eerste succesvolle behandeling van AK gemeld met het gebruik van propamidine 0,1% en neomycine 1%.26 Sindsdien is combinatietherapie de basis van de behandeling gebleven, met toepassing van twee of meer topische anti-amoebica gedurende de dag.
Effectieve kationische antiseptica, met name polyhexamethyleen biguanide (PHMB, 0,02%) en chloorhexidine (0,02%), zijn effectief gebleken bij zowel monotherapie als combinatietherapie met een diamidine26 zoals Brolene (propamidine-isethionaat en dibroompropamidine-isethionaat).8 Kationische antiseptica zijn sterke basen waarvan het anti-amoebisch potentieel voortkomt uit hun vermogen om cellen te lyseren door zich te binden aan de fosfolipide bilaag en fatale membraanschade te veroorzaken.27 Het gebruik van deze antiseptica heeft grote verbeteringen gebracht bij zowel contactlensloze als contactlensdragende AK patiënten.8 Diamidines werken door ofwel de overdracht van de methylgroep te verstoren of direct de amoebische nucleïnezuren te verstoren.28 Uurlijkse toepassing van 0,1% propamidine-isethionaat en 0,15% dibroompropamidine heeft alleen in de vroege stadia van de ziekte succes gehad. Corticosteroïden worden soms ook voorgeschreven om de ontsteking en pijn te verminderen, maar kunnen tegelijkertijd de pathogeniteit van de amoeben verhogen door de immuunrespons van de patiënt te onderdrukken.29
Chirurgische behandeling blijft een noodzakelijke optie wanneer de infectie verder is gevorderd dan het punt van levensvatbaarheid met anti-infectiemiddelen. Penetrerende keratoplastiek wordt gebruikt om geïnfecteerd weefsel te verwijderen en te vervangen, en een antiseptische/diamidineregime wordt voortgezet.
Acanthamoeba keratitis is een zeldzame ziekte die, indien onopgemerkt, permanente schade kan toebrengen aan het hoornvlies en de voorste weefsels, waardoor de patiënt blind kan worden aan een of beide ogen. Het gevaar van AK moet in overweging worden genomen bij de beslissing om al dan niet contactlenzen te gebruiken, en ook bij de beslissing welk type lens te gebruiken. Het belang van een goede lensverzorging kan niet genoeg worden benadrukt, omdat het een trefzekere manier is om niet alleen een Acanthamoeba-infectie te voorkomen, maar ook een hele reeks andere onaangename en meer voorkomende infecties. Gemeenschapsbewustzijn van de gevaren die verbonden zijn aan dechlorering en de opslag van stilstaand water, meer wijdverspreide adoptie van de juiste contactlensgewoonten, en deskundige diagnose zijn de enige manieren om Acanthamoeba effectief te behandelen en de toenemende prevalentie ervan een halt toe te roepen.
Dr. Abelson, universitair hoofddocent oogheelkunde aan de Harvard Medical School en senior klinisch wetenschapper aan het Schepens Eye Research Institute, adviseert op het gebied van oogheelkundige farmaceutica. Mr. Dewey-Mattia is een medisch schrijver bij ORA Clinical Research and Development in North Andover, en Mr. Shapiro is directeur van anti-infectiva en anti-inflammatoire middelen bij ORA.
1. Moore MB, McCulley JP, Luckenbach M, Gelender H, Newton C, McDonald MB, Visvesvara GS. Acanthamoeba keratitis geassocieerd met zachte contactlenzen. Am J Ophthalmol 1985;100:3:396.
2. Meier PA, Mathers WD, Sutphin JE, Folberg R, Hwang T, Wenzel RP. Een epidemie van vermoedelijke Acanthamoeba keratitis die volgde op een regionale overstroming. Arch Ophthalmol 1998;116:8:1090-4.
3. Visvesvara GS, Moura H, Schuster FL. Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea. FEMS Immunol Med Microbiol 2007;50:1-26.
4. Thebpatiphat N, Hammersmith KM, Rocha FN, Rapuano CJ, Ayres BD, Laibson PR, Eagle RC, Cohen EJ. Acanthamoeba keratitis: Een parasiet in opmars. Cornea 2007;26:6:701-6.
5. Marciano-Cabral F, Cabral G. Acanthamoeba spp. als verwekkers van ziekte bij de mens. Clin Microbiol Rev 2003;16:2:273-307.
6. Mazur T, Hadás E, Iwanicka I. De duur van het cystestadium en de levensvatbaarheid en virulentie van Acanthamoeba-isolaten. Trop Med and Parasitol 1995;46:2:106-8.
7. Schuster FL, Visvesvara GS. Free-living amoebae as opportunistic and non-opportnistic pathogens of humans and animals. Int J Parasitology 2004;34:9:1001-27.
8. Sharma S, Garg P, Rao GN. Patient characteristics, diagnosis, and treatment of non-contact lens related Acanthamoeba keratitis. Br J Ophthalmol 2000;84:1103-8.
9. Stehr-Green JK, Bailey TM, Brandt FH, Carr JH, Bond WW, Visvesvara GS. Acanthamoeba keratitis in dragers van zachte contactlenzen. Een case-control studie. JAMA 1987;258:1:57-60.
10. Hiti K, Walochnik J, Haller-Schober EM, Faschinger C, Aspöck H. Viability of Acanthamoeba after exposure to a multipurpose disinfecting contact lens solution and two hydrogen peroxide systems. Br J Ophthalmol 2002;86:2:144-6.
11. Shoff ME, Joslin CE, Tu EY, Kubatko L, Fuerst PA. Efficacy of contact lens systems against recent clinical and tapwater Acanthamoeba isolates. Cornea 2008;27:6:713-9.
12. Joslin CE, Tu EY, McMahon TT, Passaro DJ, Stayner LT, Sugar J. Epidemiological characteristics of a Chicago-area Acanthamoeba keratitis outbreak. Am J Ophthalmol 2006;142:2:212-217.
13. Mathers W. Use of higher medication concentrations in the treatment of Acanthamoeba keratitis. Arch Ophthalmol 2006;124:6:923.
14. Sansanayudh W, Cevallos V, Porco TC, Margolis TP, Lietman TM, Acharya NR. Fusarium en Acanthamoeba keratitis: Kan een enkel centrum uitbraken opsporen? Br J Ophthalmol 2008;95:5:720-1.
15. Joslin CE, Tu EY, Shoff ME, Booton GC, Fuerst PA, Mchahon TT, Anderson RJ, Dworkin MS, Sugar J, Davis FG, Stayner LT. Het verband tussen het gebruik van contactlensvloeistof en Acanthamoeba keratitis. Am J Ophthalmol 2007;144:2:169-180.
16. Butcko V, McMahon TT, Joslin CE, Jones L. Microbiële keratitis en de rol van wrijven en spoelen. Eye Contact Lens 2007;33:6:421-3.
17. Kilvington S, Gray T, Dart J, Morlet N, Beeching JR, Frazer DG, Matheson M. Acanthamoeba keratitis: De rol van huishoudelijk kraanwater in het Verenigd Koninkrijk. IOVS 2004;45:1:165-169.
18.Thomas PA, Geraldine P. Infectious keratitis. Curr Opin Infect Dis 2007;20:2:129-41.
19.Alizadeth H, Neelam S, Hurt M, Niederkorn JY. Role of contact lens wear, bacterial flora, and mannose-induced pathogenic protease in the pathogenesis of amoebic keratitis. Infect Immun 2005;73:2:1061-8.
20.Watt K, Swarbrick HA. Microbiële keratitis bij nachtelijke orthokeratologie: Review of the first 50 cases. Eye Contact Lens 2005;31:5:201-8.
21. Hammersmith KM. Diagnose en behandeling van Acanthamoeba keratitis. Curr Opin Ophthalmol 2006;17:4:327-31.
22. Lam DS, Houang E, Fan DS, Lyon D, Seal D, Wong E; Hong Kong Microbial Keratitis Study Group. Incidentie en risicofactoren voor microbiële keratitis in Hong Kong: Vergelijking met Europa en Noord-Amerika. Eye 2002;16:5:608-18.
23. Zegel DV. Acanthamoeba keratitis update – incidentie, moleculaire epidemiologie en nieuwe geneesmiddelen voor behandeling. Eye 2003;17:8:893-905.
24. Tu EY, Joslin CE, Sugar J, Booton GC, Shoff ME, Fuerst PA. The relative value of confocal microscopy and superficial corneal scrapings in the diagnosis of Acanthamoeba keratitis. Cornea 2008;27:7:764-72.
25. Gupta N, Tandom R. Investigative modalities in infectious keratitis. Indian Journal of Ophthalmology 2008;56:3:209-1.3
26. Wright P, Warhurst D, Jones BR. Acanthamoeba keratitis succesvol medisch behandeld. Br J Ophthalmol 1985;69:778-782.
27. Lim N, Goh D, Bunce C, Xing W, Fraenkel G, Poole TRG, Ficker L. Comparison of polyhexamethylene biguanide and chlorhexidine as monotherapy agents in the treatment of Acanthamoeba keratitis. Amer J Ophthalmol 2008;145:130.
28. Wysenbeek YS, Blank-Porat D, Harizman N, Wygnanski-Jaffe T, Keller N, Avni I. De recultuurtechniek: Individualisering van de behandeling van acanthamoeba keratitis. Cornea 2000;19:4:464-7.
29. Berger ST, Mondino BJ, Hoft RH, Donzis PB, Holland GN, Farley MK, Levenson JE, Successful medical management of Acanthamoeba keratitis. Amer J Ophthalmol 1990;110:4:395-403.