 Ammoniakki vahingoittaa vesieliöitä jo erittäin pieninä pitoisuuksina. Ammoniakkia esiintyy luonnollisesti ympäristössä. Pieni määrä ammoniakkia syntyy salaman iskiessä ja pääsee sateessa maahan. Suurimman osan ammoniakista tuottavat kuitenkin bakteerit vedessä ja maaperässä kasvien ja eläinten jätteiden hajoamisen lopputuotteena. Ammoniakkia esiintyy suhteellisen pieninä, ei-myrkyllisinä pitoisuuksina maaperässä, ilmassa ja vedessä, ja se on kasvien typen lähde.
Ammoniakki vahingoittaa vesieliöitä jo erittäin pieninä pitoisuuksina. Ammoniakkia esiintyy luonnollisesti ympäristössä. Pieni määrä ammoniakkia syntyy salaman iskiessä ja pääsee sateessa maahan. Suurimman osan ammoniakista tuottavat kuitenkin bakteerit vedessä ja maaperässä kasvien ja eläinten jätteiden hajoamisen lopputuotteena. Ammoniakkia esiintyy suhteellisen pieninä, ei-myrkyllisinä pitoisuuksina maaperässä, ilmassa ja vedessä, ja se on kasvien typen lähde.Maaperässä ja vedessä ammoniakki käy läpi monia monimutkaisia biokemiallisia muunnoksia. Nämä muunnokset muodostavat sen, mitä yleisesti kutsutaan typen kierroksi. Typpikiertoa käsitellään perusteellisemmin asiaan liittyvissä linkeissä.
Ammoniakki vedessä
Vesi reagoi ammoniakin kanssa muodostaen ammonium- ja hydroksidi-ioneja. Ammoniakista käytetään usein nimitystä ”yhdistynyt ammoniakki”. Ammoniakki on myrkyllistä vesieliöille, mutta ammonium ei ole myrkyllistä. Vedessä vallitsee tasapaino myrkyllisen ammoniakin ja myrkyttömän ammoniumin välillä. Tasapaino siirtyy edestakaisin olemassa olevien tai käyttöön otettujen ympäristömuutosten mukaan
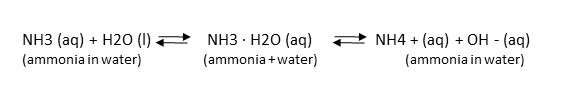
NH3:n ja NH4+:n väliseen dynaamiseen tasapainoon vaikuttavat veden lämpötila ja pH (happamuus). Kun pH on kuusi, ammoniakin ja ammoniumin suhde on 1:3000, mutta se laskee 1:30:een, kun pH nousee kahdeksaan (muuttuu vähemmän happamaksi). Lämmin vesi sisältää enemmän myrkyllistä ammoniakkia kuin viileämpi vesi. Kun vedestä otetaan näytteitä ammoniakkianalyysiä varten, sekä pintavesimuodostuman lämpötila että pH on mitattava samaan aikaan, kun vesinäytteet otetaan. (Katso Ammoniakki, pH & Lämpötilalaskuri)
Jos ammoniakkia valuu suoraan pintaveteen tai jos palokunnan ammoniakkihöyrypilven vaimentamiseen käyttämä vesi pääsee pintaveteen, vesieliöille voi aiheutua haittaa. Jopa pitoisuus 0,02 mg/l (48 tunnin LC50) unionoitu ammoniakki on tappava joillekin herkille makean veden kaloille. Tämä vastaa noin ½ kupillista unionoitua ammoniakkia miljoonassa gallonassa vettä. Ammoniakki on myös erittäin myrkyllistä makean veden selkärangattomille, sillä 48 tunnin LC50-arvo on 0,66 mg/l Daphnia magna -lajille. Tässäkään tapauksessa lannoiteammoniakin saastuttamaa vettä ei saa päästää sadevesiviemäreihin, jokiin, ojiin, kosteikkoihin tai järviin.
Ammoniakki ilmassa ja maaperässä
Ammoniakin vapautumisen jälkeen höyryt haihtuvat ja reagoivat ilman kosteuden kanssa muodostaen ammoniumia, ja lopulta ne palaavat maahan sateen mukana. Ammonium sitoutuu sitten nopeasti negatiivisesti varautuneeseen maaperän orgaaniseen ainekseen ja maaperän saviin. Ammonium kertyy maaperään harvoin, koska bakteerit muuttavat nopeasti nitraateiksi (nitrifikaatio) sen ammoniumin, jota kasvien juuret eivät ota vastaan. Nitraatit voivat myös imeytyä juuriin tai huuhtoutua maaprofiilin läpi. Koska ammonium on maaperään sitoutunutta, ellei sadetapahtumat huuhtele maaperää pois, saastuminen todennäköisesti pysyy paikallaan horisontaalisesti, mutta huuhtoutuu vertikaalisesti nitraatteina juuristovyöhykkeen kautta.
Jos palokunta tukahduttaa ammoniakkihöyrypilveä vedellä pitkän aikaa, levitetty vesi voi saastuttaa maaperän. Tällöin maaperä saattaa vaatia jonkinlaista kunnostusmenetelmää haitallisten ympäristövaikutusten estämiseksi.
Ammoniakin vaikutus kasveihin

Kasvit, puut ja viljelykasvit koostuvat pääasiassa vedestä. Jos tapahtuu suuri ammoniakkipäästö, höyry todennäköisesti polttaa läheisen myötätuulen kasvillisuuden lehdet. Ammoniakki imee vettä lehdistä, mutta ei vaikuta juuriin, joten vahingoittuneet kasvit todennäköisesti toipuvat täysin, vaikka vahingoittuneet viljelykasvit saattavat kärsiä sadonmenetyksestä.
Ammoniakin vaikutus kotieläimiin
Ole tietoinen siitä, että ammoniakkihöyryt ovat myrkyllisiä kotieläimille. Maito-, sika- ja siipikarjatuottajille, jotka toimivat päästön tai mahdollisen päästön läheisyydessä tai myötätuulen suunnassa, on ilmoitettava, jotta he voivat ryhtyä asianmukaisiin toimiin.
The Nitrogen Cycle in Soil (Typpikierto maaperässä) Ohion osavaltionyliopiston neuvontapalvelun tiedotuslehdestä AEX-463-96
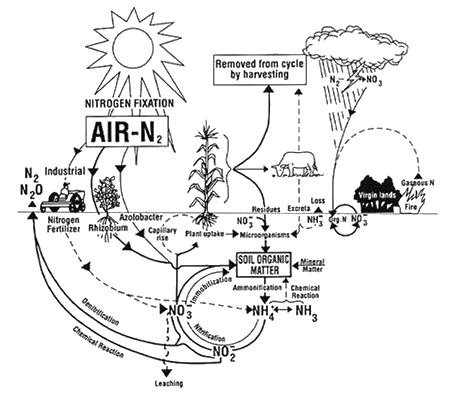

.