Litiumoxid Kemiska egenskaper, användning, produktion
Kemiska egenskaper
Litiumoxid (Li2O) är en av de enklaste jonoxiderna och är isoelektronisk till H2O. Två litiumatomer ger vardera en elektron till syreatomen och bildar en jonisk bindning mellan litium och syre. Formeln för litiumoxid är Li2O.
Litiumoxid är mycket frätande. Den reagerar med vatten och bildar litiumhydroxid. Den är giftig på grund av sin starka alkalinitet (är en bas).
Det är en mycket olöslig termiskt stabil litiumkälla som lämpar sig för glas, optik och keramiska tillämpningar. Litiumoxid är ett vitt fast ämne även känt som lithia, det bildas när litiummetall brinner i närvaro av syre. Oxidföreningar är inte elektriskt ledande. Vissa perovskitstrukturerade oxider är dock elektriskt ledande och kan användas som katod i fastoxidbränsleceller och syregenereringssystem. De är föreningar som innehåller minst en syreanjon och en metallkatjon.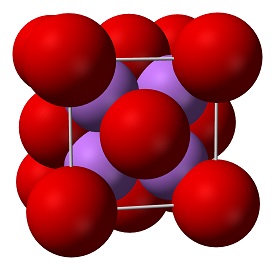
Litiumoxid används som flussmedel i keramiska glasyrer och skapar blått med koppar och rosa med kobolt. Litiumoxid reagerar med vatten och ånga och bildar litiumhydroxid och bör isoleras från dem. Dess användning undersöks också för oförstörande emissionsspektroskopisk utvärdering och övervakning av nedbrytning i beläggningssystem med termisk barriär. Den kan tillsättas som en co-dopant tillsammans med yttriumoxid i den keramiska toppbeläggningen av zirkoniumoxid, utan att beläggningens förväntade livslängd minskar i någon större utsträckning.
Användningar
Det finns inga aktuella industriella användningsområden som förbrukar stora mängder litiumoxid.
Litiumoxid används som flussmedel i keramiska glasyrer; och skapar blått med koppar och rosa med kobolt. Litiumoxid reagerar med vatten och ånga och bildar litiumhydroxid och bör isoleras från dem.Dess användning undersöks också för icke-destruktiv emissionsspektroskopisk utvärdering och övervakning av nedbrytning i beläggningssystem med termisk barriär. Den kan tillsättas som en co-dopant tillsammans med yttriumoxid i den keramiska toppbeläggningen av zirkoniumoxid, utan att den förväntade livslängden för beläggningen minskar i någon större utsträckning.
Reaktioner
Litiumoxid reagerar med vatten när den löser sig och bildar en lösning av litiumhydroxid.
Litiumoxid är en stark bas och reagerar typiskt med sura gaser och vätskor för att bilda litiumsalter. Vid förhöjda temperaturer reagerar litiumoxid också med många fasta icke-metalloxider (SiO2, B2O3 osv.) och metalloxider (A12O3, Fe2O3 osv.). Reaktioner vid höga temperaturer ligger till grund för litiumoxidens, litiumhydroxidens och litiumkarbonatets flussande verkan. Försiktighet måste iakttas för att undvika att litiumoxid reagerar med reaktionskärl vid höga temperaturer.
Förberedelse
Litiumoxid framställs genom upphettning av litiummetall i torrt syre över 100°C:
4Li + O2→2Li2O
En annan framställningsmetod som ger ren litiumoxid innebär termisk nedbrytning av litiumperoxid:
2Li2O2→2Li2O + O2
Och oxiden kan framställas genom upphettning av ren litiumhydroxid vid 800°C i vakuum:
2LiOH→Li2O + H2O
Hälsofara
Såvitt vi vet har de kemiska, fysikaliska och toxikologiska egenskaperna hos litiumoxid inte undersökts och rapporterats grundligt.
Toxiciteten hos litiumföreningar är en funktion av deras löslighet i vatten. Litiumjonen har toxicitet för det centrala nervsystemet. De första effekterna av litiumexponering är skakningar i händerna, illamående, miktion, slentrianmässigt tal, tröghet, sömnighet, svindel, törst och ökad urinvolym. Effekter av fortsatt exponering är apati, anorexi, trötthet, letargi, muskelsvaghet och förändringar i ekg. Långvarig exponering leder till hypotyreos, leukocytos, ödem, viktökning, polydipsi/polyuri (ökat vattenintag som leder till ökad urinproduktion), minnesstörningar, kramper, njurskador, chock, hypotoni, hjärtrytmrubbningar, koma, död.
Kemiska egenskaper
Finfördelat vitt pulver eller skorpigt material; absorberar lätt CO2 och H2O från atmosfären; framställs genom upphettning av LiOH till ~800°C i vakuum eller genom termisk nedbrytning av litiumperoxid; används i keramik och speciella glasformuleringar och i litiumvärmebatterier
Användningsområden
Litiumoxid är en stark alkali som absorberar koldioxid och vatten från atmosfären. Den används vid tillverkning av keramik och speciella typer av glas.
Användningar
Keramik och speciella glasformuleringar, koldioxidabsorberande
Preparat
Industriella preparat och laboratoriepreparat. Endast små volymer av materialet bereds industriellt. Både industri- och laboratorieberedningar kräver termisk nedbrytning av litiumperoxid eller litiumhydroxid.
Litiumperoxid, Li202 , omvandlas till litiumoxid, Li20 , och syre genom upphettning till 450° i en ström av heliumgas.
Termisk dehydrering av litiumhydroxid utförs vid 675°C±10° under vakuum i en nickelbehållare fodrad med silverfolie.
Litiumkarbonat kan omvandlas till litiumoxid och koldioxid genom upphettning av materialet till 700°C under vakuum i en platinabåt.
Industriell användning. Det finns inga nuvarande industriella användningsområden som förbrukar stora mängder litiumoxid.
Litiumoxid reagerar med vatten när det löser sig och bildar en lösning av litiumhydroxid.Litiumoxid är en stark bas och reagerar typiskt med sura gaser och vätskor för att bilda litiumsalter. Vid förhöjda temperaturer reagerar litiumoxid också med många fasta icke-metalloxider (Si02, B2O3 etc.) och metalloxider (A1203 , Fe2C>3 etc.). Reaktioner vid höga temperaturer ligger till grund för den flödande verkan av litiumoxid, litiumhydroxid och litiumkarbonat. Man måste vara försiktig för att undvika att litiumoxid reagerar med reaktionskärl vid höga temperaturer.