De goda nyheterna är att de allra flesta av dessa perifera skador på trigeminusnerven genomgår spontan regeneration. Vissa skador kan dock vara permanenta med olika grader av sensorisk nedsättning som sträcker sig från lätt domningar (hypoestesi) till fullständig anestesi. Vissa patienter kan till och med utveckla brännande smärta som kallas dysestesi utöver sina sensoriska brister.
Målet med mikrokirurgi av trigeminusnerven är att återställa nervkontinuiteten genom att avlägsna eventuella hinder som ärrbildning eller främmande föremål och skapa nervkontinuitet. I den här artikeln kommer man att gå igenom mekanismerna för skador på trigeminusnerven inom tandvården, klinisk neurosensorisk testning, indikationer för kirurgi och remiss till en mikrokirurg samt kirurgiska förfaranden som innefattar tilläggsmaterial för att öka regenerationen och förbättra aktiviteterna i det dagliga livet för våra patienter.
Mekanismer för trigeminusnervskador inom tandvården
De vanligaste ingreppen som är förknippade med trigeminusnervskador inom tandvården omfattar avlägsnande av impedierade tredje molarer och placering av endosseösa tandimplantat (figur 1). Ytterligare orsaker kan vara endodontiska ingrepp och även administrering av lokalbedövning. Andra mindre vanliga kirurgiska ingrepp är ortognatisk kirurgi med osteotomier, ansiktstrauma och behandling av maxillofacial patologi.
I vår praktik är de tre vanligaste observerade etiologierna för skador på trigeminusnerven tandutdragningar, placering av implantat och endodontiska ingrepp där endodontiska material extruderas in i den nedre alveolära nervkanalen (figur 2).
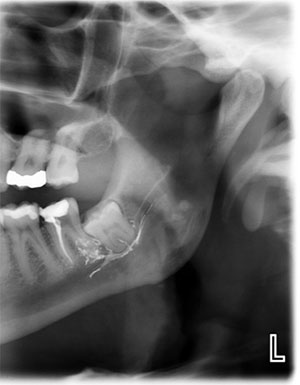
Figur 2. Endodontiska material som extruderats in i IAN såsom denna pasta utgör en av de tre vanligaste etiologierna för skador på trigeminusnerven.
 |
 |
|
Figur 3. Förberedelse av nerven för neurorafy börjar med förberedelse av de proximala och distala nervsegmenten tillbaka till frisk nervvävnad som noteras av axoplasmatisk utbuktning, punktformig blödning och avsaknad av fibros |
Figur 4. Allogent nervtransplantat kan användas för att rekonstruera defekter när det inte går att åstadkomma en spänningsfri reparation. |
Temporära eller permanenta sensoriska nervstörningar i samband med avlägsnande av impedierade tredje molarer, inklusive kirurgisk exodonti, är ett resultat av skador på den linguala och/eller den inferiora alveolära nerven. I vissa fall leder tekniker för att bevara fästen med hjälp av allogena bentransplantat till att benet förskjuts in i nervkanalen, vilket också kan orsaka nervskador.
Tandläkare måste diskutera risken för dessa typer av skador under den informerade samtyckesprocessen och dokumentera diskussionen i enlighet med detta. När dessa skador väl har identifierats måste de följas upp regelbundet med seriella nervtester för att dokumentera eventuella sensoriska förändringar. Neurosensorisk testning och indikationer för mikrokirurgi av trigeminusnerven kommer att diskuteras senare i denna artikel.
Skador på den nedre alveolärnerven (IAN) vid avlägsnande av en impakterad tredje kindtand har korrelerats negativt med flera faktorer, bland annat äldre patienters ålder, djupet av impaktering, rotstrukturens utveckling, den impakterade tandens vinkling och rotspetsens läge i förhållande till IAN. Operatörens erfarenhet spelar också en roll för förekomsten av nervskador. Övernitisk användning av roterande instrument för avlägsnande av ben och sektionering av tänder kan leda till direkta nervskador.
Det är inte ovanligt att vissa kliniker överväger att använda sig av avsiktlig partiell odonektomi (där kronan avlägsnas och rötterna behålls) i de fall där risken för IAN-skador är hög. Det finns begränsningar för detta förfarande i och med att tandstrukturen inte bör behållas i närvaro av infektion eller patologi. Dessutom kan patienterna utveckla sekundär infektion eller migration av rotfragment som kräver sekundär kirurgi, vilket måste diskuteras med patienten preoperativt.
Detta är anledningen till att jag reserverar förfarandet med avsiktlig partiell odontektomi för endast mycket utvalda patienter och ofta väljer att avlägsna komplexa tredje molarer efter avancerad avbildning i operationssalens miljö där samtidig mikrokirurgi kan utföras intraoperativt om det är indicerat.
Lingualnervskador i samband med kirurgi av tredje kindtanden kan förekomma och resultera i att man biter sig i tungan, förändrar talet, t.ex. lismande, och försämrad smakuppfattning. Patienterna kan också beskriva förändrad smak med ökad bitterhet eller metallsmak på grund av att den glossopharyngeala nervfördelningen dominerar och involverar den bakre tredjedelen av tungan med minskad intensitet av salt, surt och sött som förmedlas av de främre två tredjedelarna av tungan.
Håll dig i minnet att nerverna chorda tympani, som förmedlar smak i de främre två tredjedelarna av tungan, löper tillsammans med nerverna lingualerna och kan skadas samtidigt. Lingualnerven visualiseras i allmänhet inte vid kirurgi av tredje molaren och kan ha ett varierande anatomiskt läge. Anatomiska studier har visat på variationen i nervens läge med upp till 10 % av patientens nerv belägen ovanför den linguala benkammen och i direkt kontakt med den linguala plattan hos upp till 25 % av patienterna. Detta sätter den linguala nerven i riskzonen beroende på om incisionen placeras för långt lingalt eller om den linguala plattan fraktureras eller bryts av en kirurgisk borr eller ett handinstrument.
Jag har observerat fall där den impakterade tredje molaren är lingalt orienterad, vilket eliminerar en del av den linguala plattan och placerar nerven i ett prekärt läge under extraktionen, även om nerverna är lokaliserade inom normala anatomiska varianter. Det måste betonas att man måste vara uppmärksam på incisionsdesign med buccal eller lateral orientering och att inte kränka den linguala benplattan med roterande instrumentering. Användningen av retraktion av linguallappen vid kirurgi av tredje molar kan vara förknippad med en ökad förekomst av tillfälliga nervskador på grund av dragskador.
Lokalanestesiinjektioner kan i vissa fall orsaka skador på trigeminusnerven. Lyckligtvis försvinner de flesta av dessa skador spontant, men vissa kan vara permanenta. Det har uppskattats att ungefär en av 100 000 injektioner resulterar i ett neurosensoriskt underskott. Detta innebär att en eller två skador orsakade av injektion av lokalbedövningsmedel inträffar under en aktiv tandläkares karriär. Den exakta etiologin för denna skada är oklar med flera postulerade mekanismer.
Direkt trauma från en nål som penetrerar nerven kommer att framkalla en smärtsam reaktion från patienten och få tandläkaren att dra tillbaka och rikta om nålen. Det skulle vara olidligt smärtsamt och osannolikt att injicera lokalbedövning i nervskidan på en vaken patient. Dessutom är ytan av en nålperforation mycket liten i förhållande till nervens diameter och ofta oproportionerligt stor i förhållande till den nivå av sensoriskt underskott som observeras kliniskt.
En mer trolig orsak är utvecklingen av en barb på nålen på grund av kontakt med benet vid upprepade injektioner. Om nålen sedan tränger in i nerven kan den teoretiskt sett orsaka ett intraneuralt hematom, vilket kan leda till ischemi på grund av tryck, fibros och så småningom permanent sensoriskt underskott. En förklaring till de varierande graderna av sensoriskt underskott som kan uppstå till följd av injektionsskador kan vara relaterad till ett minskat antal fascikler inom nerven på platsen för injektion av lingula i förhållande till antalet fascikler i regionen kring den tredje molaren.
Förutom mekaniska skador är alla lokalanestetika neurotoxiska och har potential att orsaka nervskador. Koncentrationen av lokalbedövning, förekomsten av en vasokonstriktor och lokalbedövningens penetrerbarhet kan alla potentiellt påverka risken för skador. Vissa kliniker väljer att undvika användning av mer koncentrerade lokalbedövningsmedel för inferior alveolär nervblockering och reserverar dem för områden där infiltration kan utföras.
Oavsett orsaken till nervskador vid injektion av lokalbedövningsmedel finns det inget tillförlitligt sätt att förhindra att dessa skador uppstår. God teknik innebär att patienterna injiceras långsamt och att man förlitar sig på aspiration före injektion. Alla skador till följd av lokalbedövningsinjektioner måste dokumenteras och övervakas med seriella undersökningar.
Patienterna kan vara lugnade med att de flesta av dessa skador kommer att lösa sig spontant. I de sällsynta fall där patienterna utvecklar neuropatisk smärta och dysestesi som blir centraliserad, är farmakologisk behandling och remiss till en smärtbehandlingsspecialist indicerad. Mikrokirurgi av trigeminusnerven har inte visat sig vara framgångsrik i dessa fall och är i allmänhet inte indicerad för patienter med lokalbedövningsskador.
Placering av tandimplantat kan resultera i skador på IAN från området för mentalnerven där en främre slinga finns till vilken plats som helst längs nervens väg. Implantatskador kan uppstå från en mängd olika mekanismer, inklusive direkt mekanisk kompression från implantatet, fraktur av kortikalt ben med förskjutning in i kanalen, eller borrning av osteotomin och blödning i kanalen som i huvudsak leder till ett kompartmentsyndrom i kanalen genom komprimering av nerven.
En grundlig preoperativ planering med lämplig avbildning, användning av datorgenererade guider och sondering av osteotomiplatserna för att säkerställa intakt benstruktur kan minimera dessa skador. Postoperativa röntgenbilder bör vara standardpraxis efter implantatplacering. Om implantatet verkar inkräkta på nervkanalen bör det antingen avlägsnas och ersättas med ett kortare implantat eller backas ut på lämpligt sätt. Tekniker för att lateralisera nerver för att möjliggöra placering av längre implantat har använts tidigare. Själva förfarandet var dock ansvarigt för vissa permanenta sensoriska brister.
Endodontisk behandling kan resultera i skador på trigeminusnerven, vilket kan vara förödande. Överinstrumentering av kanalsystemet kan utgöra en direkt kanal för mekaniska skador med hjälp av filar eller gutta-perka-material. Kemiska skador kan orsakas av steriliseringslösningar inklusive natriumhypoklorit och cement som ofta innehåller eugenol, vilka båda är neurotoxiska.
Direkt trauma kan också uppstå vid endodontisk kirurgi, t.ex. vid apikektomi på bakre tänder där rötterna befinner sig i närheten av IAN. Förflyttning av endodontiskt material in i IAN-kanalen bör alltid betraktas som en nödsituation.
Inom sensoriska brister kan många patienter utveckla neuropatisk smärta, vilket har begränsat nyttan av mikrokirurgi av trigeminusnerven. Dessa patienter bör hänvisas till en kirurg med erfarenhet av mikrokirurgi för att avlägsna eventuella främmande material så snart som möjligt innan neuropatisk smärta uppstår.
Klinisk neurosensorisk testning
När ett neurosensoriskt underskott har diagnostiserats är neurosensorisk testning indicerad för att kvantifiera graden av sensorisk nedsättning, övervaka eventuell spontan sensorisk återhämtning och avgöra om mikrokirurgi av trigeminusnerven är indicerad. Det drabbade området kartläggs på patientens ansikte och registreras på ett lämpligt diagram för reproducerbara registreringar av seriella undersökningar.
En lätt borste eller steril nål kan användas för att avgränsa det drabbade området. Den kontralaterala eller opåverkade sidan används som kontroll och alla mätningar registreras. Vid bilaterala skador används ett opåverkat intilliggande ansiktsområde som kontroll. Tillräckligt tryck appliceras för att framkalla ett svar. Penetration av huden ger ingen användbar tilläggsinformation. Tre nivåer av testning utförs för patienter med hypoestesi eller domningar.
Nivå A omfattar tvåpunktsdiskriminering och riktningssinne. Tvåpunktsdiskriminering kan utföras med hjälp av en kaliber- eller boley-mätare. Normalvärdena är ungefär 3 till 4 mm. Värden som är större än 20 mm registreras i allmänhet inte eftersom innervation på den kontralaterala sidan börjar spela en roll vid detta avstånd. Riktningssinne uppnås med hjälp av en lätt borste eller ett tunt nylonmonofilament och man bedömer om patienten kan bestämma slag och riktning.
Nivå B-testning används för att utvärdera icke-noxiska stimuli, t.ex. vibrationer och statisk lätt beröring. Vibrationer mäts enkelt med en stämgaffel och statisk lätt beröring mäts med von Frey-monofilament. Nylonmonofilamentet appliceras vinkelrätt mot huden och tryck appliceras tills filamentet böjs. En filament med tjockare diameter kräver mer kraft för att böjas. Filamenten kalibreras baserat på det tryck som krävs för att böja sig, och ett kvantitativt värde kan registreras.
Nivå C-testning används för att mäta skadliga stimuli, inklusive smärta och temperatur. Smärta bedöms med hjälp av en steril nål som försiktigt berör huden för att avgöra om en skarp eller smärtsam känsla upplevs. Varm och kall känsla kan utvärderas med hjälp av en applikator med bomullsspets med varmt vatten och etylkloridspray. En tryckalgesiometer kan också användas för att ge ett standardiserat tryck vid varje mätning. De olika testerna motsvarar specifika nervfibrer som förmedlar var och en av förnimmelserna.
Current perception threshold är en teknik som är vanligare inom forskningen där drabbade områden stimuleras med ett elektriskt stimuli. Frekvensen av stimuleringen korrelerar med specifika nervfibrer, och patienterna kan kvantitativt registrera sin tröskelrespons vid ökande strömstyrka. Denna teknik gör det möjligt för forskaren att kvantitativt bedöma nervskador, även om detta har visat sig korrelera väl med den traditionella kliniska neurosensoriska testningen.
Samma testprocedurer kan användas för patienter med neuropatisk smärta med målet att karaktärisera svaret på varierande stimuli. Testning på nivå A där försiktig strykning av huden framkallar smärta kallas allodyni. Testning på nivå B avgör om patienten har hyperpati, vilket definieras som onormal smärtreaktion med fördröjd debut, ökande intensitet vid upprepad stimulering och ihållande känsla efter att stimuleringen avlägsnats. Testning på nivå C avgör om hyperalgesi eller ökad känslighet som inte står i proportion till stimuleringen föreligger. För patienter med smärta kan lokalanestetiska blockeringar användas för att avgöra om skadan är perifer genom att bestämma om de är effektiva för att minska eller eliminera smärta.
Indikationer för mikrokirurgi av trigeminusnerven
En neurosensorisk störning som kvarstår i mer än tre månader är en allmänt accepterad indikation för explorativ mikrokirurgi av trigeminusnerven. Detta koncept kommer dock troligen att förändras i framtiden i och med tillgången till högupplösta MRT-studier, inklusive magnetresonansneurografi, där nervskador kan visualiseras direkt, vilket eliminerar behovet av att vänta i fall av allvarliga eller fullständiga skador.
Indikationer för mikrokirurgi av trigeminusnerven inkluderar:
- Observerad nervtransektion
- Ingen subjektiv sensorisk förbättring under längre tid än 3 månader
- Utveckling av nytillkommen smärta i den drabbade regionen
- Närvaro av en främmande kropp
- Progressivt försämrad hypoestesi eller dysestesi
- Hypoestesi som är intolerabel för patienten.
Närvaro av en främmande kropp, t.ex. vid endodontiska fyllnadsmaterial i nervkanalen, är en indikation för omedelbar explorativ mikrokirurgi före uppkomsten av neuropatisk smärta.
Kontraindikationer för trigeminal mikrokirurgi skulle innefatta:
- Visor på förbättrad sensorisk funktion
- Hypoestesi som är acceptabel för patienten
- En allvarligt medicinskt komprometterad patient
- Central neuropatisk smärta
- För lång tid sedan skadan
Studier har visat på en signifikant sensorisk förbättring efter mikrokirurgi av trigeminusnerven från sex till nio månader efter skadan. Prognosen försämras dock i allmänhet med tiden.
Mikrokirurgi av trigeminusnerven
De grundläggande kirurgiska principerna som ingår i perifer mikrokirurgi av trigeminusnerven omfattar dekompression och exponering av nerverna, hemostas, avlägsnande av främmande material i eller runt nerverna, resektion tillbaka till frisk nervvävnad och spänningsfri neurorafy.
IAN kan närmas antingen intraoralt eller transcervikalt via ett submandibulärt snitt. Det transorala tillvägagångssättet används oftast med exponering av nerven genom dekorticering av den laterala cortexen eller alternativt via en sagittal delad mandibulär osteotomi. Det senare tillvägagångssättet ger god åtkomst. Ocklusion måste dock återupprättas efter avslutad mikrokirurgi, och tillämpning av rigid intern fixering för benstabilitet och läkning krävs.
Den linguala nerven närmar sig genom antingen ett paralingual eller lingual gingivalsulcärt snitt i ett subperiostalt plan. Det paralingualiska snittet kompletteras med trubbig och skarp dissektion längs munsbottnen i nervens förväntade närhet för att möjliggöra exponering. Fördelarna med detta tillvägagångssätt är ett mindre snitt med direkt visualisering av nerven. En nerv som har fått en fullständig skada kan dock resultera i retraktion av de proximala och distala segmenten vid exponering.
Det lingual gingivala sulcus-incisionen kräver en lateral frigörelse längs den externa oblika åsen för fullständig mobilisering av klaffen och förhöjning av klaffen i ett subperiostalt plan. När klaffen är upphöjd kan man visualisera nerven genom det överliggande periostet och trubbigt dissekera den från insidan av klaffen. Denna teknik kräver ett större snitt än det paralingual mucosala snittet. Den proximala och distala nerven kommer dock inte att dra sig tillbaka under den kirurgiska dissektionen, och det är min föredragna metod.
I alla fall av mikrokirurgi av den perifera trigeminusnerven bör extern neurolys utföras för att exponera och befria den från ärrvävnad, främmande kroppar eller restriktioner från vävnadsbädden. Detta kommer att exponera nerven, vilket möjliggör en bättre bedömning av skadan för definitiv kirurgisk planering. Avskiljandet av ärrvävnad och frigörandet av en intakt nerv kan vara det enda nödvändiga ingreppet för att möjliggöra återhämtning av känseln. Extern neurolys utförs vanligen under viss förstoring för att bedöma nerven och isolera eventuell patologi såsom neurom.
Intern neurolys är ett mindre vanligt ingrepp som kan användas när det finns tecken på nervfibros utöver restriktion eller kompression. Denna teknik praktiseras inte av alla kirurger eftersom det finns risk för att vissa iatrogena skador kan uppstå till följd av själva ingreppet. Ett längsgående snitt skapas genom epineurium för att exponera de inre fascikulära strukturerna och bedöma nervens integritet.
Placering av ett längsgående snitt längs med nerven kallas epifascikulär epineurotomi, medan fullständig excision av epineurium kallas epifascikulär epineurektomi. När epineurium frigörs kan nerven tillåtas expandera, vilket tyder på en lyckad intern dekompression. När fibros observeras och ingen livskraftig nervvävnad finns, ska det drabbade segmentet excideras och nerven förberedas för neurorafi.
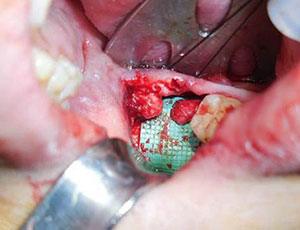
Förberedelse av nerven för neurorafi börjar med att förbereda de proximala och distala nervsegmenten tillbaka till frisk nervvävnad som noteras av axoplasmatisk utbuktning, punktblödning och avsaknad av fibros (figur 3). Onormal vävnad excideras i små steg tills normal nervvävnad kan observeras under förstoring. De proximala och distala nervändarna riktas sedan in och bedöms om spänningsfri stängning är möjlig.
Mobilisering av IAN kan förbättras genom distal och proximal nervdissektion och offring av incisivegrenen för att möjliggöra lateralisering och mobilisering efter dekorticering av IAN från skadeplatsen till de mentala foramina. Mobiliseringen av lingualnerven kan maximeras genom ytterligare proximal och distal dissektion. Neurorafy för perifera skador på trigeminusnerven kan utföras på epineurium- eller perineuriumnivå, även om den oftast fullbordas på epineuriumnivå.
Kliniskt sett finns det ingen skillnad i resultat för reparation av sensoriska nerver med den epineurala jämfört med den perineurala tekniken, även om det finns en potential för iatrogena skador när man försöker reparera på fascikelns nivå. En suturdiameter mindre än 7-0 av ett icke-reaktivt material som nylon väljs för att minimera proliferation av ärrvävnad och inflammatorisk reaktion.
Den mest kritiska frågan förblir spänningen över neurorafyplatsen, som måste minimeras för att uppnå optimala resultat, eftersom spänningen kan leda till begränsning av blodflödet och ischemi av nerven. Om en spänningsfri reparation inte kan uppnås genom direkt neurorafy, kan man använda sig av den ledningsassisterade reparationstekniken. Denna teknik gör det möjligt att placera spänningsreducerande suturer i kanten av kanalen.
Kanaler fyller också flera andra viktiga funktioner vid nervreparation. Dessa innefattar skydd av neurorafysplatserna, förhindrande av felställning av fascikel och förhindrande av ärrbildning nedåt eller bindning av nerven under läkningen. Många ledningsmaterial har beskrivits och använts historiskt, men de flesta kirurger föredrar idag resorberbara kollagen- eller porcina tunntarmssubmucosaledningar, som remodelleras för att bilda ett nytt vävnadsskikt som liknar epineurium. Oavsett vilket material som används hjälper dessa ledningar till med nervregenerering genom att möjliggöra kapillär inväxt och spridning av tillväxtfaktorer till skadeplatsen.
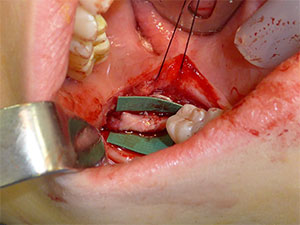
Om gapet mellan nervändarna är för stort för antingen en direkt neurorafy eller en ledningsassisterad reparation kan ett interpositionellt nervtransplantat, som kan vara antingen autogent eller allogent, användas (figur 4). Tillgången till allogena nervtransplantat har dramatiskt förändrat alternativen för patienterna eftersom de eliminerar den samtidiga morbiditet som är förknippad med skörden av autogena transplantat. Användning av transplantat utan spänning kan faktiskt förbättra resultaten jämfört med primära reparationer som utförs under spänning. Jag föredrar allogena nervtransplantat, som är lättillgängliga och acceptabla för patienterna jämfört med skörden av autogena transplantat.
Sensorisk rehabilitering
Sensorisk rehabilitering kan vara till hjälp för att hjälpa patienterna att påskynda början på sin sensoriska återhämtning. Övningar för sensorisk återuppbyggnad som utförs med daglig massage och stimulering av det drabbade området i samband med administrering av vitamin B12 resulterar i att man uppnår funktionell sensorisk återhämtning (FSR) tidigare än de patienter som inte använder sig av dessa metoder. Detta innebär inte att slutresultatet är annorlunda, bara att FSR kan uppnås tidigare.
Målet med sensorisk rehabilitering är att stimulera de perifera receptorerna så att det centrala nervsystemet sedan kan börja bearbeta denna sensoriska input. Jag rekommenderar sensorisk rehabiliteringsträning och vitamin B12 till alla patienter postoperativt.
Resultat av mikrokirurgi av trigeminusnerven
De flesta resultatdata för mikrokirurgisk reparation av perifera trigeminusnervskador bygger på fallrapporter och serier. Historiskt sett fanns det ingen standardisering när det gäller att kvantifiera resultaten av nervskador förrän man införde Medical Research Council Scale (MRCS). Detta verktyg standardiserar och kvantifierar kliniska sensoriska resultat, vilket är användbart för jämförelser mellan studier.
De faktorer som är förknippade med framgångsrika sensoriska resultat från mikrokirurgi inkluderar tid från skada till operation, avsaknad av preoperativ neuropatisk smärta, avsaknad av främmande kroppar kring nerverna, spänningsfri primär reparation och användning av conduit-assisterad reparation eller nervtransplantat när spänningsfri reparation inte är möjlig.
Patienterna måste få råd om realistiska resultatförväntningar när det gäller tid till återhämtning och slutliga sensoriska nivåer som kan uppnås baserat på de preoperativa variablerna. Mikrokirurgi av trigeminusnerven har visat sig vara en effektiv metod för att återställa känseln efter perifera skador på trigeminusnerven.
Framtida riktlinjer och slutsatser
Mikrokirurgi av trigeminusnerven har visat sig vara en effektiv kirurgisk behandling vid behandling av perifera skador på trigeminusnerven. Förutom tillgången till ledningar och allogena nervtransplantat börjar andra hjälpmedel bli tillgängliga för mikrokirurgerna, t.ex. platelet rich plasma, som används för att förbättra sårläkningen genom frisättning av tillväxtfaktorer och andra bioaktiva substanser som inleder sårläkningen. Stamceller från fettceller är ett annat komplement som kan främja nervregenerering. Dessa typer av nya material och tekniker kommer att fortsätta att utvecklas och kommer sannolikt att bidra till förbättrad sensorisk återhämtning i framtiden.
Bibliografi
Behnia H, Kheradvar A, Shabrohbi M. Anatomic Study of the Lingual Nerve in the Third Molar Region. J Oral Maxillofac Surg. 58:649-651; 2000.
Dessouky R, Xi Y, Zuniga J, Chhabra A. Role of MR Neurography for the Diagnosis of Peripheral Trigeminal Nerve Injuries in Patients with Prior Molar Tooth Extraction. Am J Neuroradiolo. 39:162-169: 2018.
Devine M, Modgill O, Renton T. Mandibular Division Trigeminal Nerve Injuries Following Primary Endodontic Treatment. En fallserie. Australian Endodontic J. 43:56-65; 2017.
Dodson TB och Kaban LB. Rekommendationer för hantering av trigeminusnervskador baserat på en kritisk bedömning av litteraturen. J Oral Maxillofac Surg. 55:1380-1386; 1997.
Lampert RC, Nesbitt TR, Chuang SK, Ziccardi VB. Hantering av endodontiska skador på den inre alveolarnerven. Quintessence Int. 47:581-587; 2016.
Meyer RA och Bagheri SC. Klinisk utvärdering av perifera skador på trigeminusnerven. Atlas Oral Maxillofac Surg Clin N Am. 19:15-33; 2011.
Miloro M, Halkias LE, Slone HW, et al. Assessment of the Lingual Nerve in the Third Molar Region Using Magnetic Resonance Imaging. J Oral Maxillofac Surg. 55:134-137; 1997.
Nizam SA och Ziccardi VB. Skador på trigeminusnerven: Undvikande och hantering av iatrogena skador. Oral Maxillofac Surg Cl N Am. 27:411-424; 2015.
Pogrel MA. Resultaten av mikroneurokirurgi av den inre alveolära och lingualnerven. J Oral Maxillofac Surg. 60:485-489; 2002.
Pogrel MA, Jergensen R, Burgon E, Hulme D. Long-Term Outcome of Trigeminal Nerve Injuries Related to Dental Treatment. J Oral Maxillofac Surg. 69:2284-2288; 2011.
Pogrel MA och Thamby S. Permanent Nerve Involvement Resulting from Inferior Alveolar Nerve Blocks. JADA. 131:901-907; 2000.
Pogrel MA, Bryan J, Regezi J. Nerve Damage Associated with Inferior Alveolar Nerve Blocks. JADA. 126:1150-1155; 1995.
Shanti RM, Khan J, Eliav E, Ziccardi VB. Finns det en roll för en kollagenledare och ett antiinflammatoriskt medel vid behandling av partiella perifera nervskador. J Oral Maxillofac Surg. 71:1119-1125, 2013.
Wilson MT, Chuang SK, Ziccardi, VB. Lingualnervens mikrokirurgiska resultat med hjälp av två olika ledningar: En retrospektiv kohortstudie. J Oral Maxillofac Surgery. 75:609-615; 2017.
Yampolsky A, Ziccardi VB, Chuang SK. Efficacy of Acellular Nerve Allografts in Trigeminal Nerve Reconstruction. J Oral Maxillofac Surgery. 75:2230-2234; 2017.
Yilmaz Z, Ucer C, Scher E, Suzuki J, Renton T. A Survey of the Opinion and Experience of UK Dentists: Del 2: Riskbedömningsstrategier och hantering av iatrogena skador på trigeminusnerven i samband med tandimplantatkirurgi. Implant Dent. 26:256-262; 2017.
Ziccardi VB och Assael LA. Mekanismer för skador på trigeminusnerven. Atlas Oral Maxillofac Surg Clin N Am. 9:1-11; 2001.
Ziccardi VB, Hullett J, Eliav E, Gomes J. Physical Neurosensory Testing versus Current Perception Threshold Assessment in Trigeminal Nerve Injuries Related to Dental Treatment: En retrospektiv studie. Quintessence Int. 40:603-609; 2009.
Ziccardi VB. Mikrokirurgiska tekniker för reparation av de inre alveolära och lingualnerverna. Atlas Oral Maxillofac Surg Clin N Am. 19:79-90; 2011.
Dr. Ziccardi är professor, ordförande och chef för utbildning på Rutgers University School of Dental Medicine Department of Oral and Maxillofacial Surgery. Han kan nås på (973) 972-7462 eller Den här e-postadressen skyddas mot spambots. Du måste aktivera JavaScript för att se den..
Offentliggörande: Dr Ziccardi är konsult hos Axogen, Alachua, Florida.
Fönstret på 90 dagar: Trigeminusnervskador och vikten av snabb remiss
Rutgers-forskare ska utforska de genetiska rötterna till trigeminusneuralgi
Behandling mot trigeminusneuralgi utan biverkningar