1. Permeabilitet
2. Fluiditet
3. Heterogenitet
– Inre
– Yttre
– Böjning, tjocklek
Cellmembranens funktioner bestäms av deras molekylära sammansättning. Typen och andelen av dessa molekyler fastställer membranens fysikalisk-kemiska egenskaper: semipermeabilitet, asymmetri, fluiditet, reparation och återvinning.
Permeabilitet
Membranens semipermeabilitet är en följd av membranens inre hydrofoba miljö, skapad av lipidfettsyrekedjorna, som är svår att passera för molekyler med elektriska laddningar. Genom att förhindra fri diffusion av molekyler kan membranen således bilda avdelningar som håller olika inre och yttre miljöer åtskilda. Permeabiliteten är dock selektiv. Polaritet och storlek är de viktigaste molekylära egenskaperna som påverkar förmågan att passera membranen. Små molekyler utan elektrisk laddning, t.ex. CO2, N2, O2, och molekyler med hög löslighet i fett, t.ex. etanol, kan passera membranen nästan fritt genom passiv diffusion (figur 1). Permeabiliteten är lägre för molekyler som har elektriska laddningar när antalet positiva laddningar är lika med negativa laddningar, så kallade oladdade molekyler, t.ex. vatten och glycerol. Man skulle kunna tro att vatten kan passera membranen fritt, men det finns vissa begränsningar, och det är därför som vissa membran innehåller akvaporiner, en typ av transmembranprotein med en kanal som gör att vattnet kan passera fritt. Förmågan hos stora oladdade molekyler, t.ex. glukos, att passera membranen är låg. Membraner är mycket ogenomträngliga för joner och laddade molekyler. Några värden för permeabilitetskoefficienten vid passiv diffusion är: O2: 2,3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, glycerol: 10-6 cm/s, natrium och kalium: 10 -14 cm/s.
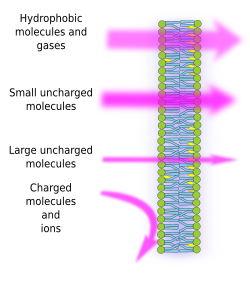
Den ojämna fördelningen av joner och molekyler mellan båda sidor av ett membran gör det möjligt att generera och upprätthålla elektrokemiska gradienter. Skillnaden mellan den inre och den yttre koncentrationen av elektriska laddningar kallas membranpotential. Denna gradient används för många cellfunktioner, t.ex. ATP-syntes och överföring av information längs nerverna. Semipermeabiliteten är också ansvarig för osmotiska processer, som är vattenrörelser genom membranen från en mindre koncentrerad lösning på ena sidan till en mer koncentrerad lösning på andra sidan, för att jämna ut de båda koncentrationerna. På detta sätt kan växtcellerna öka i storlek tack vare en högre intracellulär koncentration av vissa lösningsmedel som får vatten att tränga in i cellen, vilket i sin tur ger upphov till ett inre hydrostatiskt tryck (kallat turgortryck) som pressar cellväggarna utåt. Molekyler som inte passerar membranen fritt är användbara för cellerna eftersom de kan skapa gradienter som kan fungera som informationsmekanismer eller som energilager. Celler har transmembranproteiner som gör det möjligt att korsa membranet eller flytta laddade molekyler och joner mellan cellmembranens båda sidor och undvika det inre membranets hydrofoba miljö. Muskelsammandragning utlöses till exempel av öppnandet av kanaler som minskar en befintlig jongradient.
Semipermeabiliteten påverkas av membranens lipidsammansättning. Kolesterolhalten är till exempel viktig i plasmamembranen. En ökning av kolesterolhalten minskar fluiditeten och ökar hydrofobiciteten, båda egenskaperna gör membranen mer ogenomträngliga. En ökning av kolesterolhalten med mer än 30 % (vilket är ett högt värde) gör således myelinmembranen mycket lämpliga för att isolera axonerna och optimera spridningen av aktionspotentialen längs axonet.
Fluiditet och laterala domäner
Fluiditet är en egenskap hos membran. Den är relaterad till molekylers förmåga att röra sig inuti membranen. Högre fluiditet innebär att rörelserna är mer frekventa. Cellmembranen är i själva verket ett fettskikt där molekylerna befinner sig i ett halvflytande visköst tillstånd. Man kan alltså gissa att molekyler kan förflytta sig genom diffusion. En glycerofosfolipid som befinner sig i plasmamembranets yttre monolager kan till exempel ha två typer av rörelser: laterala, dvs. i samma monolager, och flip-flop, dvs. hoppa från ett monolager till ett annat (figur 2). I konstgjorda membran har dessa två typer av rörelser observerats, och de laterala rörelserna är mycket vanligare än flip-flop-rörelserna. Genom lateral diffusion kan lipiderna förflytta sig 30 µm på 20 sekunder; de kan förflytta sig över hela omkretsen av en medelstor cell på en minut. Flip-flop-rörelser är dock mycket sällsynta eftersom lipidmolekylens hydrofila huvud måste korsa det inre skiktet av fettsyrekedjor, och detta är termodynamiskt svårt. För en lipidmolekyl är sannolikheten för en flip-flop-förflyttning ungefär en gång per månad. Kolesterol beter sig dock annorlunda och kan göra flip-flop ganska lätt.

Membranens fluiditet kan förändras beroende på den kemiska sammansättningen. Generellt sett ökar kortare fettsyrekedjor och högre mängd omättade bindningar mellan kolväten i fettsyrorna membranets fluiditet. Mängden kolesterol påverkar också membranets fluiditet, men nettoeffekten beror på temperatur och typ av lipider i membranet. Kolesterol har två effekter: det hämmar övergången till ett fast geltillstånd (mindre fluiditet), men minskar också flexibiliteten hos de omättade fettsyrekedjorna. Generellt kan man säga att en ökning av kolesterolkoncentrationen minskar membranens fluiditet, även om effekten vid låga temperaturer är den motsatta. Cellens inre membran, t.ex. i det endoplasmatiska retikulumet, innehåller mycket lite kolesterol och är därför mer flytande. Kolesterol ger dessutom membranen en annan egenskap som kallas hidrofobicitet, vilket gör membranen mer ogenomträngliga.
Den olika molekylära sammansättningen mellan de två monolagren i ett membran, så kallad membranasymmetri, kan generera en distinkt fluiditet i varje monolag. Beroende på den molekylära sammansättningen kan lipiderna befinna sig i två fysiska faser: vätskeordnad (mindre fluiditet) och vätskefördelad (mer fluiditet). Plasmamembranets yttre monolager antas oftare befinna sig i den vätskeordnade fasen, medan det inre monolagret tenderar att befinna sig i den vätskefördelade fasen.
Celler kan modifiera membranens fluiditet genom att ändra deras kemiska sammansättning. Bakterier justerar till exempel fettsyrekedjornas mättnad och längd så att membranens fluiditet kan anpassas till miljöförhållandena. Variation i koncentrationen av glycerofosfolipider, t.ex. fosfatidyletanolamin, kan också modulera fluiditeten. Vissa insekter kan inte syntetisera steroler, som kolesterol, och sterolerna i deras membran kommer från födan. De ändrar sina cellmembraners fluiditet genom olika koncentrationer av fosfatidyletanolamin.
Mitokondriernas inre membran måste vara en stark ogenomtränglig barriär för att skapa och upprätthålla en protongradient. Det skulle kunna göras genom en ökning av kolesterolhalten. På så sätt blir hydrofobiniteten högre, men i gengäld minskar kolesterolet fluiditeten, vilket tycks vara mycket viktigt för proteinernas funktion i detta membran. Mitokondrierna löser problemet med kardiolipin, en omättad fosfolipid som ökar hidrophobiciteten, men som inte minskar membranets fluiditet särskilt mycket.
3. Heterogenitet
På grund av fluiditeten kan man tro att proteinerna är slumpmässigt fördelade och att membranen därför är homogena när det gäller den molekylära sammansättningen, dvs. att de uppvisar samma molekylära innehåll och proportion oberoende av membranregionen. Detta är inte sant. Det finns begränsningar för den laterala spridningen av molekyler som orsakar heterogenitet i membranen, vilket innebär att det finns regioner i ett membran med olika molekylär sammansättning. I icke polariserade celler och på skalor större än 200 nm ser plasmamembranet ut att vara homogent, men på skalor under 200 nm är det heterogent. Membranens mikrodomäner anses vara cirka 60 µm stora. Lipider och proteiner uppvisar laterala rörelser som oftast är begränsade till områden på 60-200 nm under några millisekunder, och hoppar sedan till ett annat angränsande område där de stannar kvar under ytterligare en kort tid. Detta beteende kallas saltatorisk diffusion.
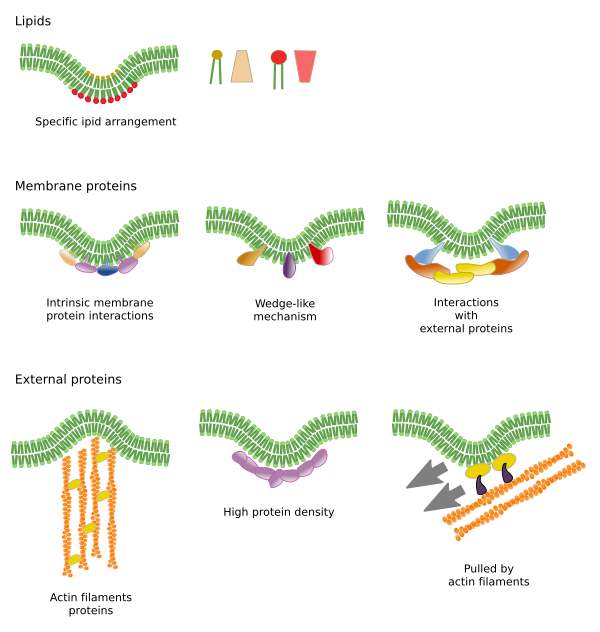
Begränsningar av molekylers laterala rörelser kan orsakas av flera mekanismer: interaktioner med cytoskelettet eller den extracellulära matrisen, interaktioner mellan membranmolekylerna sinsemellan, olika tätheter i lokala membranområden (förändringar i fluiditeten), mängden elektriska laddningar, membranens krökning och olika tjocklek på membranområden (figur 3).
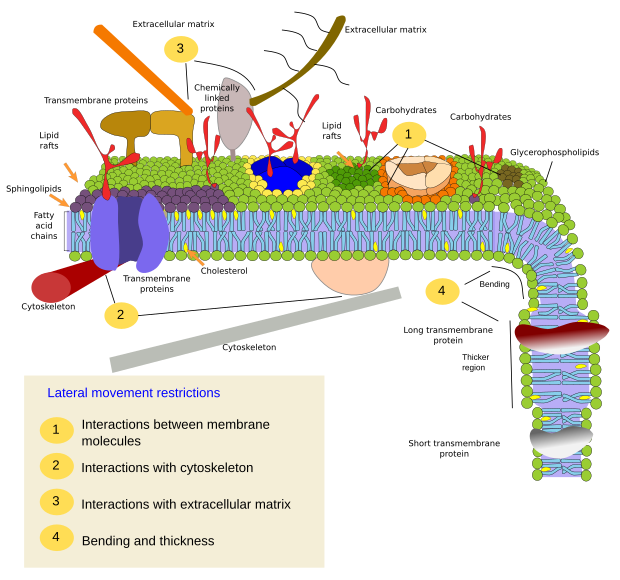
Inre interaktioner
Membranmolekylers interaktioner mellan varandra begränsar laterala rörelser. Både protein- och lipidrörelser påverkas av dessa interaktioner, vilket leder till att det bildas mikrodomäner med olika molekylär sammansättning (figur 4). Resultatet är en lateral heterogen fördelning av molekyler i membranen. Beroende på de molekylära proportionerna kan lipidmikrodomänerna ha olika densitet (dvs. fluiditet): fasta, flytande ordnade och flytande oordnade. Den vanligaste densiteten är flytande oordnade, som är den mest flytande.
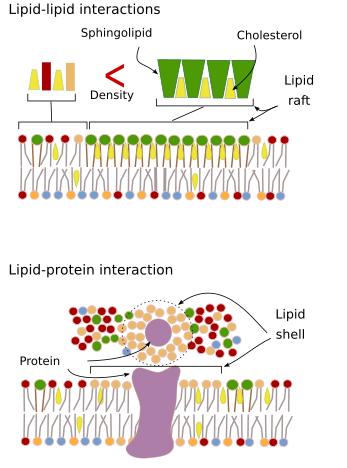
Sfingolipider och kolesterol kan associeras spontant mellan varandra, vilket minskar deras rörlighet och ökar den molekylära tätheten jämfört med närliggande områden. En liten distinkt grupp av molekyler bildas som en flotte i ett hav av lipider. Egentligen är dessa molekylära sammanslutningar kända som lipidflottar, och man tror att de är mycket rikliga och i cellmembranen. Lipidflottar uppvisar ett mycket dynamiskt beteende, de kan röra sig, växa, minska, dyka upp och försvinna. Membraner består faktiskt av många täta domäner som rör sig lateralt bland glycerofosfolipiderna, vilket gör att membranen är ganska heterogena när det gäller deras molekylära fördelning. Vissa experiment tyder på att vissa typer av proteiner ”trivs” bättre i lipidflottar. Dessa proteiner tillbringar mer tid inuti än utanför lipidflottarna, varför de under en viss tid färdas inom dessa tätheter. Detta orsakar en segregering av molekyler längs membranet och ökar sannolikheten för att olika molekyler befinner sig nära varandra längre tid än av en slump (diffusion), vilket på så sätt ökar sannolikheten för vissa molekylära reaktioner. Vidare föreslås att en hög koncentration av vissa typer av lipider i lipidflottarna skapar en distinkt kemisk miljö som underlättar vissa kemiska reaktioner eller molekylära interaktioner. Lipidflottar har föreslagits finnas i plasmamembranets yttre monolager eftersom det är på denna sida som sfingolipiderna är rikligt förekommande. Membrandomäner har föreslagits finnas även i organellernas membran, och man tror att vissa av deras funktioner är beroende av dessa membrandomäner.
I plasmamembranets inre monolager bildas mikrodomäner genom elektrostatiska interaktioner mellan basiska cytosoliska domäner eller divalenta katjoners domäner hos proteiner och lipidernas negativa polära huvuden. Ett annat mindre känt exempel är föreningen mellan fosfatidylinositolbisfosfat och kolesterol som bildar mikrodomäner i detta monolager. Dessa mikrodomäner som vetter mot cytosolen kan påverka intracellulära proteinställningar.
Traditionellt har man trott att det inte finns några interaktioner mellan de båda membranmonolagren och att de distribuerar sina mikrodomäner oberoende av varandra. Bevis tyder dock på att det finns interaktioner mellan varandra. Transmembranproteiner påverkar samtidigt båda monolagerna eftersom de korsar hela membranet. Ett annat sätt att synkronisera mellan de båda monolagren kan förmedlas av de långa fettsyrekedjorna, som vissa sfingolipier som kan ha en längd på 24 kolväten (den normala längden är 18). Dessa långa kedjor kan infogas bland fettsyrekedjorna i lipiderna i det andra monolaget och påverka lipidfördelningen. Dessutom tros lipiddomäner med långa fettsyrekedjor balanseras av lipidmikrodomäner med korta fettsyrekedjor i det andra monolagret, vilket håller membranets tjocklek konstant.
Membranproteiner, både integrerade och associerade, kan också interagera med varandra och samlas till makromolekylära byggnadsställningar för att underlätta informationsöverföring, igenkänning av cell-celler, starta vissa enzymatiska aktiviteter och cellulära rörelser. Det finns också multimera proteiner som endast är aktiva när alla underenheter hålls samman. Insulinreceptorn består till exempel av fyra underenheter. Proteiner och lipider kan också interagera för att bilda membrandomäner. I det inre monolagret associeras till exempel fosfatidylinositol runt proteiner genom elektriska interaktioner, som kan regleras genom att ändra fosfaterna i lipidernas polära huvud.
Interaktioner med yttre element
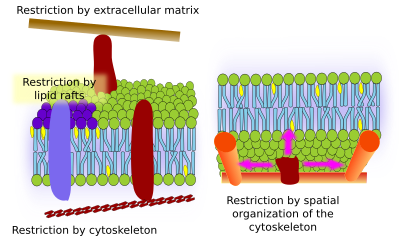
Integrala membranproteiner kan också ha laterala rörelser, men de är mer begränsade än lipider, främst på grund av interaktioner med den extracellulära matrisen och cytoskelettet genom deras extracellulära respektive intracellulära domäner (bild 5). Dessa interaktioner kan hålla kvar proteiner i små områden av membranet under längre tid än bara genom diffusion. Cytoskelettet kan bilda staket strax under plasmamembranet som håller proteiner begränsade till små områden. Aktinfilament och mikrotubuli kan omsluta små områden som begränsar difusionen av proteiner och lipider. Interaktioner med cytoskelettet är viktiga eftersom membranen blir mycket mer homogen om cytoskelettet experimentellt desorganiseras. Celler har andra mekanismer för att begränsa proteiner till specifika områden. Exempelvis har tarmepitelceller vissa transportörer och enzymer i det apikala plasmamembranet, men inte i den baso-laterala domänen på grund av ett bälte av täta korsningar, en molekylär dragkedja som förhindrar spridning mellan den apikala och baso-laterala domänen. En sådan asymmetrisk fördelning är nödvändig för epitelcellens fysiologi.
Membranböjning är ett annat sätt att skapa mikrodomäner. En membranböjning kan vara utgångspunkten för att bilda en vesikel, en cytoplasmaförlängning för cellulär expansion, en formförändring eller tillväxt av en organell, eller bara för att starta en barriär för att begränsa molekylers sidoförflyttning. Detta är en fysisk begränsning genom lipidernas 3D-placering i membranveckets mindre vinkel.
De molekylära verktyg som behövs för att böja ett membran rekryteras till specifika områden i membranet. Dessa mikrodomäner kan ha en specifik lipidsammansättning eller en särskild elektrisk laddningsmiljö. Fosfoinositider (PIP), främst PIP2 och PIP3, är lipider som bidrar till rekryteringen av proteiner för att böja membranet. De är användbara molekyler eftersom den elektriska laddningen och molekylstrukturen hos deras polära huvuden lätt kan modifieras genom kemiska reaktioner. På så sätt kan egenskaperna hos en viss membranregion ändras vid behov och rekrytera specifika proteiner. Fosfatidylserin kan också initiera en mikrodomän för membranböjning när den translokeras från ett monolager till det andra av flipasaser.
Böjning och tjocklek
Lipidmikrodomäner rekryterar proteiner som effektivt böjer membranet. Det finns specialiserade proteiner i denna roll (figur 6). BAR-domänproteiner (Bin/amfyphysin/Rsv161) är ett av dem. Böjning kan induceras genom två mekanismer: sammansättning av en böjd ställning av proteiner som drar eller trycker på membranet, och genom att aminosyrasekvenser infogas bland lipiderna som en kil. Caveoliner orsakar till exempel en krökning av membranen för att bilda caveloae, tetraspain tvingar membranen att bilda tubuli, ESCRT hjälper till med vesikelbildningen inuti endosomer för att bilda multivesikulära kroppar. Aktin är en stark membranböjare genom polymerisering av aktinfilament som trycker plasmamembranet utåt vilket leder till celexpansioner. Många proteiner som kan kröka plasmamembranet aktiverar också aktinpolymerisation.
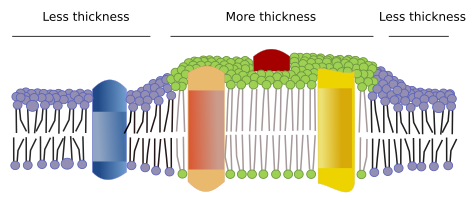
Det finns andra domäner i membranen, fysiska domäner, som bildas av molekyler som transmembranproteiner. Dessa områden uppvisar olika membrantjocklek eftersom de innehåller proteiner med längre hydrofoba aminosyrasekvenser som omges av lipider med längre fettsyrekedjor (figur 7). Dessa proteiner och lipider ”känns” mer bekväma när de är tillsammans eftersom de passar ordentligt sina hydrofoba delar. De bildar membrandomäner som utesluter andra molekyler, antingen proteiner eller lipider, med kortare hydrofoba områden.
Bibliografía
Honigmann A, Pralle A. (2016). Kompartmentalisering av cellmembranet. Journal of mollecular biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Membrankrökning i cellbiologi: en integration av molekylära mekanismer. Journal of cell biology. 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). Hög kolesterol/låg kolesterol: effekter i biologiskamembraner: en översyn Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.