Venerinen nimi: erytromysiinietyylisukkinaatti
Asennusmuoto: tabletti, rakeet oraalisuspensiota varten
Lääketieteellisesti tarkistanut Drugs.com. Viimeksi päivitetty 1.2.2020.
- Yleiskatsaus
- Haittavaikutukset
- Adostus
- Profiili
- Vuorovaikutukset
- Lisätiedot
Ainoastaan reseptilääkkeille
Lääkkeelle vastustuskykyisten bakteereiden kehittymisen vähentämiseksi ja E.E.S.:n ja muiden antibakteeristen lääkkeiden tehon ylläpitämiseksi E.E.S:ää tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden on osoitettu tai vahvasti epäillään olevan bakteerien aiheuttamia.
EES Kuvaus
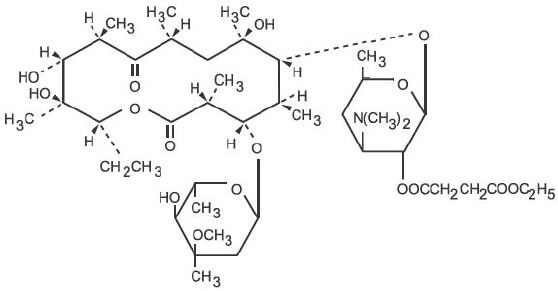
Erythromysiiniä tuottaa Saccharopolyspora erythraea -kanta (aiemmin Streptomyces erythraeus) ja se kuuluu makrolidiantibioottien ryhmään. Se on emäksinen ja muodostaa helposti suoloja happojen kanssa. Emäs, stearaattisuola ja esterit liukenevat huonosti veteen. Erytromysiinietyylisukkinaatti on erytromysiinin esteri, joka soveltuu suun kautta annettavaksi. Erytromysiinietyylisukkinaatti tunnetaan kemiallisesti nimellä erytromysiini 2′-(etyylisukkinaatti). Molekyylikaava on C43H75NO16 ja molekyylipaino on 862,06. Rakennekaava on:
E.E.S. Rakeet on tarkoitettu sekoitettavaksi veteen. Jokainen 5 ml:n teelusikallinen rekonstruoitua kirsikanmakuista suspensiota sisältää erytromysiinietyylisukkinaattia, joka vastaa 200 mg erytromysiiniä.
Mukavanmakuiset, hedelmänmakuiset nesteet toimitetaan valmiina suun kautta annosteltavaksi.
E.E.S. 200 nestemäinen: Jokainen 5 ml:n teelusikallinen hedelmänmakuista suspensiota sisältää erytromysiinietyylisukkinaattia, joka vastaa 200 mg:a erytromysiiniä.
E.E.S. 400 Liquid: Jokainen 5 ml:n teelusikallinen appelsiininmakuista suspensiota sisältää erytromysiinietyylisukkinaattia, joka vastaa 400 mg:aa erytromysiiniä.
Granulaatit ja valmiit suspensiot on tarkoitettu ensisijaisesti pediatriseen käyttöön, mutta niitä voidaan käyttää myös aikuisille.
E.E.S. 400 kalvopäällysteiset tabletit: Jokainen tabletti sisältää erytromysiinietyylisukkinaattia, joka vastaa 400 mg erytromysiiniä.
Kalvopäällysteiset tabletit on tarkoitettu ensisijaisesti aikuisille tai vanhemmille lapsille.
Vaikuttavat aineet
E.E.S. Granulat: Sitruunahappo, FD&C Red No. 3, magnesiumalumiinisilikaatti, natriumkarboksimetyyliselluloosa, natriumsitraatti, sakkaroosi ja keinotekoinen aromi.
E.E.S. 400 kalvopäällysteiset tabletit: Selluloosapolymeerit, makeissokeri (sisältää maissitärkkelystä), maissitärkkelys, D&C Red No. 30, D&C Yellow No. 10, FD&C Red No. 40, magnesiumstearaatti, polakriliinikalium, polyetyleeniglykoli, propyleeniglykoli, natriumsitraatti, sorbiinihappo ja titaanidioksidi.
E.E.E.S. 200 Liquid: FD&C Red No. 40, metyyliparabeeni, polysorbaatti 60, propyyliparabeeni, natriumsitraatti, sakkaroosi, vesi, ksantaanikumi sekä luonnolliset ja keinotekoiset aromit.
E.E.S. 400 Liquid: D&C Yellow No. 10, FD&C Yellow No. 6, metyyliparabeeni, polysorbaatti 60, propyyliparabeeni, natriumsitraatti, sakkaroosi, vesi, ksantaanikumi sekä luontaiset ja keinotekoiset aromit.
EES – Kliininen farmakologia
Suureen suun kautta annosteltavat erytromysiinietyylisukkinaattisuspensiot ja kalvopäällysteiset tablettitabletit imeytyvät helposti ja luotettavasti. Vertailukelpoiset erytromysiinipitoisuudet seerumissa saavutetaan paastotilassa ja ilman paastoa.
Ertromysiini diffundoituu helposti useimpiin kehon nesteisiin. Selkäydinnesteessä saavutetaan tavallisesti vain pieniä pitoisuuksia, mutta lääkkeen kulkeutuminen veri-aivoesteen läpi lisääntyy aivokalvontulehduksessa. Normaalin maksan toiminnan vallitessa erytromysiini konsentroituu maksaan ja erittyy sappeen; maksan toimintahäiriön vaikutusta erytromysiinin erittymiseen maksasta sappeen ei tunneta. Alle 5 prosenttia suun kautta annetusta erytromysiiniannoksesta erittyy aktiivisessa muodossa virtsaan.
Ertromysiini läpäisee istukan esteen, mutta sikiön plasmapitoisuudet ovat pieniä. Lääke erittyy ihmismaitoon.
Mikrobiologia
Vaikutusmekanismi
Ertromysiini vaikuttaa estämällä proteiinisynteesiä sitoutumalla herkkien organismien 50S ribosomaalisiin alayksiköihin. Se ei vaikuta nukleiinihapposynteesiin.
Resistenssi
Resistenssin pääasiallinen reitti on 23S rRNA:n modifioituminen 50S ribosomaalisen alayksikön epäherkkyydeksi, vaikka effluksi voi olla myös merkittävä.
Yhteisvaikutukset muiden mikrobilääkkeiden kanssa
Antagonismia esiintyy in vitro erytromysiinin ja klindamysiinin, lincomysiinin ja kloramfenikolin välillä.
Mikrobilääkeainevaikutus
Ertromysiinin on osoitettu olevan aktiivinen seuraavien mikro-organismien useimpia isolaatteja vastaan sekä in vitro että kliinisissä infektioissa .
Aerobiset bakteerit
Gram-positiiviset bakteerit:
Corynebacterium diphtheriae
Corynebacterium minutissimum
Listeria monocytogenes
Staphylococcus aureus (resistenttejä organismeja voi ilmaantua hoidon aikana)
Streptococcus pneumoniae
Streptococcus pyogenes
Gramminegatiiviset bakteerit:
Bordetella pertussis
Haemophilus influenzae
Legionella pneumophila
Neisseria gonorrhoeae
Muut mikro-organismit:
Chlamydia trachomatis
Entamoeba histolytica
Mycoplasma pneumoniae
Treponema pallidum
Ureaplasma urealyticum
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta. Vähintään 90 prosentilla seuraavista bakteereista on in vitro pienin inhiboiva pitoisuus (MIC), joka on pienempi tai yhtä suuri kuin erytromysiinille herkkä taitekohta vastaavan suvun tai organismiryhmän isolaatteja vastaan. Erytromysiinin tehoa näiden bakteerien aiheuttamien kliinisten infektioiden hoidossa ei kuitenkaan ole osoitettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
Aerobiset bakteerit
Gram-positiiviset bakteerit:
Viridans-ryhmän streptokokit
Gram-negatiiviset bakteerit:
Moraxella catarrhalis
Herkkyystestaus
Erityistietoa herkkyystestien tulkintakriteereistä ja niihin liittyvistä testausmenetelmistä sekä FDA:n tälle lääkkeelle tunnustamista laadunvalvontanormistandardeista, katso: https://www.fda.gov/STIC.
EES:n käyttöaiheet ja käyttö
Lääkkeille vastustuskykyisten bakteerien kehittymisen vähentämiseksi ja E.E.S.:n ja muiden antibakteeristen lääkkeiden tehon ylläpitämiseksi E.E.S.:ää saa käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden on osoitettu tai vahvasti epäillään olevan herkkien bakteerien aiheuttamia. Kun viljely- ja herkkyystietoja on saatavilla, ne on otettava huomioon antibakteerista hoitoa valittaessa tai muutettaessa. Jos tällaisia tietoja ei ole, paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
E.E.S. on tarkoitettu nimettyjen organismien herkkien kantojen aiheuttamien infektioiden hoitoon alla luetelluissa taudeissa:
Olempien hengitysteiden lieviä tai keskivaikea-asteisia infektioita, jotka ovat Streptococcus pyogenesin, Streptococcus pneumoniaen tai Haemophilus influenzaen aiheuttamia (kun sitä käytetään samanaikaisesti riittävien sulfonamidiannosten kanssa, koska monet H. influenzaen kannat eivät ole herkkiä tavanomaisesti saavutettaville erytromysiinipitoisuuksille). (Ks. asianmukaiset sulfonamidien merkintöjä koskevat lääkemääräystiedot.)
Leppoisen tai keskivaikean vaikeusasteen alempien hengitysteiden infektiot, joita aiheuttavat Streptococcus pneumoniae tai Streptococcus pyogenes.
Listeria monocytogenes -bakteerin aiheuttama listerioosi.
Bordetella pertussis -bakteerin aiheuttama hinkuyskä. Erytromysiini poistaa tehokkaasti organismin tartunnan saaneiden henkilöiden nenänielusta, jolloin he eivät ole tartuntakykyisiä. Eräät kliiniset tutkimukset viittaavat siihen, että erytromysiinistä voi olla apua hinkuyskän ennaltaehkäisyssä altistuneilla alttiilla henkilöillä.
Mykoplasma pneumoniae:n aiheuttamat hengitystieinfektiot.
Streptococcus pyogenes:n tai Staphylococcus aureus:n aiheuttamat lievät tai keskivaikeat iho- ja ihorakenteiden infektiot (resistenttejä staflylokokkeja voi ilmaantua hoidon aikana).
Kyypukamat: Corynebacterium diphtheriae -bakteerin aiheuttamat infektiot, antitoksiinin lisänä, kantajien muodostumisen estämiseksi ja organismin hävittämiseksi kantajista.
Erythrasma: Corynebacterium minutissimum -bakteerin aiheuttamien infektioiden hoidossa.
Entamoeba histolytican aiheuttama suolistoamebiaasi (vain suun kautta otettavat erytromysiinit). Extraenteraalinen amebiaasi vaatii hoitoa muilla aineilla.
Neisseria gonorrhoeae:n aiheuttama akuutti lantionpohjan tulehdussairaus: Vaihtoehtoisena lääkkeenä N. gonorrhoeae:n aiheuttaman akuutin lantionpohjan tulehdussairauden hoidossa naispotilailla, joilla on aiemmin todettu herkkyyttä penisilliinille. Potilaille on tehtävä serologinen koe kupan varalta ennen kuin he saavat erytromysiiniä tippurin hoitoon ja serologinen seurantakoe kupan varalta 3 kuukauden kuluttua.
Treponema pallidum -bakteerin aiheuttama kuppa: Erytromysiini on vaihtoehtoinen hoitovaihtoehto primaarisen kupan hoidossa potilailla, jotka ovat allergisia penisilliineille. Primaarisen syfiliksen hoidossa selkäydinnestetutkimukset on tehtävä ennen hoitoa ja osana seurantaa hoidon jälkeen.
Ertromysiinit on tarkoitettu seuraavien Chlamydia trachomatis -bakteerin aiheuttamien infektioiden hoitoon: vastasyntyneen sidekalvotulehdus, imeväisikäisen keuhkokuume ja raskauden aikaiset urogenitaaliset infektiot. Kun tetrasykliinit ovat vasta-aiheisia tai niitä ei siedetä, erytromysiini on tarkoitettu Chlamydia trachomatis -bakteerin aiheuttamien komplisoitumattomien virtsaputki-, endokervikaali- tai peräsuoli-infektioiden hoitoon aikuisilla.
Kun tetrasykliinit ovat vasta-aiheisia tai niitä ei siedetä, erytromysiini on tarkoitettu Ureaplasma urealyticum -bakteerin aiheuttaman ei-nongonokokki-virtsaputken tulehdusinfektion hoitoon.
Legionella pneumophila -bakteerin (Legionella pneumophila) aiheuttama legioonalaistauti: Vaikka kontrolloituja kliinisiä tehokkuustutkimuksia ei ole tehty, in vitro- ja rajalliset alustavat kliiniset tiedot viittaavat siihen, että erytromysiini saattaa olla tehokas legioonalaistaudin hoidossa.
Profylaksia
Reumakuumeen ensimmäisten kohtausten ehkäisy
Amerikkalaisen Sydänliiton mukaan penisilliini on ensisijainen lääke reumakuumeen ensimmäisten kohtausten ehkäisyssä (ylähengitysteiden Streptococcus pyogenes -infektioiden hoito, esim, nielurisatulehdus tai nielutulehdus). Erytromysiini on tarkoitettu penisilliiniallergisten potilaiden hoitoon.1 Terapeuttista annosta on annettava 10 päivän ajan.
Reumakuumeen toistuvien kohtausten ehkäisy
American Heart Association pitää penisilliiniä tai sulfonamideja valintalääkkeinä reumakuumeen toistuvien kohtausten ehkäisyssä. Potilaille, jotka ovat allergisia penisilliinille ja sulfonamideille, American Heart Association suosittelee suun kautta otettavaa erytromysiiniä streptokokki-faryngiitin pitkäaikaisprofylaksiassa (toistuvien reumakuumekohtausten ehkäisemiseksi).1
Vasta-aiheet
Ertromysiini on vasta-aiheinen potilaille, joilla on tunnettu yliherkkyys tälle antibiootille.
Ertromysiini on vasta-aiheinen terfenadiinia, astemitsolia, pimotsidia tai sisapridia käyttäville potilaille (ks. kohta VAROTOIMENPITEET – Lääkkeiden yhteisvaikutukset).
Eritromysiiniä ei saa käyttää samanaikaisesti HMG CoA -reduktaasin estäjien (statiinien) kanssa, jotka metaboloituvat laajasti CYP 3A4:n välityksellä (lovastatiini tai simvastatiini), koska myopatian, mukaan lukien rabdomyolyysin, riski on suurentunut.
Varoitukset
Hepatotoksisuus
Oraalisesti otettavia erytromysiinivalmisteita saaneilla potilailla on raportoitu maksan toimintahäiriöitä, mukaan lukien suurentuneita maksaentsyymejä ja hepatosellulaarista ja/tai kolestaattista hepatiittia, johon on liittynyt tai ei ole liittynyt keltaisuutta.
QT-ajan pidentyminen
Ertromysiiniin on liittynyt QT-välin pidentymistä ja harvinaisia rytmihäiriötapauksia. Markkinoille tulon jälkeisen seurannan aikana on raportoitu spontaanisti torsades de pointes -tapauksia erytromysiiniä saaneilla potilailla. Kuolemantapauksia on raportoitu. Erytromysiiniä on vältettävä potilailla, joilla tiedetään QT-intervallin pidentyneen, potilailla, joilla on jatkuvia rytmihäiriöitä aiheuttavia tiloja, kuten korjaamatonta hypokalemiaa tai hypomagnesemiaa, kliinisesti merkittävää bradykardiaa, ja potilailla, jotka saavat luokan IA (kinidiini, prokaiiniamidi) tai luokan III (dofetilidi, amiodaroni, sotaloli) rytmihäiriölääkkeitä. Iäkkäät potilaat saattavat olla herkempiä lääkkeestä johtuville vaikutuksille QT-väliin.
Syfilis raskauden aikana
On raportoitu, että erytromysiini ei saavuta sikiöön riittävää pitoisuutta estääkseen synnynnäistä syfilistä. Varhaisen syfiliksen vuoksi raskauden aikana suun kautta otettavalla erytromysiinillä hoidettujen naisten synnyttämiä lapsia on hoidettava asianmukaisella penisilliinihoidolla.
Clostridium difficileen liittyvä ripuli
Clostridium difficileen liittyvää ripulia (CDAD, Clostridium difficile associated diarrhea) on raportoitu melkein kaikkien bakteerilääkkeiden, mukaan lukien E.E.S.:n, käytön yhteydessä, ja sen vaikeusaste vaihtelee lieväoireisesta ripulista kuolemaan johtavaan paksusuolen tulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvistoa, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiineja tuottavat C. difficile -kannat aiheuttavat lisääntynyttä sairastuvuutta ja kuolleisuutta, sillä nämä infektiot voivat olla vastustuskykyisiä mikrobilääkehoidolle ja vaatia kolektomian. CDAD on otettava huomioon kaikilla potilailla, joilla esiintyy ripulia antibioottien käytön jälkeen. Huolellinen anamneesi on tarpeen, koska CDAD:n on raportoitu ilmenevän yli kaksi kuukautta antibakteeristen aineiden antamisen jälkeen.
Jos CDAD:tä epäillään tai se on vahvistettu, jatkuva antibioottien käyttö, jota ei ole suunnattu C. difficileä vastaan, on ehkä lopetettava. Asianmukainen neste- ja elektrolyyttihoito, proteiinilisäys, C. difficilen antibioottihoito ja kirurginen arviointi on aloitettava kliinisen tarpeen mukaan.
Lääkeinteraktiot
Potilailla, jotka ovat käyttäneet erytromysiiniä samanaikaisesti CYP3A4:n substraattien kanssa, on raportoitu vakavia haittavaikutuksia. Näitä ovat kolkisiinitoksisuus kolkisiinin kanssa, rabdomyolyysi simvastatiinin, lovastatiinin ja atorvastatiinin kanssa sekä hypotensio CYP3A4:n metaboloimien kalsiumkanavan salpaajien kanssa (esim, verapamiili, amlodipiini, diltiatseemi) (ks. kohta VAROTOIMENPITEET – Yhteisvaikutukset lääkkeiden kanssa).
Kolkisiinitoksisuudesta on saatu markkinoille tulon jälkeisiä raportteja erytromysiinin ja kolkisiinin samanaikaisen käytön yhteydessä. Tämä yhteisvaikutus on mahdollisesti hengenvaarallinen, ja sitä voi esiintyä käytettäessä molempia lääkkeitä suositelluilla annoksilla (ks. KÄYTTÖOHJEET – Lääkeaineiden yhteisvaikutukset).
Rhabdomyolyysiä munuaisten vajaatoiminnan kanssa tai ilman sitä on raportoitu vakavasti sairailla potilailla, jotka ovat saaneet erytromysiiniä samanaikaisesti lovastatiinin kanssa. Siksi samanaikaisesti lovastatiinia ja erytromysiiniä saavien potilaiden kreatiinikinaasi- (CK) ja seerumin transaminaasiarvoja on seurattava huolellisesti. (Katso lovastatiinin pakkausseloste.)
Varotoimet
Yleistä
Erytomysiinin määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai ennaltaehkäisevää käyttöaihetta ei todennäköisesti hyödytä potilasta, ja se lisää lääkkeelle resistenttien bakteerien kehittymisen riskiä.
Koska erytromysiini erittyy pääasiassa maksan kautta, on noudatettava varovaisuutta, kun erytromysiiniä annetaan potilaille, joiden maksan toiminta on heikentynyt (ks. kohdat KLIININEN FARMAKOLOGIA ja VAROITUKSET).
Erytromysiinihoitoa saavilla potilailla on raportoitu myastenia graviksen oireiden pahenemista ja myasteemisen oireyhtymän oireiden ilmaantumista uudelleen.
Erytromysiinihoidon jälkeen on raportoitu imeväisikäisillä esiintyneen infantiilia hypertrofista pylorusstenoosia (IHPS). Eräässä kohortissa, johon kuului 157 vastasyntynyttä, jotka saivat erytromysiiniä hinkuyskäprofylaksian, seitsemälle vastasyntyneelle (5 %) kehittyi oireita, jotka liittyivät ei-juoksevaan oksenteluun tai ärtyneisyyteen ruokinnan yhteydessä, ja sittemmin diagnosoitiin, että heillä oli IHPS, joka vaati kirurgista pyloromyotomiaa. Mahdollinen annos-vaste-ilmiö kuvattiin siten, että IHPS:n absoluuttinen riski oli 5,1 % vauvoilla, jotka käyttivät erytromysiiniä 8-14 päivän ajan, ja 10 % vauvoilla, jotka käyttivät erytromysiiniä 15-21 päivän ajan.2 Koska erytromysiiniä saatetaan käyttää sellaisten sairauksien hoidossa, joihin liittyy merkittävää kuolleisuutta tai sairastuvuutta (kuten hinkuyskä tai vastasyntyneiden Chlamydia trachomatis -infektiot), erytromysiinihoidosta saatava hyöty on suhteutettava mahdolliseen riskiin, joka voi johtaa IHPS:n kehittymiseen. Vanhemmille on kerrottava, että heidän on otettava yhteyttä lääkäriin, jos ilmenee oksentelua tai ärtyneisyyttä ruokinnan yhteydessä.
Pitkäkestoinen tai toistuva erytromysiinin käyttö voi johtaa ei-herkkien bakteerien tai sienten liikakasvuun. Jos superinfektiota esiintyy, erytromysiinihoito on lopetettava ja aloitettava asianmukainen hoito.
Mikäli se on aiheellista, viilto- ja tyhjennysleikkaukset tai muut kirurgiset toimenpiteet on suoritettava antibioottihoidon yhteydessä.
Tietoa potilaille
Potilaille on kerrottava, että bakteerilääkkeitä, mukaan lukien E.E.E.S.:aa, saa käyttää vain bakteeri-infektioiden hoitoon. Niillä ei hoideta virusinfektioita (esim. flunssaa). Kun E.E.S.-valmistetta määrätään bakteeri-infektion hoitoon, potilaille on kerrottava, että vaikka on tavallista, että olo paranee hoidon alkuvaiheessa, lääkitys on otettava täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi (1) heikentää välittömän hoidon tehoa ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssin eivätkä ole tulevaisuudessa hoidettavissa E.E.S:llä tai muilla antibakteerilääkkeillä.
Ripuli on yleinen antibioottien aiheuttama ongelma, joka yleensä loppuu, kun antibiootti lopetetaan. Joskus antibioottihoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristusten ja kuumeen kanssa tai ilman niitä) jopa vielä kahden tai useamman kuukauden kuluttua viimeisen antibioottiannoksen ottamisesta. Jos näin tapahtuu, potilaiden on otettava yhteyttä lääkäriin mahdollisimman pian.
Lääkkeiden yhteisvaikutukset
Teofylliini
Ertromysiinin käyttöön potilailla, jotka saavat suuria teofylliiniannoksia, saattaa liittyä seerumin teofylliinipitoisuuden nousu ja mahdollinen teofylliinitoksisuus. Jos teofylliinitoksisuutta ja/tai kohonneita seerumin teofylliinipitoisuuksia esiintyy, teofylliiniannosta on pienennettävä, kun potilas saa samanaikaisesti erytromysiinihoitoa.
On julkaistu raportteja, jotka viittaavat siihen, että kun oraalista erytromysiiniä annetaan samanaikaisesti teofylliinin kanssa, erytromysiinin seerumipitoisuudet pienenevät noin 35 %. Mekanismia, jolla tämä yhteisvaikutus tapahtuu, ei tunneta. Teofylliinin samanaikaisesta annostelusta johtuva erytromysiinipitoisuuksien pieneneminen saattaa johtaa erytromysiinin subterapeuttisiin pitoisuuksiin.
Verapamiili
Kalsiumkanavan salpaajien lääkeryhmään kuuluvaa verapamiilia samanaikaisesti saavilla potilailla on havaittu hypotensiota, bradyarytmioita ja maitohappoasidoosia.
Digoksiini
Erytromysiinin ja digoksiinin samanaikaisen antamisen on raportoitu johtaneen kohonneisiin digoksiinin seerumipitoisuuksiin.
Antikoagulantit
On raportoitu lisääntyneitä antikoagulanttivaikutuksia, kun erytromysiiniä ja suun kautta otettavia antikoagulantteja on käytetty samanaikaisesti. Erytromysiinin ja erilaisten suun kautta otettavien antikoagulanttien yhteisvaikutuksista johtuvat lisääntyneet antikoagulaatiovaikutukset voivat olla voimakkaampia iäkkäillä.
Ertromysiini on sytokromi p450 -entsyymijärjestelmän (CYP3A) 3A-isomuodon alaryhmän substraatti ja estäjä. Erytromysiinin ja pääasiassa CYP3A:n metaboloiman lääkkeen samanaikaiseen käyttöön voi liittyä lääkeainepitoisuuksien kohoamista, joka voi lisätä tai pidentää sekä samanaikaisen lääkkeen terapeuttisia että haittavaikutuksia. Annoksen mukauttamista voidaan harkita, ja CYP3A:n ensisijaisesti metaboloimien lääkkeiden seerumipitoisuuksia on mahdollisuuksien mukaan seurattava tarkasti potilailla, jotka saavat samanaikaisesti erytromysiiniä.
Seuraavassa on esimerkkejä joistakin kliinisesti merkittävistä CYP3A:han perustuvista lääkeaineinteraktioista. Yhteisvaikutukset muiden CYP3A-isoformin metaboloimien lääkkeiden kanssa ovat myös mahdollisia. Seuraavia CYP3A:han perustuvia lääkeaineinteraktioita on havaittu erytromysiinivalmisteiden kanssa markkinoille tulon jälkeisen kokemuksen perusteella:
Ergotamiini/dihydroergotamiini
Valmisteen markkinoille tulon jälkeisten raporttien mukaan erytromysiinin samanaikaiseen käyttöön ergotamiinin tai dihydroergotamiinin kanssa on liittynyt akuuttia ergotoksisuutta, jolle on ollut ominaista raajojen ja muiden kudosten, mukaan lukien keskushermosto, vasospasmi ja iskemia. Erytromysiinin ja ergotamiinin tai dihydroergotamiinin samanaikainen anto on vasta-aiheista (ks. vasta-aiheet).
Triatsolobentsodiatsepiinit (kuten triatsolaami ja alpratsolaami) ja sukulaisbentsodiatsepiinit
Ertromysiinin on raportoitu pienentävän triatsolaamin ja midatsolaamin puhdistumaa ja näin ollen se saattaa lisätä näiden bentsodiatsepiinien farmakologista vaikutusta.
HMG-CoA-reduktaasin estäjät
Ertromysiinin on raportoitu suurentavan HMG-CoA-reduktaasin estäjien pitoisuuksia (esim, lovastatiini ja simvastatiini). Näitä lääkkeitä samanaikaisesti käyttävillä potilailla on raportoitu harvinaisia rabdomyolyysitapauksia.
Sildenafiili (Viagra)
Ertromysiinin on raportoitu suurentavan sildenafiilin systeemistä altistusta (AUC). Sildenafiiliannoksen pienentämistä on harkittava. (Ks. Viagra-pakkausseloste.)
Erytromysiinin CYP3A-pohjaisista yhteisvaikutuksista siklosporiinin, karbamatsepiinin, takrolimuusin, alfentaniilin, disopyramidin, rifabutiinin, kinidiinin, metyyliprednisolonin, silostatsolin, vinblastiinin ja bromokriptiinin kanssa on spontaaneja tai julkaistuja raportteja.
Erytromysiinin samanaikainen anto sisapridin, pimotsidin, astemitsolin tai terfenadiinin kanssa on vasta-aiheista (ks. vasta-aiheet).
Tämän lisäksi on raportoitu erytromysiinin yhteisvaikutuksia sellaisten lääkkeiden kanssa, joiden ei uskota metaboloituvan CYP3A:n välityksellä, mukaan lukien heksobarbitaali, fenytoiini ja valproaatti.
Ertromysiinin on raportoitu muuttavan merkittävästi ei-sedatoivien antihistamiinien terfenadiinin ja astemitsolin metaboliaa, kun niitä on otettu yhtäaikaisesti. Harvinaisia tapauksia vakavista kardiovaskulaarisista haittavaikutuksista, mukaan lukien elektrokardiografinen QT/QTc-intervallin pidentyminen, sydänpysähdys, torsades de pointes ja muut kammioperäiset rytmihäiriöt, on havaittu (ks. vasta-aiheet). Lisäksi terfenadiinin ja erytromysiinin samanaikaisen annon yhteydessä on raportoitu harvoin kuolemantapauksia.
Markkinoille tulon jälkeen on raportoitu lääkkeiden yhteisvaikutuksista, kun erytromysiiniä on annettu samanaikaisesti sisapridin kanssa, mikä on johtanut QT-ajan pidentymiseen, sydämen rytmihäiriöihin, kammiotakykardiaan, kammiovärinään ja kammiovärinään sekä torsades de pointes -oireyhtymiin, jotka johtuvat todennäköisimmin siitä, että erytromysiini on inhiboijana sisapridin hepaattisessa metaboliassa. Kuolemantapauksia on raportoitu (ks. vasta-aiheet).
Kolkisiini
Kolkisiini on sekä CYP3A4:n että effluksikuljettaja P-glykoproteiinin (P-gp) substraatti. Erytromysiiniä pidetään kohtalaisena CYP3A4:n estäjänä. Kolkisiinin plasmapitoisuuden odotetaan lisääntyvän merkittävästi, kun sitä annetaan samanaikaisesti keskivaikeiden CYP3A4:n estäjien, kuten erytromysiinin, kanssa. Jos kolkisiinin ja erytromysiinin yhteiskäyttö on välttämätöntä, kolkisiinin aloitusannosta on ehkä pienennettävä, ja kolkisiinin enimmäisannosta on pienennettävä. Potilaita on seurattava kolkisiinitoksisuuden kliinisten oireiden varalta (ks. VAROITUKSET).
Lääkkeiden ja laboratoriokokeiden yhteisvaikutukset
Ertromysiini häiritsee virtsan katekoliamiinien fluorometristä määritystä.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikentyminen
Erytromysiinistearaatilla tehdyt pitkäaikaiset oraaliset ruokavaliotutkimukset, jotka tehtiin rotilla enintään 400 mg/kg/vrk ja hiirillä enintään noin 500 mg/kg/vrk (noin 1-2-kertainen ihmisen enimmäisannokseen nähden ruumiinpinta-alaan suhteutettuna), eivät antaneet viitteitä kasvainvaarallisuudesta. Erytromysiinistearaatti ei osoittanut genotoksista potentiaalia Ames- ja hiiren lymfoomamäärityksissä eikä aiheuttanut kromosomipoikkeavuuksia CHO-soluissa. Rotilla, jotka saivat erytromysiinistearaattia suun kautta annosteltuna 700 mg/kg/vrk (noin kolme kertaa ihmisen enimmäisannos kehon pinta-alaan suhteutettuna), ei ollut ilmeistä vaikutusta urosten tai naaraiden hedelmällisyyteen.
Raskaus
Teratogeeniset vaikutukset
Ei ole näyttöä teratogeenisuudesta tai muusta haitallisesta vaikutuksesta lisääntymiseen naarasrotilla, joille annettiin erytromysiinipohjaa suun kautta annosteltuna 350 mg/kg/vrk (noin kaksinkertainen suositeltuun ihmisen enimmäisannokseen nähden elimistön pinta-alaan suhteutettuna) ennen astutusta ja astutuksen aikana, tiineyden aikana ja vieroitukseen asti.
Teratogeenisuudesta tai alkiontoksisuudesta ei havaittu viitteitä, kun erytromysiinipohjaa annettiin suun kautta ruokintana tiineille rotille ja hiirille annoksella 700 mg/kg/vrk ja tiineille kaneille annoksella 125 mg/kg/vrk (noin 1-3 kertaa suurin suositeltu ihmisannos).
Synnytys ja synnytys
Eritromysiinin vaikutusta synnytykseen ja synnytykseen ei tunneta.
Synnyttävät äidit
Eritromysiini erittyy ihmisen maitoon. Varovaisuutta on noudatettava, kun erytromysiiniä annetaan imettävälle naiselle.
Pediatrinen käyttö
Katso kohdat INDIKAATIOT JA KÄYTTÖAIHEET ja ANNOSTUS JA ANNOSTUS.
Geriatrinen käyttö
Iäkkäillä potilailla, erityisesti niillä, joiden munuaisten tai maksan toiminta on heikentynyt, saattaa olla suurentunut riski saada erytromysiinin aiheuttama kuulon heikkeneminen (ks. kohdat HAITTAVAIKUTUKSET ja ANNOSTUS JA KÄYTTÖÖNOTTO).
Iäkkäät potilaat voivat olla alttiimpia torsades de pointes -rytmihäiriöiden kehittymiselle kuin nuoremmat potilaat (ks. VAROITUKSET).
Iäkkäillä potilailla saattaa esiintyä suun kautta otettavan antikoagulanttihoidon lisääntyneitä vaikutuksia erytromysiinihoidon aikana (ks. VAROTOIMENPITEET – Lääkeaineiden yhteisvaikutukset).
E.E.S.® Granules sisältää 25,9 mg (1,1 mEq) natriumia yksittäistä annosta kohti.
Geriatrinen väestö saattaa reagoida heikentyneellä natriureesilla suolakuormitukseen. Tällä voi olla kliinistä merkitystä esimerkiksi kongestiivisen sydämen vajaatoiminnan kaltaisten sairauksien kannalta.
E.E.S. 400 kalvopäällysteinen sisältää 47 mg (2 mEq) natriumia tablettia kohti ja 10,0 mg (0,3 mEq) kaliumia tablettia kohti.
Haittavaikutukset
Oraalisesti annosteltavien erytromysiinivalmisteiden tavallisimmat haittavaikutukset ovat maha-suolikanavaan liittyviä haittavaikutuksia, ja ne ovat annostukseen liittyviä. Niitä ovat pahoinvointi, oksentelu, vatsakipu, ripuli ja ruokahaluttomuus. Hepatiitin oireita, maksan toimintahäiriöitä ja/tai poikkeavia maksan toimintakokeiden tuloksia voi esiintyä (ks. kohta VAROITUKSET).
Pseudomembranoottisen koliitin oireiden ilmaantumista voi esiintyä antibakteerisen hoidon aikana tai sen jälkeen (ks. kohta VAROITUKSET).
Ertromysiiniin on liittynyt QT-ajan pidentymistä ja kammioperäisiä rytmihäiriöitä, mukaan lukien kammiotakykardia ja kammiotakykardia (torsades de pointes) (ks. kohta VAROITUKSET).
Allergisia reaktioita nokkosihottumasta (urtikaria) anafylaksiaksiin on esiintynyt. Harvoin on raportoitu ihoreaktioita, jotka vaihtelevat lievistä ihottumista erythema multiformeen, Stevens-Johnsonin oireyhtymään ja toksiseen epidermaaliseen nekrolyysiin.
Erytromysiinin käytön yhteydessä on raportoitu interstitiaalista nefriittiä.
Harvinaisia raportteja haimatulehduksesta ja kouristuksista.
Es on ollut yksittäisiä raportteja palautuvasta kuulon heikkenemisestä, jota on esiintynyt pääasiassa potilailla, joilla on munuaisten vajaatoiminta ja potilailla, jotka ovat saaneet suuria erytromysiiniannoksia.
Yliannostus
Yliannostustapauksissa erytromysiinihoito on lopetettava. Yliannostukseen on puututtava poistamalla imeytymätön lääke nopeasti ja ryhdyttävä kaikkiin muihin asianmukaisiin toimenpiteisiin.
Ertromysiini ei poistu peritoneaalidialyysillä eikä hemodialyysillä.
EES:n annostus ja antotapa
Ertromysiinietyylisukkinaattisuspensiot ja kalvopäällysteiset tabletit voidaan antaa aterioista välittämättä.
Lapset
Ikä, paino ja infektion vaikeusaste ovat tärkeitä tekijöitä oikean annostuksen määrittämisessä. Lievissä tai keskivaikeissa infektioissa erytromysiinietyylisukkinaatin tavanomainen annos lapsille on 30-50 mg/kg/vrk tasaisesti jaettuina annoksina 6 tunnin välein. Vaikeammissa infektioissa tämä annos voidaan kaksinkertaistaa. Jos halutaan annostella kahdesti vuorokaudessa, puolet koko vuorokausiannoksesta voidaan antaa 12 tunnin välein. Annokset voidaan antaa myös kolme kertaa vuorokaudessa antamalla kolmasosa vuorokauden kokonaisannoksesta 8 tunnin välein.
Seuraavaa annosteluaikataulua suositellaan lieviin tai keskivaikeisiin infektioihin:
| Kehon paino | Kokonaisvuorokausiannos | |
|---|---|---|
| Alle 10 lbs | 30… 50 mg/kg/vrk 15-25 mg/kg/vrk |
|
| 10-15 lbs | 200 mg | |
| 16-25 lbs | 400 mg | |
| 26 – 50 lbs | 800 mg | |
| 51 – 100 lbs | 1200 mg | |
| yli 100 lbs. lbs | 1600 mg |
Aikuiset
400 mg erytromysiinietyylisukkinaattia 6 tunnin välein on tavanomainen annos. Annosta voidaan nostaa jopa 4 g:aan vuorokaudessa infektion vaikeusasteen mukaan. Jos halutaan annostella kahdesti vuorokaudessa, puolet koko vuorokausiannoksesta voidaan antaa 12 tunnin välein. Annokset voidaan antaa myös kolme kertaa vuorokaudessa antamalla kolmasosa vuorokauden kokonaisannoksesta 8 tunnin välein.
Aikuisten annoksen laskemisessa käytetään suhdetta 400 mg erytromysiiniaktiivisuutta etyylisukkinaattina ja 250 mg erytromysiiniaktiivisuutta stearaattina, emäksisenä aineena tai estolaattina.
Streptokokki-infektioiden hoidossa terapeuttista erytromysiinietyylisukkinaattiannosta on annettava vähintään 10 päivän ajan. Jatkuvassa streptokokki-infektioiden uusiutumisen estävässä profylaksiassa henkilöillä, joilla on aiemmin ollut reumaattinen sydänsairaus, tavanomainen annos on 400 mg kahdesti vuorokaudessa.
C. trachomatiksen tai U. urealyticumin aiheuttaman virtsaputken tulehduksen hoitoon
800 mg kolme kertaa vuorokaudessa 7 päivän ajan.
Primäärisen syfiliksen hoitoon
Aikuiset
48-64 g annettuna jaettuina annoksina 10-15 päivän ajan.
Suoliperäiseen amebioosiin
Aikuiset
400 mg neljä kertaa vuorokaudessa 10-14 vuorokauden ajan.
Lapset
30-50 mg/kg/vrk jaettuina annoksina 10-14 vuorokauden ajan.
Käyttö hinkuyskään
Vaikka optimaalista annostusta ja kestoa ei ole vahvistettu, raportoiduissa kliinisissä tutkimuksissa käytetyt erytromysiiniannokset olivat 40-50 mg/kg/vrk, annettuna jaettuina annoksina 5-14 päivän ajan.
Legioonalaistaudin hoitoon
Vaikka optimaalisia annoksia ei ole vahvistettu, raportoiduissa kliinisissä tutkimuksissa käytetyt annokset olivat edellä suositeltuja (1,6-4 g vuorokaudessa jaettuina annoksina).
E.E.E.S.-rakeiden sekoitusohjeet
100 ml
Lisää 77 ml vettä ja ravista voimakkaasti. Näin saadaan 100 ml suspensiota.
200 ml
Lisää 154 ml vettä ja ravista voimakkaasti. Näin saadaan 200 ml suspensiota.
Miten EES toimitetaan
E.E.S. Granules 200 mg / 5 ml (erytromysiinietyylisukkinaatti oraalisuspensiota varten, USP) on vaaleanpunaisia rakeita, joissa on kirsikan tuoksu, ja ne toimitetaan 100 ml:n (NDC 24338-134-02) ja 200 ml:n (NDC 24338-136-10) kokoisissa pulloissa. Valmistuksen jälkeen E.E.S. Granules muuttuu vaaleanpunaiseksi läpinäkymättömäksi suspensioksi, jossa on kirsikan aromi.
E.E.S.. 400 kalvopäällysteiset tabletit (erytromysiinietyylisukkinaattitabletit, USP) 400 mg, toimitetaan vaaleanpunaisina soikeina tabletteina, joihin on painettu kaksikirjaiminen merkintä EE, seuraavissa pakkauksissa:
30 kappaleen pulloissa (NDC 24338-100-03) 100 kappaleen pulloissa (NDC 24338-100-13)
Suositeltu säilytys
Varastoitava lämpötilassa, jossa lämpötila on 20°-25° C .
Varastoidaan rakeet ennen sekoittamista 20°-25°C:ssa (68°-77°F) . Sekoittamisen jälkeen jäähdytä ja käytä 10 päivän kuluessa.
- Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young, the American Heart Association: Prevention of Rheumatic Fever. Circulation. 78(4):1082-1086, lokakuu 1988.
- Honein, M.A., et al.: Infantile hypertrophic pyloric stenosis after pertussis prophylaxis with erythromycin: a case review and cohort study. The Lancet 1999:354 (9196): 2101-5.
Korjattu: Huhtikuu 2018
EES-PI-03
Arbor Pharmaceuticals, LLC
Atlanta, GA 30328
(No. 5729, 6369)
PÄÄLLYSTIEDOTE – 400 mg:n tablettipullon etiketti
NDC 24338-100-03
30 tablettia
E.E.S.. 400®
Kalvopäällysteiset tabletit
ERYTHROMYCIN
ETYLSUKKINAATTI
TABLETIT, USP
400 mg
Erythromycin
aktiivisuus
Vain
Rx, LLC

ESIMERKKIPANEELI – 100 ml:n pullon etiketti
NDC 24338-134-02
100 ml (sekoitettuna)
suun kautta annettavaan suspensioon
E.E.S.® Granules
ERYTHROMYCIN
ETYLSUCCINATE FOR
ORAL SUSPENSION, USP
Erythromycin activity
200 mg per 5 ml
when reconstituted
Rx only
arbor®
PHARMACEUTICALS, INC.

ESIMERKKIPAKKAUSSELOSTE – 5 ml:n pullon etiketti
NDC 24338-136-10
200 ml (sekoitettuna)
oraalisuspensiota varten
E.E.S.® Granules
ERYTHROMYCIN
ETYLSUCCINATE FOR
ORAL SUSPENSION, USP
Erythromycin activity
200 mg per 5 ml
when reconstituted
Rx only
arbor®
PHARMACEUTICALS, INC.

| E.E.S 400 erytromysiinietyylisukkinaattitabletti |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
| E.E.24338-134 | |||
| Antamistapa | ORAL | DEA Schedule |
| Aktiivinen ainesosa/aktiivinen osa | ||
| Ainesosan nimi | Vahvuuden perusta | Vahvuus |
| Erythromycin Etyylisukkinaatti (erytromysiini) | Erytromysiini | 200 mg 5 ml:ssa |
| Inaktiivinen Ainesosat | ||
| Ainesosan nimi | Vahvuus | |
| Sitruunahappomonohydraatti | ||
| FD&C Red No. 3 | ||
| magnesiumalumiinisilikaatti | ||
| karboksimetyyliselluloosa natrium, määrittelemätön muoto | ||
| NATRIUMSITRAATTI, määrittelemätön muoto | ||
| sakkaroosi | ||
| Pakkaus | |||
| # | Item Code | Package Description | |
| 1 | NDC:24338-134-02 | 100 ml 1 pullossa | |
| Myyntitiedot | |||
| Myyntikategoria | Sovellusnumero tai monografia. Sitaatti | Markkinoinnin alkamispäivä | Markkinoinnin päättymispäivä |
| NDA | NDA050207 | 04/18/2011 | |
| E.E.24338-136 | |||
| Valmistustapa | ORAL | DEA Schedule |
| Aktiivinen ainesosa/aktiivinen osa | ||
| Ainesosan nimi | Vahvuuden perusta | Vahvuus |
| Erythromycin Etyylisukkinaatti (erytromysiini) | Erytromysiini | 200 mg 5 ml:ssa |
| Inaktiivinen Ainesosat | ||
| Ainesosan nimi | Vahvuus | |
| Sitruunahappomonohydraatti | ||
| FD&C Red No. 3 | ||
| magnesiumalumiinisilikaatti | ||
| karboksimetyyliselluloosa natrium, määrittelemätön muoto | ||
| NATRIUMSITRAATTI, määrittelemätön muoto | ||
| sakkaroosi | ||
| Pakkaus | |||
| # | Item Code | Package Description | |
| 1 | NDC:24338-136-10 | 200 ml 1 pullossa | |
| Myyntitiedot | ||||
| Myyntitiedot | Myyntikategoria | Sovellusnumero tai monografia. Citation | Markkinoinnin alkamispäivä | Markkinoinnin päättymispäivä |
| NDA | NDA050207 | 04/18/2011 | ||
Etikettien – Arbor Pharmaceuticals, Inc. (781796417)
Tiheästi kysyttyjä kysymyksiä
- Kannattaako antibiootteja ottaa raskaana ollessa?
Lisätietoa EES:stä. Granules (erytromysiini)
- Haittavaikutukset
- Raskauden tai imetyksen aikana
- Asetustiedot
- Lääkkeiden yhteisvaikutukset
- Hinnoittelu &Kuponkeja
- En Español
- Lääkeluokka: Makrolidit
Kuluttajan resurssit
- Lisälukemisto
Ammattilaisen resurssit
- Valmisteyhteenvedot
- Erythromysiinitabletit (FDA)
Muut tuotemerkit Ery-Tab, EryPed, Erythrocin, Eryc, PCE Dispertab
Seuraavat hoito-ohjeet
- Bakteeriperäisen endokardiitin ehkäisy
- Bartonelloosi
- Suolikanavan valmiste
- Bronkiitti
- … +21 lisää
Lääketieteellinen vastuuvapauslauseke