Nombre genérico: etilsuccinato de eritromicina
Forma farmacéutica: comprimido, gránulo para suspensión oral
Revisado médicamente por Drugs.com. Última actualización: 1 de febrero de 2020.
- Descripción general
- Efectos secundarios
- Dosificación
- Profesional
- Interacciones
- Más
Sólo Rx
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de E.E.S. y de otros fármacos antibacterianos, E.E.E.S. debe utilizarse únicamente para tratar o prevenir las infecciones que se ha demostrado o se sospecha fuertemente que están causadas por bacterias.
EES Descripción
La eritromicina es producida por una cepa de Saccharopolyspora erythraea (anteriormente Streptomyces erythraeus) y pertenece al grupo de antibióticos macrólidos. Es básico y forma fácilmente sales con ácidos. La base, la sal de estearato y los ésteres son poco solubles en agua. El etilsuccinato de eritromicina es un éster de eritromicina adecuado para la administración oral. El etilsuccinato de eritromicina se conoce químicamente como eritromicina 2′-(etilsuccinato). La fórmula molecular es C43H75NO16 y el peso molecular es 862,06. La fórmula estructural es:
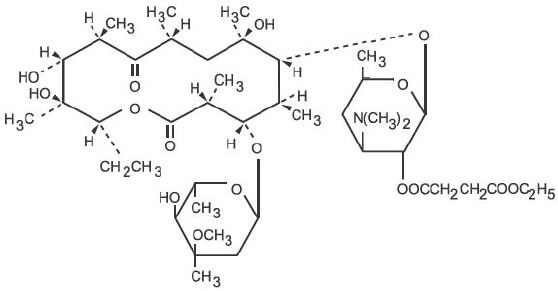
E.E.S. Los gránulos están destinados a ser reconstituidos con agua. Cada cucharadita de 5 ml de suspensión reconstituida con sabor a cereza contiene etilsuccinato de eritromicina equivalente a 200 mg de eritromicina.
Los líquidos de agradable sabor a fruta se suministran listos para su administración oral.
E.E.S. 200 Líquido: Cada cucharadita de 5 ml de suspensión con sabor a fruta contiene etilsuccinato de eritromicina equivalente a 200 mg de eritromicina.
E.E.S. 400 Líquido: Cada cucharadita de 5 mL de suspensión con sabor a naranja contiene etilsuccinato de eritromicina equivalente a 400 mg de eritromicina.
Los gránulos y las suspensiones preparadas están destinados principalmente a uso pediátrico pero también pueden utilizarse en adultos.
E.E.S. 400 comprimidos recubiertos con película: Cada comprimido contiene etilsuccinato de eritromicina equivalente a 400 mg de eritromicina.
Los comprimidos recubiertos con película están destinados principalmente a adultos o niños mayores.
Ingredientes inactivos
E.E.S. Gránulos: Ácido cítrico, FD&C Rojo nº 3, silicato de aluminio y magnesio, carboximetilcelulosa de sodio, citrato de sodio, sacarosa y aroma artificial.
E.E.S. 400 comprimidos recubiertos con película: Polímeros celulósicos, azúcar de confitería (contiene almidón de maíz), almidón de maíz, D&C Rojo nº 30, D&C Amarillo nº 10, FD&C Rojo nº 40, estearato de magnesio, polacrilina potásica, polietilenglicol, propilenglicol, citrato de sodio, ácido sórbico y dióxido de titanio.
E.E.S. 200 líquido: FD&C Rojo nº 40, metilparabeno, polisorbato 60, propilparabeno, citrato de sodio, sacarosa, agua, goma xantana y aromas naturales y artificiales.
E.E.S. 400 Líquido: D&C Amarillo nº 10, FD&C Amarillo nº 6, metilparabeno, polisorbato 60, propilparabeno, citrato de sodio, sacarosa, agua, goma xantana y aromas naturales y artificiales.
EES – Farmacología clínica
Las suspensiones de etilsuccinato de eritromicina administradas por vía oral y los comprimidos recubiertos con película se absorben de forma fácil y fiable. Se alcanzan niveles séricos comparables de eritromicina en los estados de ayuno y no ayuno.
La eritromicina se difunde fácilmente en la mayoría de los fluidos corporales. Normalmente sólo se alcanzan concentraciones bajas en el líquido cefalorraquídeo, pero el paso del fármaco a través de la barrera hematoencefálica aumenta en la meningitis. En presencia de una función hepática normal, la eritromicina se concentra en el hígado y se excreta en la bilis; se desconoce el efecto de la disfunción hepática en la excreción de eritromicina por el hígado en la bilis. Menos del 5% de la dosis de eritromicina administrada por vía oral se excreta en forma activa en la orina.
La eritromicina atraviesa la barrera placentaria, pero los niveles plasmáticos fetales son bajos. El fármaco se excreta en la leche humana.
Microbiología
Mecanismo de acción
La eritromicina actúa por inhibición de la síntesis de proteínas al unirse a las subunidades ribosomales 50S de los organismos susceptibles. No afecta a la síntesis de ácidos nucleicos.
Resistencia
La principal vía de resistencia es la modificación del ARNr 23S de la subunidad ribosomal 50S hasta la insensibilidad, aunque el eflujo también puede ser significativo.
Interacciones con otros antimicrobianos
Existe antagonismo in vitro entre la eritromicina y la clindamicina, la lincomicina y el cloranfenicol.
Actividad antimicrobiana
La eritromicina ha demostrado ser activa frente a la mayoría de los aislados de los siguientes microorganismos tanto in vitro como en infecciones clínicas .
Bacterias aerobias
Bacterias grampositivas:
Corynebacterium diphtheriae
Corynebacterium minutissimum
Listeria monocytogenes
Staphylococcus aureus (pueden aparecer organismos resistentes durante el tratamiento)
Streptococcus pneumoniae
Streptococcus pyogenes
Bacterias gramnegativas:
Bordetella pertussis
Haemophilus influenzae
Legionella pneumophila
Neisseria gonorrhoeae
Otros microorganismos:
Chlamydia trachomatis
Entamoeba histolytica
Mycoplasma pneumoniae
Treponema pallidum
Ureaplasma urealyticum
Se dispone de los siguientes datos in vitro, pero se desconoce su importancia clínica. Al menos el 90 por ciento de las siguientes bacterias presentan una concentración inhibitoria mínima (CIM) in vitro inferior o igual al punto de ruptura de susceptibilidad para la eritromicina frente a aislados de género o grupo de organismos similares. Sin embargo, la eficacia de la eritromicina en el tratamiento de infecciones clínicas causadas por estas bacterias no se ha establecido en ensayos clínicos adecuados y bien controlados.
Bacterias aerobias
Bacterias grampositivas:
Estreptococos del grupo Viridans
Bacterias gramnegativas:
Moraxella catarrhalis
Pruebas de susceptibilidad
Para información específica sobre los criterios de interpretación de las pruebas de susceptibilidad y los métodos de prueba asociados y las normas de control de calidad reconocidas por la FDA para este medicamento, consulte: https://www.fda.gov/STIC.
Indicaciones y uso de E.E.S.
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de E.E.S. y otros medicamentos antibacterianos, E.E.S. debe utilizarse únicamente para tratar o prevenir infecciones que se haya demostrado o se sospeche firmemente que están causadas por bacterias susceptibles. Cuando se disponga de información sobre el cultivo y la susceptibilidad, deben tenerse en cuenta a la hora de seleccionar o modificar el tratamiento antibacteriano. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
E.E.S. está indicado en el tratamiento de infecciones causadas por cepas susceptibles de los organismos designados en las enfermedades enumeradas a continuación:
Infecciones del tracto respiratorio superior de grado leve a moderado causadas por Streptococcus pyogenes, Streptococcus pneumoniae o Haemophilus influenzae (cuando se utiliza de forma concomitante con dosis adecuadas de sulfonamidas, ya que muchas cepas de H. influenzae no son susceptibles a las concentraciones de eritromicina que se alcanzan habitualmente). (Véase la información de prescripción en la etiqueta de la sulfonamida correspondiente.)
Infecciones del tracto respiratorio inferior de gravedad leve a moderada causadas por Streptococcus pneumoniae o Streptococcus pyogenes.
Listeriosis causada por Listeria monocytogenes.
Tos ferina (tos ferina) causada por Bordetella pertussis. La eritromicina es eficaz para eliminar el organismo de la nasofaringe de los individuos infectados haciéndolos no infecciosos. Algunos estudios clínicos sugieren que la eritromicina puede ser útil en la profilaxis de la tos ferina en individuos susceptibles expuestos.
Infecciones del tracto respiratorio debidas a Mycoplasma pneumoniae.
Infecciones de la piel y de las estructuras de la piel de gravedad leve a moderada causadas por Streptococcus pyogenes o Staphylococcus aureus (pueden aparecer estafilococos resistentes durante el tratamiento).
Difteria: Infecciones debidas a Corynebacterium diphtheriae, como complemento de la antitoxina, para prevenir el establecimiento de portadores y para erradicar el organismo en los portadores.
Eritrasma: En el tratamiento de infecciones debidas a Corynebacterium minutissimum.
Amebiasis intestinal causada por Entamoeba histolytica (sólo eritromicinas orales). La amebiasis extraentérica requiere tratamiento con otros agentes.
Enfermedad inflamatoria pélvica aguda causada por Neisseria gonorrhoeae: Como fármaco alternativo en el tratamiento de la enfermedad inflamatoria pélvica aguda causada por N. gonorrhoeae en pacientes mujeres con antecedentes de sensibilidad a la penicilina. Los pacientes deben someterse a una prueba serológica para la sífilis antes de recibir eritromicina como tratamiento de la gonorrea y a una prueba serológica de seguimiento para la sífilis después de 3 meses.
Sífilis causada por Treponema pallidum: La eritromicina es una opción alternativa de tratamiento para la sífilis primaria en pacientes alérgicos a las penicilinas. En el tratamiento de la sífilis primaria, deben realizarse exámenes del líquido cefalorraquídeo antes del tratamiento y como parte del seguimiento después de la terapia.
Las eritromicinas están indicadas para el tratamiento de las siguientes infecciones causadas por Chlamydia trachomatis: conjuntivitis del recién nacido, neumonía de la infancia e infecciones urogenitales durante el embarazo. Cuando las tetraciclinas están contraindicadas o no se toleran, la eritromicina está indicada para el tratamiento de infecciones uretrales, endocervicales o rectales no complicadas en adultos debidas a Chlamydia trachomatis.
Cuando las tetraciclinas están contraindicadas o no se toleran, la eritromicina está indicada para el tratamiento de la uretritis no onocócica causada por Ureaplasma urealyticum.
Enfermedad del legionario causada por Legionella pneumophila: Aunque no se han realizado estudios de eficacia clínica controlada, los datos clínicos preliminares in vitro y limitados sugieren que la eritromicina puede ser eficaz en el tratamiento de la enfermedad del legionario.
Profilaxis
Prevención de los ataques iniciales de fiebre reumática
La Asociación Americana del Corazón considera que la penicilina es el fármaco de elección en la prevención de los ataques iniciales de fiebre reumática (tratamiento de las infecciones por Streptococcus pyogenes del tracto respiratorio superior, por ejemplo, amigdalitis o faringitis). La eritromicina está indicada para el tratamiento de pacientes alérgicos a la penicilina.1 La dosis terapéutica debe administrarse durante 10 días.
Prevención de ataques recurrentes de fiebre reumática
La Asociación Americana del Corazón considera que la penicilina o las sulfonamidas son los fármacos de elección en la prevención de ataques recurrentes de fiebre reumática. En los pacientes alérgicos a la penicilina y a las sulfonamidas, la Asociación Americana del Corazón recomienda la eritromicina oral en la profilaxis a largo plazo de la faringitis estreptocócica (para la prevención de ataques recurrentes de fiebre reumática).1
Contraindicaciones
La eritromicina está contraindicada en pacientes con hipersensibilidad conocida a este antibiótico.
La eritromicina está contraindicada en pacientes que toman terfenadina, astemizol, pimozida o cisaprida (ver PRECAUCIONES – Interacciones medicamentosas).
No utilizar eritromicina concomitantemente con inhibidores de la HMG CoA reductasa (estatinas) que se metabolizan extensamente por el CYP 3A4 (lovastatina o simvastatina), debido al mayor riesgo de miopatía, incluyendo rabdomiólisis.
Advertencias
Hepatotoxicidad
Se han notificado casos de disfunción hepática, incluyendo aumento de las enzimas hepáticas, y hepatitis hepatocelular y/o colestásica, con o sin ictericia, que se producen en pacientes que reciben productos de eritromicina oral.
Prolongación del QT
La eritromicina se ha asociado con la prolongación del intervalo QT y con casos poco frecuentes de arritmia. Se han notificado espontáneamente casos de torsades de pointes durante la vigilancia posterior a la comercialización en pacientes que recibían eritromicina. Se han notificado casos mortales. La eritromicina debe evitarse en pacientes con prolongación conocida del intervalo QT, en pacientes con condiciones proarrítmicas en curso como hipopotasemia o hipomagnesemia no corregidas, bradicardia clínicamente significativa y en pacientes que reciben agentes antiarrítmicos de clase IA (quinidina, procainamida) o clase III (dofetilida, amiodarona, sotalol). Los pacientes de edad avanzada pueden ser más susceptibles a los efectos asociados al fármaco sobre el intervalo QT.
Sífilis en el embarazo
Hay informes que sugieren que la eritromicina no llega al feto en una concentración adecuada para prevenir la sífilis congénita. Los bebés nacidos de mujeres tratadas durante el embarazo con eritromicina oral para la sífilis temprana deben ser tratados con un régimen apropiado de penicilina.
Diarrea asociada a Clostridium difficile
Se ha notificado diarrea asociada a Clostridium difficile (DACD) con el uso de casi todos los agentes antibacterianos, incluido el E.E.S., y puede variar en gravedad desde una diarrea leve hasta una colitis mortal. El tratamiento con agentes antibacterianos altera la flora normal del colon, lo que conduce a un crecimiento excesivo de C. difficile.
C. difficile produce toxinas A y B que contribuyen al desarrollo de la CDAD. Las cepas de C. difficile que producen hipertoxinas causan una mayor morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias al tratamiento antimicrobiano y pueden requerir una colectomía. La CDAD debe considerarse en todos los pacientes que presentan diarrea tras el uso de antibióticos. Es necesaria una historia clínica cuidadosa, ya que se ha informado de que la DAC ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o se confirma la DAC, puede ser necesario interrumpir el uso de antibióticos no dirigidos contra C. difficile. Debe establecerse un tratamiento adecuado de líquidos y electrolitos, suplementos proteicos, tratamiento antibiótico de C. difficile y evaluación quirúrgica según esté clínicamente indicado.
Interacciones medicamentosas
Se han notificado reacciones adversas graves en pacientes que toman eritromicina concomitantemente con sustratos del CYP3A4. Estas incluyen toxicidad con colchicina; rabdomiólisis con simvastatina, lovastatina y atorvastatina; e hipotensión con bloqueadores de los canales de calcio metabolizados por el CYP3A4 (p. ej, verapamilo, amlodipino, diltiazem) (ver PRECAUCIONES – Interacciones con otros medicamentos).
Ha habido informes posteriores a la comercialización de toxicidad por colchicina con el uso concomitante de eritromicina y colchicina. Esta interacción es potencialmente peligrosa para la vida, y puede ocurrir mientras se usan ambos medicamentos a sus dosis recomendadas (ver PRECAUCIONES – Interacciones con otros medicamentos).
Se han notificado casos de rabdomiólisis con o sin insuficiencia renal en pacientes gravemente enfermos que reciben eritromicina de forma concomitante con lovastatina. Por lo tanto, los pacientes que reciban lovastatina y eritromicina de forma concomitante deben ser controlados cuidadosamente en cuanto a los niveles de creatina quinasa (CK) y transaminasas séricas. (Véase el prospecto de lovastatina.)
Precauciones
Generales
La prescripción de E.E.S. en ausencia de una infección bacteriana probada o fuertemente sospechada o de una indicación profiláctica es poco probable que proporcione beneficio al paciente y aumenta el riesgo de desarrollo de bacterias resistentes al medicamento.
Dado que la eritromicina se excreta principalmente por el hígado, se debe tener precaución cuando se administre eritromicina a pacientes con la función hepática deteriorada (ver secciones FARMACOLOGÍA CLÍNICA y ADVERTENCIAS).
Se ha notificado la exacerbación de los síntomas de la miastenia gravis y la aparición de nuevos síntomas del síndrome miasténico en pacientes que reciben tratamiento con eritromicina.
Se han notificado casos de estenosis pilórica hipertrófica infantil (EIPS) en bebés tras el tratamiento con eritromicina. En una cohorte de 157 recién nacidos a los que se les administró eritromicina para la profilaxis de la tos ferina, siete neonatos (5%) desarrollaron síntomas de vómitos no biliosos o irritabilidad con la alimentación y posteriormente se les diagnosticó una EIPH que requirió una piloromiotomía quirúrgica. Se describió un posible efecto dosis-respuesta con un riesgo absoluto de SPI del 5,1% para los lactantes que tomaron eritromicina durante 8 a 14 días y del 10% para los lactantes que tomaron eritromicina durante 15 a 21 días.2 Dado que la eritromicina puede utilizarse en el tratamiento de afecciones en lactantes que se asocian con una mortalidad o morbilidad significativas (como la tos ferina o las infecciones neonatales por Chlamydia trachomatis), es necesario sopesar el beneficio del tratamiento con eritromicina frente al riesgo potencial de desarrollar SPI. Se debe informar a los padres para que se pongan en contacto con su médico si se producen vómitos o irritabilidad con la alimentación.
El uso prolongado o repetido de eritromicina puede dar lugar a un crecimiento excesivo de bacterias u hongos no susceptibles. Si se produce una sobreinfección, debe suspenderse la eritromicina e instituirse una terapia adecuada.
Cuando esté indicado, la incisión y el drenaje u otros procedimientos quirúrgicos deben realizarse junto con la terapia antibiótica.
Información para los pacientes
Se debe aconsejar a los pacientes que los medicamentos antibacterianos, incluido el E.E.S., sólo deben utilizarse para tratar infecciones bacterianas. No tratan las infecciones víricas (por ejemplo, el resfriado común). Cuando se prescribe E.E.S. para tratar una infección bacteriana, se debe informar a los pacientes de que, aunque es habitual sentirse mejor al principio del tratamiento, la medicación debe tomarse exactamente como se indica. Saltarse dosis o no completar el curso completo de la terapia puede (1) disminuir la eficacia del tratamiento inmediato y (2) aumentar la probabilidad de que las bacterias desarrollen resistencia y no sean tratables con E.E.S. u otros fármacos antibacterianos en el futuro.
La diarrea es un problema común causado por los antibióticos que suele terminar cuando se suspende el antibiótico. A veces, después de iniciar el tratamiento con antibióticos, los pacientes pueden desarrollar heces acuosas y sanguinolentas (con o sin calambres de estómago y fiebre) incluso hasta dos o más meses después de haber tomado la última dosis del antibiótico. Si esto ocurre, los pacientes deben ponerse en contacto con su médico lo antes posible.
Interacciones con otros medicamentos
Teofilina
El uso de la eritromicina en pacientes que están recibiendo dosis elevadas de teofilina puede asociarse a un aumento de los niveles séricos de teofilina y a una potencial toxicidad por teofilina. En caso de toxicidad por teofilina y/o niveles elevados de teofilina en suero, la dosis de teofilina debe reducirse mientras el paciente esté recibiendo un tratamiento concomitante de eritromicina.
Se han publicado informes que sugieren que cuando la eritromicina oral se administra simultáneamente con teofilina se produce una disminución de las concentraciones séricas de eritromicina de aproximadamente un 35%. Se desconoce el mecanismo por el que se produce esta interacción. La disminución de las concentraciones de eritromicina debida a la coadministración de teofilina podría dar lugar a concentraciones subterapéuticas de eritromicina.
Verapamilo
Se ha observado hipotensión, bradiarritmias y acidosis láctica en pacientes que reciben simultáneamente verapamilo, perteneciente a la clase de fármacos antagonistas del calcio.
Digoxina
Se ha notificado que la administración concomitante de eritromicina y digoxina da lugar a niveles séricos elevados de digoxina.
Anticoagulantes
Se ha notificado un aumento de los efectos anticoagulantes cuando la eritromicina y los anticoagulantes orales se utilizan de forma concomitante. El aumento de los efectos anticoagulantes debido a las interacciones de la eritromicina con diversos anticoagulantes orales puede ser más pronunciado en los ancianos.
La eritromicina es un sustrato e inhibidor de la subfamilia de la isoforma 3A del sistema enzimático del citocromo p450 (CYP3A). La coadministración de eritromicina y un fármaco metabolizado principalmente por el CYP3A puede asociarse con elevaciones de las concentraciones del fármaco que podrían aumentar o prolongar los efectos terapéuticos y adversos del fármaco concomitante. Se pueden considerar ajustes de la dosis y, cuando sea posible, las concentraciones séricas de los fármacos metabolizados principalmente por el CYP3A deben vigilarse estrechamente en los pacientes que reciban simultáneamente eritromicina.
Los siguientes son ejemplos de algunas interacciones farmacológicas clínicamente significativas basadas en el CYP3A. También son posibles las interacciones con otros medicamentos metabolizados por la isoforma CYP3A. Se han observado las siguientes interacciones farmacológicas basadas en el CYP3A con productos de eritromicina en la experiencia posterior a la comercialización:
Ergotamina/dihidroergotamina
Los informes posteriores a la comercialización indican que la coadministración de eritromicina con ergotamina o dihidroergotamina se ha asociado con una toxicidad aguda del cornezuelo de centeno caracterizada por vasoespasmo e isquemia de las extremidades y otros tejidos, incluido el sistema nervioso central. La administración concomitante de eritromicina con ergotamina o dihidroergotamina está contraindicada (ver CONTRAINDICACIONES).
Triazolobenzodiazepinas (como triazolam y alprazolam) y benzodiazepinas relacionadas
Se ha comunicado que la eritromicina disminuye el aclaramiento de triazolam y midazolam, y por tanto, puede aumentar el efecto farmacológico de estas benzodiazepinas.
Inhibidores de la HMG-CoA reductasa
Se ha notificado que la eritromicina aumenta las concentraciones de los inhibidores de la HMG-CoA reductasa (p. ej, lovastatina y simvastatina). Se han notificado raros casos de rabdomiólisis en pacientes que toman estos medicamentos de forma concomitante.
Sildenafilo (Viagra)
Se ha notificado que la eritromicina aumenta la exposición sistémica (AUC) del sildenafilo. Debe considerarse la reducción de la dosis de sildenafilo. (Ver prospecto de Viagra.)
Se han notificado interacciones espontáneas o publicadas basadas en el CYP3A de la eritromicina con ciclosporina, carbamazepina, tacrolimus, alfentanilo, disopiramida, rifabutina, quinidina, metilprednisolona, cilostazol, vinblastina y bromocriptina.
La administración concomitante de eritromicina con cisaprida, pimozida, astemizol o terfenadina está contraindicada (ver CONTRAINDICACIONES).
Además, se han notificado interacciones de la eritromicina con medicamentos que no se cree que sean metabolizados por el CYP3A, incluyendo el hexobarbital, la fenitoína y el valproato.
Se ha notificado que la eritromicina altera significativamente el metabolismo de los antihistamínicos no sedantes terfenadina y astemizol cuando se toman de forma concomitante. Se han observado raros casos de efectos adversos cardiovasculares graves, incluyendo prolongación electrocardiográfica del intervalo QT/QTc, paro cardíaco, torsades de pointes y otras arritmias ventriculares (ver CONTRAINDICACIONES). Además, se han notificado raramente muertes con la administración concomitante de terfenadina y eritromicina.
Ha habido informes posteriores a la comercialización de interacciones farmacológicas cuando la eritromicina es coadministrada con cisaprida, resultando en prolongación del QT, arritmias cardíacas, taquicardia ventricular, fibrilación ventricular y torsades de pointes, muy probablemente debido a la inhibición del metabolismo hepático de cisaprida por la eritromicina. Se han notificado casos mortales (ver CONTRAINDICACIONES).
Colchicina
La colchicina es un sustrato tanto para el CYP3A4 como para el transportador de eflujo P-glicoproteína (P-gp). La eritromicina se considera un inhibidor moderado del CYP3A4. Se prevé un aumento significativo de la concentración plasmática de colchicina cuando se coadministra con inhibidores moderados del CYP3A4 como la eritromicina. Si es necesaria la coadministración de colchicina y eritromicina, puede ser necesario reducir la dosis inicial de colchicina y disminuir la dosis máxima de colchicina. Se debe vigilar a los pacientes para detectar síntomas clínicos de toxicidad de la colchicina (ver ADVERTENCIAS).
Interacciones entre el medicamento y las pruebas de laboratorio
La eritromicina interfiere con la determinación fluorométrica de las catecolaminas urinarias.
Carcinogénesis, mutagénesis, alteración de la fertilidad
Los estudios dietéticos orales a largo plazo realizados con estearato de eritromicina en ratas hasta 400 mg/kg/día y en ratones hasta unos 500 mg/kg/día (aproximadamente 1 o 2 veces la dosis máxima en humanos en base a la superficie corporal) no aportaron pruebas de tumorigenicidad. El estearato de eritromicina no mostró potencial genotóxico en los ensayos de Ames y de linfoma de ratón ni indujo aberraciones cromosómicas en células CHO. No hubo efectos aparentes sobre la fertilidad de machos y hembras en ratas tratadas con eritromicina base por vía oral a 700 mg/kg/día (aproximadamente 3 veces la dosis máxima en humanos en base a la superficie corporal).
Embarazo
Efectos teratogénicos
No existen pruebas de teratogenicidad ni de ningún otro efecto adverso sobre la reproducción en ratas hembras alimentadas con eritromicina base por vía oral a 350 mg/kg/día (aproximadamente el doble de la dosis máxima recomendada para humanos en función de la superficie corporal) antes y durante el apareamiento, durante la gestación y hasta el destete.
No se observaron evidencias de teratogenicidad o embriotoxicidad cuando se administró eritromicina base por vía oral a ratas y ratones preñados a 700 mg/kg/día y a conejos preñados a 125 mg/kg/día (aproximadamente de 1 a 3 veces la dosis máxima recomendada en humanos).
Parto y nacimiento
Se desconoce el efecto de la eritromicina sobre el parto.
Madres lactantes
La eritromicina se excreta en la leche humana. Se debe tener precaución cuando se administre eritromicina a una mujer en periodo de lactancia.
Uso pediátrico
Ver secciones INDICACIONES Y USO y POSOLOGÍA Y ADMINISTRACIÓN.
Uso geriátrico
Los pacientes de edad avanzada, particularmente aquellos con función renal o hepática reducida, pueden tener un mayor riesgo de desarrollar pérdida de audición inducida por eritromicina (ver REACCIONES ADVERSAS y POSOLOGÍA Y ADMINISTRACIÓN).
Los pacientes de edad avanzada pueden ser más susceptibles al desarrollo de arritmias de torsades de pointes que los pacientes más jóvenes (ver ADVERTENCIAS).
Los pacientes de edad avanzada pueden experimentar un aumento de los efectos de la terapia anticoagulante oral mientras están en tratamiento con eritromicina (ver PRECAUCIONES – Interacciones medicamentosas).
E.E.S.® Gránulos contiene 25,9 mg (1,1 mEq) de sodio por dosis individual.
La población geriátrica puede responder con una natriuresis atenuada a la carga de sal. Esto puede ser clínicamente importante en relación con enfermedades como la insuficiencia cardíaca congestiva.
E.E.S. 400 recubierto con película contiene 47 mg (2 mEq) de sodio por comprimido y 10,0 mg (0,3 mEq) de potasio por comprimido.
Reacciones adversas
Los efectos secundarios más frecuentes de los preparados orales de eritromicina son gastrointestinales y están relacionados con la dosis. Incluyen náuseas, vómitos, dolor abdominal, diarrea y anorexia. Pueden aparecer síntomas de hepatitis, disfunción hepática y/o resultados anormales en las pruebas de la función hepática (ver sección ADVERTENCIAS).
La aparición de síntomas de colitis pseudomembranosa puede ocurrir durante o después del tratamiento antibacteriano (ver sección ADVERTENCIAS).
La eritromicina se ha asociado con prolongación del QT y arritmias ventriculares, incluyendo taquicardia ventricular y torsades de pointes (ver sección ADVERTENCIAS).
Se han producido reacciones alérgicas que van desde urticaria hasta anafilaxia. Raramente se han notificado reacciones cutáneas que van desde erupciones leves hasta eritema multiforme, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica.
Se han notificado casos de nefritis intersticial coincidentes con el uso de eritromicina.
Se han notificado raramente casos de pancreatitis y convulsiones.
Se han notificado casos aislados de pérdida de audición reversible que se producen principalmente en pacientes con insuficiencia renal y en pacientes que reciben dosis elevadas de eritromicina.
Sobredosis
En caso de sobredosis, debe interrumpirse la administración de eritromicina. La sobredosificación debe manejarse con la rápida eliminación del fármaco no absorbido y deben instituirse todas las demás medidas apropiadas.
La eritromicina no se elimina mediante diálisis peritoneal o hemodiálisis.
Dosis y administración de EES
Las suspensiones de etilsuccinato de eritromicina y los comprimidos recubiertos con película pueden administrarse sin tener en cuenta las comidas.
Niños
La edad, el peso y la gravedad de la infección son factores importantes para determinar la dosis adecuada. En las infecciones leves o moderadas, la dosis habitual de etilsuccinato de eritromicina para niños es de 30 a 50 mg/kg/día en dosis igualmente divididas cada 6 horas. En las infecciones más graves, esta dosis puede duplicarse. Si se desea una dosis de dos veces al día, puede administrarse la mitad de la dosis diaria total cada 12 horas. Las dosis también pueden darse tres veces al día administrando un tercio de la dosis diaria total cada 8 horas.
Se sugiere el siguiente esquema de dosificación para infecciones leves a moderadas:
| Peso corporal | Dosis diaria total |
|---|---|
| Menos de 10 libras | 30 a 50 mg/kg/día 15 a 25 mg/lb/día |
| 10 a 15 lbs | 200 mg |
| 16 a 25 lbs | 400 mg |
| 26 a 50 lbs | 800 mg |
| 51 a 100 lbs | 1200 mg |
| más de 100 lbs | 1600 mg |
Adultos
La dosis habitual es de 400 mg de etilsuccinato de eritromicina cada 6 horas. La dosis puede aumentarse hasta 4 g al día según la gravedad de la infección. Si se desea una dosis de dos días, puede administrarse la mitad de la dosis diaria total cada 12 horas. Las dosis también pueden darse tres veces al día administrando un tercio de la dosis diaria total cada 8 horas.
Para el cálculo de la dosis en adultos, utilice una proporción de 400 mg de actividad de eritromicina como etilsuccinato por 250 mg de actividad de eritromicina como estearato, base o estolato.
En el tratamiento de las infecciones estreptocócicas, debe administrarse una dosis terapéutica de etilsuccinato de eritromicina durante al menos 10 días. En la profilaxis continua contra las recidivas de infecciones estreptocócicas en personas con antecedentes de cardiopatía reumática, la dosis habitual es de 400 mg dos veces al día.
Para el tratamiento de la uretritis debida a C. trachomatis o U. urealyticum
800 mg tres veces al día durante 7 días.
Para el tratamiento de la sífilis primaria
Adultos
48 a 64 g administrados en dosis divididas durante un periodo de 10 a 15 días.
Para la amebiasis intestinal
Adultos
400 mg cuatro veces al día durante 10 a 14 días.
Niños
30 a 50 mg/kg/día en dosis divididas durante 10 a 14 días.
Para uso en tos ferina
Aunque no se han establecido la dosis y la duración óptimas, las dosis de eritromicina utilizadas en los estudios clínicos comunicados fueron de 40 a 50 mg/kg/día, administradas en dosis divididas durante 5 a 14 días.
Para el tratamiento de la legionelosis
Aunque no se han establecido las dosis óptimas, las dosis utilizadas en los datos clínicos comunicados fueron las recomendadas anteriormente (1,6 a 4 g diarios en dosis divididas).
Direcciones para la mezcla de E.E.S. Gránulos
100 mL
Añadir 77 mL de agua y agitar enérgicamente. Esto hace 100 mL de suspensión.
200 mL
Añadir 154 mL de agua y agitar vigorosamente. Esto hace 200 mL de suspensión.
¿Cómo se suministra EES
E.E.S. Gránulos 200 mg por 5 mL (etilsuccinato de eritromicina para suspensión oral, USP) son gránulos rosados con aroma a cereza y se suministran en frascos de 100 mL (NDC 24338-134-02) y 200 mL (NDC 24338-136-10). Tras la reconstitución, los gránulos de E.E.S. se convierten en una suspensión opaca de color rosa con aroma a cereza.
E.E.S. 400 comprimidos recubiertos con película (comprimidos de etilsuccinato de eritromicina, USP) 400 mg, se suministran como comprimidos ovalados de color rosa impresos con la designación de dos letras, EE, en:
Frascos de 30 (NDC 24338-100-03) Frascos de 100 (NDC 24338-100-13)
Almacenamiento recomendado
Almacenar a 20° a 25°C (68° a 77°F) .
Almacenar los gránulos, antes de mezclarlos, a una temperatura de 20° a 25°C (68° a 77°F) . Después de la mezcla, refrigerar y utilizar antes de 10 días.
- Comité de Fiebre Reumática, Endocarditis y Enfermedad de Kawasaki del Consejo de Enfermedades Cardiovasculares en los Jóvenes, de la Asociación Americana del Corazón: Prevención de la fiebre reumática. Circulation. 78(4):1082-1086, October 1988.
- Honein, M.A., et al: Estenosis pilórica hipertrófica infantil tras la profilaxis de la tos ferina con eritromicina: una revisión de casos y un estudio de cohortes. The Lancet 1999:354 (9196): 2101-5.
Revisado: Abril de 2018
EES-PI-03
Arbor Pharmaceuticals, LLC
Atlanta, GA 30328
(Nos. 5729, 6369)
PANEL DE PRESENTACIÓN PRINCIPAL – Etiqueta del frasco de comprimidos de 400 mg
NDC 24338-100-03
30 comprimidos
E.E.S. 400®
Comprimidos recubiertos con película
ERYTHROMYCIN
ETHYLSUCCINATE
TABLETS, USP
400 mg
Erythromycin
activity
Rx only
arbor
PHARMACEUTICALS, LLC

Panel de visualización principal – Etiqueta del frasco de 100 mL
NDC 24338-134-02
100 mL (cuando se mezcla)
Para suspensión oral
E.E.S.® Gránulos
ERITROMICINA
Etilsuccinato para
Suspensión oral, USP
Actividad de la eritromicina
200 mg por 5 mL
cuando se reconstituye
Sólo Rx
arbor®
PHARMACEUTICALS, INC.

Panel de visualización principal – Etiqueta del frasco de 5 mL
NDC 24338-136-10
200 mL (cuando se mezcla)
Para suspensión oral
E.E.S.® Gránulos
ERITROMICINA
Etilsuccinato para
Suspensión oral, USP
Actividad de la eritromicina
200 mg por 5 mL
cuando se reconstituye
Sólo Rx
arbor®
PHARMACEUTICALS, INC.

| E.E.S 400 Etilsuccinato de eritromicina comprimido |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
| E.E.S Granulado de etilsuccinato de eritromicina, para suspensión |
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
| E.E.S Granulado de etilsuccinato de eritromicina, para suspensión |
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
|
|||||||||||||||
Etiquetadora – Arbor Pharmaceuticals, Inc. (781796417)
Preguntas frecuentes
- ¿Se pueden tomar antibióticos durante el embarazo?
Más información sobre E.E.S. Gránulos (eritromicina)
- Efectos secundarios
- Durante el embarazo o la lactancia
- Información sobre la dosis
- Interacciones con otros medicamentos
- Precios &Cupones
- En español
- Clase de medicamentos: macrólidos
Recursos para el consumidor
- Lectura avanzada
Recursos para el profesional
- Información de prescripción
- Eritromicina comprimidos (FDA)
Otras marcas Ery-Tab, EryPed, Erythrocin, Eryc, PCE Dispertab
Guías de tratamiento relacionadas
- Prevención de la endocarditis bacteriana
- Bartonelosis
- Preparación intestinal
- Bronquitis
- … +21 más
Descargo de responsabilidad médica