Generisk navn: Proparacaine hydrochlorid
Doseringsform: oftalmisk opløsning
Medicinsk gennemgået af Drugs.com. Sidst opdateret den 1. okt. 2020.
- Overblik
- Bivirkninger
- Professionel
- Interaktioner
- Mere
Ophthalmic Solution, USP
0.5% steril
Kun på recept
BESKRIVELSE:
Proparacainehydrochlorid oftalmisk opløsning USP, 0,5% er et lokalbedøvelsesmiddel til oftalmisk instillation. Hver mL steril, vandig opløsning indeholder: Aktiv: Proparacainehydrochlorid 5 mg (0,5%): Aktivt:: Proparacainehydrochlorid 5 mg (0,5%). Inaktiver:: Glycerin som stabilisator, saltsyre og/eller natriumhydroxid kan tilsættes for at justere pH (3,5 til 6,0) og vand til injektion. Konserveringsmiddel:
Proparacainehydrochlorid er kemisk konstrueret som 2-(Diethylamino)ethyl 3-amino-4-propoxybenzoat monohydrochlorid. Det aktive stof er repræsenteret ved strukturformlen:
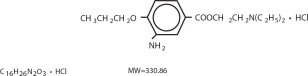
KLINISK FARMAKOLOGI:
Proparacainehydrochlorid oftalmisk opløsning er et hurtigt virkende lokalbedøvende lokalanæstetikum egnet til oftalmisk brug. Med et enkelt dråbe indtræder anæstesien inden for 30 sekunder og fortsætter i 15 minutter eller længere.
Det vigtigste anæstetiske virkningssted er nervecellemembranen, hvor proparacaine forstyrrer den store forbigående stigning i membranens permeabilitet for natriumioner, som normalt fremkommer ved en let depolarisering af membranen. Efterhånden som den anæstetiske virkning udvikler sig gradvist i en nerve, øges tærsklen for elektrisk stimulering gradvist, og sikkerhedsfaktoren for ledning falder; når denne virkning er tilstrækkeligt veludviklet, opstår der blokering af ledningen.
Den nøjagtige mekanisme, hvorved proparacaine og andre lokalanæstetika påvirker cellemembranens permeabilitet, er ukendt; flere undersøgelser tyder dog på, at lokalanæstetika kan begrænse natriumionpermeabiliteten ved at lukke de porer, hvorigennem ionerne vandrer i lipidlaget i nervecellemembranen. Denne begrænsning forhindrer den grundlæggende ændring, der er nødvendig for generering af aktionspotentialet.
INDIKATIONER OG ANVENDELSE:
Proparacainehydrochlorid oftalmisk opløsning er indiceret til lokal anæstesi i oftalmisk praksis. Repræsentative oftalmiske procedurer, hvor præparatet giver god lokalanæstesi, omfatter måling af intraokulært tryk (tonometri), fjernelse af fremmedlegemer og suturer fra cornea, konjunktival skrabning ved diagnosticering og gonioskopisk undersøgelse; det er også indiceret til brug som topisk anæstetikum før kirurgiske indgreb som f.eks. kataraktudtrækning.
KONTRAINDIKATIONER:
Dette præparat er kontraindiceret hos patienter med kendt overfølsomhed over for nogen komponent i opløsningen.
VARNEMÆRKNINGER:
IKKE TIL INJEKTION. KUN TIL TOPISK OPHTHALMISK ANVENDELSE.
Langvarig brug af et topisk okulært anæstetikum kan medføre permanent corneatrækning med ledsagende synstab.
FORSIGTIGELSER:
Generelt
Proparakain bør anvendes med forsigtighed og sparsomt til patienter med kendte allergier, hjertesygdomme eller hyperthyreose. Langtidstoksiciteten af proparacain er ukendt; langvarig brug kan muligvis forsinke sårheling. Selv om det er yderst sjældent ved oftalmisk anvendelse af lokalanæstetika, bør man være opmærksom på, at systemisk toksicitet (manifesteret ved stimulering af centralnervesystemet efterfulgt af depression) kan forekomme.
Beskyttelse af øjet mod irriterende kemikalier, fremmedlegemer og gnidning i anæstesiperioden er meget vigtig. Tonometer, der er gennemblødt i steriliserings- eller rengøringsmiddelopløsninger, skal skylles grundigt med sterilt destilleret vand inden brug. Patienterne bør rådes til at undgå at røre ved øjet, indtil anæstesien er aftaget. Dråberspidsen må ikke berøres med nogen overflade, da dette kan forurene opløsningen.
Carcinogenese, mutagenese, forringelse af fertiliteten
Langtidsundersøgelser på dyr er ikke blevet udført for at vurdere det carcinogene potentiale, mutagenicitet eller mulig forringelse af fertiliteten hos hanner eller hunner.
Graviditet: Teratogene virkninger
Kategori C
Der er ikke foretaget undersøgelser af dyrs reproduktion med proparacainhydrochloridhydrochlorid øjenvæskeopløsning. Det vides heller ikke, om Proparacainehydrochlorid kan forårsage fosterskader, når det administreres til en gravid kvinde, eller om det kan påvirke reproduktionsevnen. Proparacainehydrochlorid bør kun administreres til en gravid kvinde, hvis det er klart nødvendigt.
Sygeplejende mødre
Det vides ikke, om dette lægemiddel udskilles i modermælk. Da mange lægemidler udskilles i modermælk, skal der udvises forsigtighed, når Proparacainehydrochlorid administreres til en ammende kvinde.
Pædiatrisk brug
Der er ikke udført kontrollerede kliniske undersøgelser med Proparacainehydrochlorid oftalmisk opløsning for at fastslå sikkerhed og effektivitet hos pædiatriske patienter; litteraturen nævner dog brugen af Proparacainehydrochlorid som et topisk oftalmisk anæstetikum hos pædiatriske patienter.
ADVERSE REAKTIONER:
Pupillær dilatation eller cycloplegiske virkninger er sjældent blevet observeret med Proparacainehydrochlorid. Lægemidlet synes at være sikkert til brug hos patienter, der er følsomme over for andre lokalanæstetika, men lokal eller systemisk følsomhed forekommer lejlighedsvis. Instillation af Proparacaine i øjet ved anbefalet koncentration og dosering giver normalt kun lidt eller ingen initial irritation, svie, svie, brænden, konjunktival rødme, tåreflåd eller øget blinkning. Der kan dog forekomme en vis lokal irritation og svie flere timer efter instillationen.
Sjældent kan der forekomme en alvorlig, umiddelbar type, tilsyneladende hyperallergisk corneareaktion, som omfatter akut, intens og diffus epithelkeratitis; et gråt, glasagtigt udseende; afskalning af store områder med nekrotisk epithel; corneale filamenter og undertiden iritis med descemetitis.
Allergisk kontaktdermatitis med udtørring og spaltning af fingerspidserne er blevet rapporteret.
Om blødgøring og erosion af hornhindeepitelet og konjunktival overbelastning og blødning er blevet rapporteret.
DOSERING OG ADMINISTRATION:
Dyb anæstesi som ved kataraktekstraktion:
Instil 1 dråbe i øjet hvert 5. til 10. minut i 5 til 7 doser.
Fjernelse af suturer:
Instil 1 eller 2 dråber i øjet 2 eller 3 minutter før fjernelse af suturer.
Fjernelse af fremmedlegemer:
Instil 1 eller 2 dråber i øjet før operationen.
Tonometri:
Instil 1 eller 2 dråber i øjet umiddelbart før måling.
HVordan leveres:
Proparacainehydrochlorid oftalmisk opløsning USP, 0,5 % leveres som en steril opløsning i 15 ml plastdråbeflasker – NDC 13985-611-15
LAGERING:
Køles ved 2° til 8°C (36° til 46°F). Hold flasken tæt lukket. Opbevares i karton, indtil den er tom, for at beskytte mod lys. Hvis opløsningen viser mere end en svag gul farve, bør den ikke anvendes.
VARNELSE – OPHOLD DENNE OG ALLE MEDICINSER UD AF BØRNES RÆKKEHED.
apexa™
Fremstillet af: Akorn Inc.
Lake Forest, IL 60045
Distribueret af: Akorn Inc.
Lake Forest, IL 60045
Distribueret af: MWI
Boise, ID 83705
MWPR00N Rev. 08/14
Principal Display Panel Text for Container Label:
NDC 13985-611-15
Proparacaine Hydrochloride
Ophthalmic Solution, USP 0.5%
KUN TIL LOKAL
OFTHALMISK BRUG.
IKKE TIL INJEKTION.
Apexa-logo STERILE
Rx Only
AP 704013 15 mL

Principal Display Panel Text for Carton Label:
NDC 13985-611-15
Proparacaine
Hydrochlorid
Ophthalmic
Ophthalmic
Solution
USP, 0.5%
KUN TIL TOPISK
OPHTHALMISK BRUG.
IKKE TIL INJEKTION.
STERILE
Rx Only
Apexa-logo
AP 704013 15 mL
| Proparacaine HYDROCHLORID Proparacainehydrochlorid opløsning/dråber |
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
Mærketager – MWI (019926120)
Registrant – Akorn Operating Company LLC (117693100)
| Etablering | ||||
| Navn | Adresse | ID/FEI | ID/FEI | Operations |
| Akorn, Inc | 117696790 | PACK(13985-611), LABEL(13985-611) | ||
| Etablering | |||
| Navn | Adresse | ID/FEI | Operations |
| Akorn, Inc. | 117696832 | FREMSTILLE(13985-611), ANALYSERE(13985-611), STERILISERE(13985-611) | |