Den gode nyhed er, at langt de fleste af disse perifere skader på trigeminusnerven undergår en spontan regeneration. Nogle skader kan dog være permanente med varierende grader af føleforstyrrelser, der spænder fra let følelsesløshed (hypoæstesi) til fuldstændig anæstesi. Nogle patienter kan endda udvikle brændende smerter kaldet dysæstesi ud over deres sensoriske underskud.
Målet med mikrokirurgi af trigeminusnerven er at genoprette nervekontinuiteten ved at fjerne eventuelle hindringer såsom ar eller fremmedlegemer og skabe nervekontinuitet. Denne artikel vil gennemgå mekanismerne for skade på trigeminusnerven i tandplejen, klinisk neurosensorisk testning, indikationer for kirurgi og henvisning til en mikrokirurg samt kirurgiske procedurer, der omfatter supplerende materialer til at forbedre regenerationen og forbedre aktiviteterne i den daglige tilværelse for vores patienter.
Mekanismer for trigeminusnerveskader i tandplejen
De mest almindelige procedurer, der er forbundet med trigeminusnerveskader i tandplejen, omfatter fjernelse af impacterede tredje molarer og anbringelse af endossale tandimplantater (Figur 1). Andre årsager kan omfatte endodontiske procedurer og endda administration af lokalbedøvelse. Andre mindre almindelige kirurgiske indgreb omfatter ortognathisk kirurgi med osteotomier, ansigtstraumer og behandling af maxillofacial patologi.
I vores praksis omfatter de tre hyppigst observerede ætiologier for skader på trigeminusnerven tandekstraktioner, placering af implantater og endodontiske procedurer, hvor endodontiske materialer ekstruderes ind i den inferior alveolære nervekanal (figur 2).
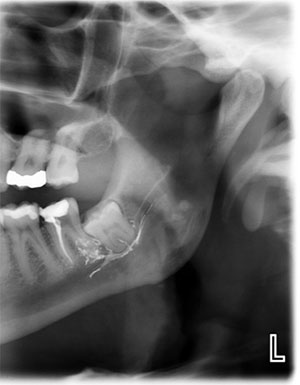
Figur 2. Endodontiske materialer, der er ekstruderet ind i IAN som f.eks. denne pasta, udgør en af de tre hyppigst observerede ætiologier for trigeminusnerveskader.
 |
 |
|
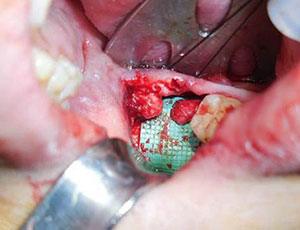
Figur 3. Forberedelse af nerven til neurorafi begynder med forberedelse af de proximale og distale nervesegmenter tilbage til sundt nervevæv, der bemærkes ved axoplasmatisk udbuling, punktvis blødning og mangel på fibrose. |
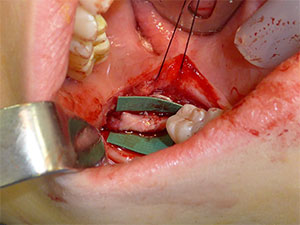
Figur 4. Allogent nervetransplantat kan anvendes til rekonstruktion af defekter, når der ikke kan foretages en spændingsfri reparation. |
Temporære eller permanente sensoriske nerveforstyrrelser i forbindelse med fjernelse af impacterede tredje molarer, herunder kirurgisk exodonti, er et resultat af lingual og/eller inferior alveolar nerveskader. I nogle tilfælde resulterer teknikker til bevarelse af sockets ved hjælp af allogene knogletransplantater i, at knogle forskydes ind i nervekanalen, hvilket også kan forårsage nerveskader.
Tandlæger skal diskutere potentialet for disse typer skader under den informerede samtykkeproces og dokumentere diskussionen i overensstemmelse hermed. Når disse skader er identificeret, skal de følges regelmæssigt med seriel nervetestning for at dokumentere eventuelle sensoriske ændringer. Neurosensorisk testning og indikationer for mikrokirurgi af trigeminusnerven vil blive diskuteret senere i denne artikel.
Skader på den inferior alveolærnerve (IAN) ved fjernelse af en impacteret tredje kindtand er blevet negativt korreleret med flere faktorer, herunder ældre patienters alder, dybden af impaktionen, udvikling af rodstrukturen, angulering af den impacterede tand og placeringen af rodspidsen i forhold til IAN. Operatørens erfaring spiller også en rolle for forekomsten af nerveskader. Overivrig brug af roterende instrumentering til fjernelse af knogle og sektionering af tænder kan føre til direkte nerveskader.
Det er ikke ualmindeligt, at nogle klinikere overvejer at anvende forsætlig delvis odontektomi (hvor kronen fjernes og rødderne bibeholdes) i de tilfælde, hvor risikoen for IAN-skader er høj. Der er begrænsninger ved denne procedure, idet tandstrukturen ikke bør bibeholdes i tilfælde af infektion eller patologi. Desuden kan patienterne udvikle sekundær infektion eller migration af rodfragmenter, der kræver sekundær kirurgi, hvilket skal diskuteres med patienten præoperativt.
Det er derfor, at jeg kun forbeholder den forsætlige delvise odontektomi procedure til meget udvalgte patienter og ofte vælger at fjerne komplekse tredje molarer efter avanceret billeddannelse på operationsstuen, hvor der kan udføres sideløbende mikrokirurgi intraoperativt, hvis det er indiceret.
Lingualnerveskader i forbindelse med operation af tredje kindtand kan forekomme, hvilket kan resultere i tungebidning, ændringer i talen, f.eks. lispling, og nedsat smagsopfattelse. Patienterne kan også beskrive ændringer i smagen med øget bitterhed eller metalsmag på grund af den fremherskende glossopharyngeale nervefordeling, der involverer den bageste tredjedel af tungen, med nedsat intensitet af salt, sur og sød smag, som formidles af de forreste to tredjedele af tungen.
Husk, at nervus chorda tympani, som formidler smag i de forreste to tredjedele af tungen, løber sammen med den lingual nerve og kan blive skadet samtidig. Nervus lingualis er generelt ikke visualiseret under kirurgi af tredje kindtand og kan have en varierende anatomisk placering. Anatomiske undersøgelser har vist variationen i nervens placering med op til 10 % af patientens nerve placeret over den linguale knoglekam og i direkte kontakt med den linguale plade hos op til 25 % af patienterne. Dette bringer den lingualnerven i fare, afhængigt af om incisionen er placeret for langt lingvisk, eller om den lingualplade er fraktureret eller brudt af kirurgisk bor eller håndinstrumentering.
Jeg har observeret tilfælde, hvor den impacterede tredje molar er lingvisk orienteret, hvilket eliminerer noget af den lingualplade og placerer nerven i en prekær placering under ekstraktionen, selv om nerven er placeret inden for normale anatomiske varianter. Det skal understreges, at man skal være opmærksom på incisionsdesign med bukkal eller lateral orientering og på ikke at krænke den lingualplade af knogle med roterende instrumentering. Brugen af lingual flap retraktion under kirurgi af tredje molar kan være forbundet med en øget forekomst af midlertidig nerveskade på grund af traktionsskade.
Lokalbedøvelsesinjektioner kan i nogle tilfælde forårsage trigeminusnerve-skader. Heldigvis forsvinder de fleste af disse skader spontant, men nogle kan være permanente. Det er blevet anslået, at ca. en ud af 100.000 injektioner resulterer i et neurosensorisk underskud. Det svarer til en eller to skader ved lokalbedøvende injektion af lokalbedøvende midler i løbet af en aktiv tandlæges karriere. Den nøjagtige ætiologi af denne skade er uklar med flere postulerede mekanismer.
Direkte traumer fra en nål, der trænger ind i nerven, vil fremkalde en smertefuld reaktion fra patienten og få tandlægen til at trække nålen tilbage og dirigere den igen. Det ville være uudholdeligt smertefuldt og usandsynligt at injicere lokalbedøvelse i nerveskeden på en vågen patient. Desuden er overfladearealet af en nåleperforation meget lille i forhold til nervens diameter og står ofte i misforhold til det niveau af sensorisk underskud, der klinisk observeres.
En mere plausibel årsag er udviklingen af en modhager på nålen som følge af kontakt med knogle under gentagne injektioner. Hvis nålen derefter trænger ind i nerven, kan den teoretisk set forårsage et intraneuralt hæmatom, hvilket kan føre til iskæmi på grund af tryk, fibrose og til sidst permanent sensorisk underskud. En forklaring på de forskellige grader af sensorisk underskud, der kan opstå som følge af injektionsskader, kan være relateret til et reduceret antal fascikler i nerven på injektionsstedet ved lingula i forhold til antallet af fascikler i området omkring den tredje molar.
Ud over de mekaniske skader er alle lokalanæstetika neurotoksiske og har potentiale til at forårsage nerveskader. Koncentrationen af lokalbedøvelse, tilstedeværelsen af en vasokonstriktor og lokalbedøvelsens penetrerbarhed kan alle potentielt påvirke risikoen for skade. Nogle klinikere vil vælge at undgå brug af mere koncentrerede lokalbedøvelsesmidler til inferior alveolær nerveblokade og reservere dem til områder, hvor infiltration kan udføres.
Uanset årsagen til nerveskader ved lokalbedøvelsesinjektion med lokalbedøvelsesmidler er der ingen pålidelig måde at forhindre, at disse skader opstår. God teknik indebærer langsom injektion af patienterne og afhængighed af aspiration før injektion. Enhver skade som følge af lokalbedøvelsesinjektioner skal dokumenteres og overvåges med serielle undersøgelser.
Patienterne kan være beroliget med, at de fleste af disse skader vil forsvinde spontant. I de sjældne tilfælde, hvor patienterne udvikler neuropatiske smerter og dysæstesi, der bliver centraliserede, er farmakologisk behandling og henvisning til en smertebehandlingsspecialist indiceret. Mikrokirurgi af trigeminusnerven har ikke vist sig at være vellykket i disse tilfælde og er generelt ikke indiceret til patienter med lokalbedøvelsesskader.
Tandimplantatplacering kan resultere i skade på IAN fra området af den mentale nerve, hvor der er en anterior løkke til et hvilket som helst sted langs nervens vej. Implantatskader kan opstå på grund af en række forskellige mekanismer, herunder direkte mekanisk kompression fra implantatet, fraktur af kortikal knogle med forskydning ind i kanalen eller boring af osteotomien og blødning i kanalen, hvilket i det væsentlige fører til et kompartmentsyndrom i kanalen ved at komprimere nerven.
Grundig præoperativ planlægning med passende billeddannelse, brug af computergenererede guider og sondering af osteotomisteder for at sikre intakt knoglestruktur kan minimere disse skader. Postoperative røntgenbilleder bør være standardpraksis efter implantatindsættelse. Hvis det ser ud til, at implantatet ser ud til at gribe ind i nervekanalen, skal det enten fjernes og erstattes med et kortere implantat eller udtages på passende vis. Der er tidligere blevet anvendt teknikker til lateralisering af nerverne for at muliggøre placering af længere implantater. Selve proceduren var imidlertid ansvarlig for nogle permanente sensoriske underskud.
Endodontisk behandling kan resultere i skader på trigeminusnerven, hvilket kan være ødelæggende. Overinstrumentering af kanalsystemet kan give en direkte kanal for mekaniske skader med filer eller gutta-percha-materialer. Kemiske skader kan forårsages af steriliseringsopløsninger, herunder natriumhypoklorit og cementer, der ofte indeholder eugenol, som begge er neurotoksiske.
Direkte traumer kan også opstå som følge af endodontisk kirurgi, f.eks. apicoectomier på posteriore tænder, hvor rødderne er i umiddelbar nærhed af IAN. Endodontisk materialeforskydning ind i IAN-kanalen bør altid betragtes som en nødsituation.
Ud over sensoriske underskud kan mange patienter udvikle neuropatiske smerter, hvilket har begrænset gavn af mikrokirurgi af trigeminusnerven. Disse patienter bør henvises til en kirurg med erfaring i mikrokirurgi for at fjerne eventuelle fremmedlegemer så hurtigt som muligt, inden der opstår neuropatiske smerter.
Klinisk neurosensorisk testning
Når et neurosensorisk underskud er blevet diagnosticeret, er neurosensorisk testning indiceret til at kvantificere graden af sensorisk svækkelse, overvåge eventuel spontan sensorisk genopretning og afgøre, om trigeminusnerve-mikrokirurgi er indiceret. Det berørte område kortlægges på patientens ansigt og registreres på et egnet diagram med henblik på reproducerbare optagelser af serielle undersøgelser.
Der kan anvendes en let børste eller en steril nål til at afgrænse det berørte område. Den kontralaterale eller upåvirkede side anvendes som kontrol, og alle målinger registreres. Ved bilaterale skader anvendes et uberørt tilstødende ansigtsområde som kontrol. Der lægges et tilstrækkeligt tryk på for at fremkalde et respons. Gennemtrængning af huden giver ingen nyttige yderligere oplysninger. Der udføres tre testniveauer for patienter med hypoæstesi eller følelsesløshed.
Niveau A omfatter topunktsdiskrimination og retningsfornemmelse. To-punkts-diskrimination kan udføres ved hjælp af en kaliber- eller boley-måler. Normalværdierne er ca. 3 til 4 mm. Værdier, der er større end 20 mm, registreres normalt ikke, da innervation i den kontralaterale side begynder at spille en rolle ved denne afstand. Retningsfornemmelse opnås ved hjælp af en let børste eller et tyndt nylonmonofilament og vurdering af, om patienten kan bestemme slag og retning.
Niveau B-testning anvendes til at evaluere ikke-noxiske stimuli såsom vibrationer og statisk let berøring. Vibrationer kan let måles ved hjælp af en stemmegaffel, og statisk let berøring måles med von Frey-monofilamenter. Nylonmonofilamentet anbringes vinkelret på huden, og der påføres et tryk, indtil filamentet bøjes. En filament med tykkere diameter kræver mere kraft for at bøje. Filamenterne kalibreres på grundlag af det tryk, der kræves for at bøje dem, og der kan registreres en kvantitativ værdi.
Niveau C-testning anvendes til at måle noxiske stimuli, herunder smerte og temperatur. Smerte vurderes ved hjælp af en steril nål, der forsigtigt berører huden for at fastslå, om der opfattes en skarp eller smertefuld fornemmelse. Varm og kold fornemmelse kan vurderes ved hjælp af en applikator med bomuldsspids med varmt vand og ethylchloridspray. Der kan også anvendes et trykalgesiometer til at give et standardiseret tryk ved hver måling. De forskellige test svarer til specifikke nervefibre, der medierer hver af fornemmelserne.
Støjperceptionstærskel er en teknik, der er mere almindeligt anvendt i forskning, hvor de berørte områder stimuleres af en elektrisk stimulus. Frekvensen af stimuleringen korrelerer med specifikke nervefibre, og patienterne kan kvantitativt registrere deres tærskelrespons på stigende strømstyrke. Denne teknik gør det muligt for forskeren at vurdere nerveskader kvantitativt, selv om det har vist sig at korrelere godt med den traditionelle kliniske neurosensoriske testning.
De samme testprocedurer kan anvendes til patienter med neuropatiske smerter med det formål at karakterisere responsen på varierende stimuli. Niveau A-testning, hvor blid strygning af huden fremkalder smerte, kaldes allodyni. Niveau B-testning bestemmer, om patienten har hyperpati, som defineres som unormal smerterespons med forsinket indtræden, stigende intensitet ved gentagne stimuli og vedvarende fornemmelse, efter at stimuli er fjernet. Ved testning på niveau C bestemmes det, om der er tale om hyperalgesi eller øget følsomhed, som ikke er proportional med stimuleringen. For patienter med smerter kan lokalbedøvende blokader anvendes til at afgøre, om skaden er perifer ved at bestemme, om de er effektive til at reducere eller eliminere smerte.
Indikationer for mikrokirurgi af trigeminusnerven
En neurosensorisk forstyrrelse, der varer ved i mere end tre måneder, er en generelt accepteret indikation for sonderende mikrokirurgi af trigeminusnerven. Dette koncept vil dog sandsynligvis ændre sig i fremtiden med tilgængeligheden af højopløselige MR-undersøgelser, herunder magnetisk resonansneurografi, hvor nerveskader kan visualiseres direkte, hvilket eliminerer behovet for at vente i tilfælde af alvorlige eller fuldstændige skader.
Indikationer for mikrokirurgi af trigeminusnerven omfatter:
- Observation af nervetransektion
- Ingen subjektiv sensorisk forbedring i længere tid end 3 måneder
- Udvikling af nyopståede smerter i den berørte region
- Forekomst af et fremmedlegeme
- Progressivt forværret hypoæstesi eller dysæstesi
- Hypoæstesi, der er uudholdelig for patienten.
Anstedeværelsen af et fremmedlegeme, som f.eks. i tilfælde af endodontiske fyldningsmaterialer i nervekanalen, er en indikation for øjeblikkelig sonderende mikrokirurgi før udbrud af neuropatiske smerter.
Kontraindikationer for trigeminusmikrokirurgi vil omfatte:
- Evidens for forbedring af sensorisk funktion
- Hypoæstesi, der er acceptabel for patienten
- En alvorligt medicinsk kompromitteret patient
- Centrale neuropatiske smerter
- Tidsmæssig lang tid siden skaden
Studier har vist signifikant sensorisk forbedring efter trigeminusnerve-mikrokirurgi fra seks til ni måneder efter skaden. Prognosen vil dog generelt blive forringet med tiden.
Trigeminusnerve-mikrokirurgi
De grundlæggende kirurgiske principper, der er involveret i perifer trigeminusnerve-mikrokirurgi, omfatter dekompression og eksponering af nerven, hæmostase, fjernelse af fremmedlegemer i eller omkring nerven, resektion tilbage til sundt nervevæv og spændingsfri neuroreksion.
IAN kan tilgås enten intraoral eller transkervikalt via en submandibulær incision. Den transorale tilgang er mest almindeligt anvendt med eksponering af nerven ved at dekortikere den laterale cortex eller alternativt via en sagittal split mandibulær osteotomi. Sidstnævnte metode giver god adgang. Okklusion skal dog genetableres efter afslutningen af mikrokirurgien, og anvendelse af rigid intern fiksation for at sikre knoglestabilitet og heling er påkrævet.
Den lingual nerve tilgås ved enten en paralingual eller lingual gingival sulcular incision i et subperiostalt plan. Den paralingual incision suppleres med stump og skarp dissektion langs mundbunden i den forventede nærhed af nerven for at muliggøre eksponering. Fordelene ved denne fremgangsmåde er bl.a. en mindre incision med direkte visualisering af nerven. En nerve, der har fået en fuldstændig skade, kan dog resultere i retraktion af de proximale og distale segmenter ved eksponering.
Den lingual gingival sulcus-incision kræver en lateral frigørelse langs den eksterne oblikale kam for fuldstændig mobilisering af flappen og elevation af flappen i et subperiostalt plan. Når flappen er hævet, kan nerven visualiseres gennem det overliggende periosteum og stumpt dissekeres inde fra flappen. Denne teknik kræver en større incision end det paralingual mucosale incisionsdesign. Den proximale og distale nerve vil imidlertid ikke trække sig tilbage under den kirurgiske dissektion, og det er min foretrukne metode.
I alle tilfælde af mikrokirurgi af den perifere trigeminusnerve bør der udføres ekstern neurolyse for at eksponere og frigøre den for arvæv, fremmedlegemer eller restriktioner fra vævslejet. Herved vil nerven blive blotlagt, hvilket giver mulighed for en bedre vurdering af skaden med henblik på den endelige kirurgiske planlægning. Adskillelse af arvæv og frigørelse af en intakt nerve kan være den eneste nødvendige procedure for at give mulighed for genoprettelse af følelsen. Ekstern neurolyse udføres normalt under en vis forstørrelse for at vurdere nerven og isolere eventuel patologi som f.eks. neurom.
Intern neurolyse er en mindre almindelig procedure, som kan anvendes, når der er tegn på nervefibrose ud over restriktion eller kompression. Denne teknik praktiseres ikke af alle kirurger, da der er potentiale for, at der kan opstå en vis iatrogen skade som følge af selve proceduren. Der anlægges et langsgående snit gennem epineurium for at blotlægge de indre fascikulære strukturer og vurdere nervens integritet.
Placering af et langsgående snit langs nerven kaldes en epifascikulær epineurotomi, mens fuldstændig excision af epineurium kaldes en epifascikulær epineurektomi. Ved frigørelse af epineurium kan nerven få lov til at udvide sig, hvilket indikerer en vellykket intern dekompression. Når der observeres fibrose, og der ikke er noget levedygtigt nervevæv til stede, bør det berørte segment excideres, og nerven forberedes til neurorrhafi.
Forberedelse af nerven til neurorrhafi begynder med forberedelse af de proximale og distale nervesegmenter tilbage til sundt nervevæv, der bemærkes ved axoplasmatisk udbuling, punktvis blødning og mangel på fibrose (Figur 3). Abnormt væv udskæres i små trin, indtil normalt nervevæv kan observeres under forstørrelse. De proximale og distale nerveender justeres derefter og vurderes med hensyn til, om der er mulighed for spændingsfri lukning.
Mobilisering af IAN kan forbedres ved distal og proximal nervedissektion og ofring af incisive-grenen for at muliggøre lateralisering og mobilisering efter decorticering af IAN fra skadestedet til de mentale foramina. Mobilisering af den lingual nerve kan maksimeres ved yderligere proximal og distal dissektion. Neuroreksi for perifere trigeminusnerveskader kan udføres på niveau af epineurium eller perineurium, selv om den oftest afsluttes på niveau af epineurium.
Klinisk set er der ingen forskel i resultaterne for reparation af sensoriske nerver ved den epineurale versus den perineurale teknik, selv om der er potentiale for iatrogen skade ved forsøg på reparation på niveau af fasciklerne. Der vælges en suturdiameter mindre end 7-0 af et ikke-reaktivt materiale som f.eks. nylon for at minimere proliferation af arvæv og inflammatorisk respons.
Det mest kritiske spørgsmål er fortsat spænding på tværs af neuroreksiestedet, som skal minimeres for at opnå optimale resultater, da spænding kan føre til begrænsning af blodgennemstrømningen og iskæmi af nerven. Hvis der ikke kan opnås en spændingsfri reparation via direkte neuroræfika, kan man anvende den conduitassisterede reparationsteknik. Denne teknik gør det muligt at anbringe spændingsreducerende suturer i kanten af conduitet.
Conduits har også flere andre vigtige funktioner i forbindelse med reparation af nerver. Disse omfatter beskyttelse af neuroreksiestederne, forebyggelse af fascikelfejlstilling og forebyggelse af ardannelse nedad eller binding af nerven under helingen. Mange conduitmaterialer er blevet beskrevet og anvendt historisk set, men de fleste kirurger foretrækker i dag resorbable kollagen- eller porcine tyndtarm-submucosa-conduits, som remodelleres til at danne et nyt vævslag svarende til epineurium. Uanset hvilket materiale der anvendes, hjælper disse conduits med at regenerere nerven ved at tillade kapillær indvækst og diffusion af vækstfaktorer til skadestedet.
Hvis hullet mellem nerveenderne er for stort til enten en direkte neuroreksi eller en conduitassisteret reparation, kan der anvendes et interpositionelt nervetransplantat, som kan være enten autogent eller allogent (Figur 4). Tilgængeligheden af allogene nervetransplantater har dramatisk ændret mulighederne for patienterne, da de eliminerer den samtidige morbiditet, der er forbundet med høst af autogene transplantater. Anvendelse af transplantater uden spænding kan faktisk forbedre resultaterne sammenlignet med primære reparationer udført under spænding. Jeg foretrækker allogene nervetransplantater, som er let tilgængelige og acceptable for patienterne sammenlignet med høst af autogene transplantater.
Sensorisk genoptræning
Sensorisk genoptræning kan være med til at hjælpe patienterne til at fremskynde deres sensoriske genopretning. Øvelser til sensorisk genoptræning udført med daglig massage og stimulering af det berørte område i forbindelse med indgivelse af B12-vitamin resulterer i, at de opnår funktionel sensorisk genopretning (FSR) hurtigere end de patienter, der ikke anvender disse metoder. Det betyder ikke, at det endelige resultat er anderledes, men blot at FSR kan opnås hurtigere.
Målet med sensorisk genoptræning er at stimulere de perifere receptorer, så centralnervesystemet derefter kan begynde at behandle dette sensoriske input. Jeg anbefaler sensorisk genoptræningstræning og B12-vitamin til alle patienter postoperativt.
Resultater af mikrokirurgi af trigeminusnerven
De fleste resultatdata for mikrokirurgisk reparation af perifere trigeminusnerveskader er baseret på case reports og serier. Historisk set var der ingen standardisering i forbindelse med kvantificering af resultaterne af nerveskader, indtil implementeringen af Medical Research Council Scale (MRCS). Dette værktøj standardiserer og kvantificerer kliniske sensoriske resultater, hvilket er nyttigt til sammenligninger mellem undersøgelser.
Faktorerne, der er forbundet med vellykkede sensoriske resultater af mikrokirurgi, omfatter tid fra skade til operation, mangel på præoperative neuropatiske smerter, fravær af fremmedlegemer omkring nerven, spændingsfri primær reparation og brug af conduit-assisteret reparation eller nervetransplantater, når spændingsfri reparation ikke er mulig.
Patienterne skal rådgives om realistiske forventninger til resultatet med hensyn til tidsrammen til genopretning og de endelige sensoriske niveauer, der kan opnås på grundlag af de præoperative variabler. Mikrokirurgi af trigeminusnerven har vist sig at være en effektiv modalitet til genoprettelse af fornemmelse efter perifere trigeminusnerve-skader.
Fremtidige retningslinjer og konklusioner
Mikrokirurgi af trigeminusnerven har vist sig at være en effektiv kirurgisk behandling i forbindelse med håndteringen af perifere trigeminusnerve-skader. Ud over tilgængeligheden af konduits og allogene nervetransplantater er andre hjælpemidler ved at blive tilgængelige for mikrokirurger, f.eks. trombocytterigt plasma, som anvendes til at forbedre sårheling gennem frigivelse af vækstfaktorer og andre bioaktive stoffer, der igangsætter sårheling. Stamceller fra fedtvæv er et andet hjælpemiddel, der kan fremme nervefornyelsen. Disse typer nye materialer og teknikker vil fortsat udvikle sig og vil sandsynligvis bidrage til forbedret sensorisk genopretning i fremtiden.
Bibliografi
Behnia H, Kheradvar A, Shabrohbi M. Anatomic Study of the Lingual Nerve in the Third Molar Region. J Oral Maxillofac Surg. 58:649-651; 2000.
Dessouky R, Xi Y, Zuniga J, Chhabra A. Role of MR Neurography for the Diagnosis of Peripheral Trigeminal Nerve Injuries in Patients with Prior Molar Tooth Extraction (MR-neurografi til diagnosticering af perifere trigeminusnerveskader hos patienter med tidligere ekstraktion af kindtænder). Am J Neuroradiolo. 39:162-169: 2018.
Devine M, Modgill O, Renton T. Mandibular Division Trigeminal Nerve Injuries Following Primary Endodontic Treatment. A case series. Australian Endodontic J. 43:56-65; 2017.
Dodson TB og Kaban LB. Anbefalinger til behandling af trigeminusnervebeskadigelser baseret på en kritisk vurdering af litteraturen. J Oral Maxillofac Surg. 55:1380-1386; 1997.
Lampert RC, Nesbitt TR, Chuang SK, Ziccardi VB. Håndtering af endodontiske skader på den inferior alveolærnerve. Quintessence Int. 47:581-587; 2016.
Meyer RA og Bagheri SC. Klinisk evaluering af perifere trigeminusnerveskader. Atlas Oral Maxillofac Surg Clin N Am. 19:15-33; 2011.
Miloro M, Halkias LE, Slone HW, et al. Assessment of the Lingual Nerve in the Third Molar Region Using Magnetic Resonance Imaging. J Oral Maxillofac Surg. 55:134-137; 1997.
Nizam SA og Ziccardi VB. Skader på trigeminusnerven: Undgåelse og håndtering af iatrogene skader. Oral Maxillofac Surg Cl N Am. 27:411-424; 2015.
Pogrel MA. Resultaterne af mikroneurokirurgi af den inferior alveolære og lingualnerve. J Oral Maxillofac Surg. 60:485-489; 2002.
Pogrel MA, Jergensen R, Burgon E, Hulme D. Long-Term Outcome of Trigeminal Nerve Injuries Related to Dental Treatment. J Oral Maxillofac Surg. 69:2284-2288; 2011.
Pogrel MA og Thamby S. Permanent Nerve Involvement Resulting from Inferior Alveolar Nerve Blocks. JADA. 131:901-907; 2000.
Pogrel MA, Bryan J, Regezi J. Nerve Damage Associated with Inferior Alveolar Nerve Blocks (Nervebeskadigelser i forbindelse med Inferior Alveolar Nerve Blocks). JADA. 126:1150-1155; 1995.
Shanti RM, Khan J, Eliav E, Ziccardi VB. Er der en rolle for en kollagenledning og et antiinflammatorisk middel i behandlingen af delvise perifere nerveskader. J Oral Maxillofac Surg. 71:1119-1125, 2013.
Wilson MT, Chuang SK, Ziccardi, VB. Lingual Nerve Microsurgery Outcomes using Two Different Conduits (Resultater af lingual nerve mikrokirurgi med to forskellige ledninger): En retrospektiv kohortestudie. J Oral Maxillofac Surgery. 75:609-615; 2017.
Yampolsky A, Ziccardi VB, Chuang SK. Efficacy of Acellular Nerve Allografts in Trigeminal Nerve Reconstruction. J Oral Maxillofac Surgery. 75:2230-2234; 2017.
Yilmaz Z, Ucer C, Scher E, Suzuki J, Renton T. A Survey of the Opinion and Experience of UK Dentists: Part 2: Risk of Assessment Strategies and the Management of Iatrogenic Trigeminal Nerve Injuries Related to Dental Implant Surgery (Del 2: Risikovurderingsstrategier og håndtering af iatrogene trigeminusnerveskader i forbindelse med tandimplantatkirurgi). Implant Dent. 26:256-262; 2017.
Ziccardi VB og Assael LA. Mekanismer for trigeminusnerveskader. Atlas Oral Maxillofac Surg Clin N Am. 9:1-11; 2001.
Ziccardi VB, Hullett J, Eliav E, Gomes J. Physical Neurosensory Testing versus Current Perception Threshold Assessment in Trigeminal Nerve Injuries Related to Dental Treatment: En retrospektiv undersøgelse. Quintessence Int. 40:603-609; 2009.
Ziccardi VB. Mikrokirurgiske teknikker til reparation af de inferior alveolære og lingualnerve. Atlas Oral Maxillofac Surg Clin N Am. 19:79-90; 2011.
Dr. Ziccardi er professor, formand og leder af opholdssted ved Rutgers University School of Dental Medicine Department of Oral and Maxillofacial Surgery. Han kan kontaktes på (973) 972-7462 eller Denne e-mail adresse bliver beskyttet mod spambots. Du skal have JavaScript slået til for at se den..
Oplysning: Dr. Ziccardi er konsulent hos Axogen, Alachua, Florida.
Det 90-dages vindue: Trigeminusnerve-skader og vigtigheden af hurtig henvisning
Rutgers-forsker skal undersøge genetiske rødder af trigeminusneuralgi
Behandling tager fat på trigeminusneuralgi uden bivirkninger