1. Permeabilitet
2. Fluiditet
3. Heterogenitet
– Indre
– Ydre
– Bøjning, tykkelse
Cellemembranernes funktioner er bestemt af deres molekylære sammensætning. Typen og andelen af disse molekyler bestemmer membranens fysisk-kemiske egenskaber: semipermeabilitet, asymmetri, fluiditet, reparation og genanvendelse.
Permeabilitet
Membranens semipermeabilitet er en konsekvens af membranernes interne hydrofobiske miljø, der er skabt af lipidfedtsyrekæderne, og som vanskeligt kan krydses af molekyler med elektriske ladninger. Ved at forhindre fri diffusion af molekyler kan membraner således danne rum, der opretholder forskellige indre og ydre miljøer. Permeabiliteten er imidlertid selektiv. Polaritet og størrelse er de vigtigste molekylære egenskaber, der har indflydelse på evnen til at krydse membraner. Små molekyler uden elektrisk ladning, f.eks. CO2, N2, O2, og molekyler med høj opløselighed i fedt, f.eks. ethanol, kan næsten frit krydse membraner ved passiv diffusion (figur 1). Permeabiliteten er lavere for molekyler, der har elektriske ladninger, når antallet af positive ladninger er lig med negative ladninger, såkaldte uladede molekyler, som f.eks. vand og glycerol. Man kunne tro, at vand frit kan krydse membraner, men der er nogle begrænsninger, og derfor indeholder nogle membraner aquaporiner, en type transmembranprotein med en kanal, der tillader vandet at krydse frit. Store uladede molekyler som f.eks. glukose har kun ringe evne til at krydse membraner. Membraner er meget uigennemtrængelige for ioner og ladede molekyler. Nogle værdier for permeabilitetskoefficienten ved passiv diffusion er: O2: 2,3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, glycerol: 10 -6 cm/s, natrium og kalium: 10 -6 cm/s: 10 -14 cm/s.
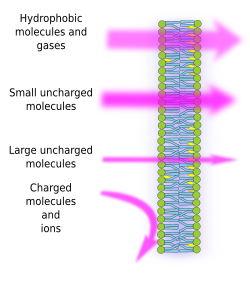
Den ulige fordeling af ioner og molekyler mellem begge sider af en membran gør det muligt at generere og opretholde elektrokemiske gradienter. Forskellen mellem den indre og den ydre koncentration af elektriske ladninger er kendt som membranpotentialet. Denne gradient anvendes til mange cellefunktioner, f.eks. til ATP-syntese og overførsel af information langs nerverne. Semipermeabilitet er også ansvarlig for osmotiske processer, som er vandbevægelser på tværs af membraner fra en mindre koncentreret opløsning i den ene side til en mere koncentreret opløsning i den anden side, så begge koncentrationer bliver lige store. På denne måde er plantecellerne i stand til at vokse i størrelse takket være en højere intracellulær koncentration af visse opløsningsstoffer, der får vand til at trænge ind i cellen, hvilket igen skaber et indre hydrostatisk tryk (kaldet turgortryk), der skubber cellevæggene udad. Molekyler, der ikke frit kan krydse membraner, er nyttige for cellerne, fordi de kan skabe gradienter, der kan fungere som informationsmekanismer eller som energilagre. Celler har transmembranproteiner, der gør det muligt at krydse membranen eller flytte ladede molekyler og ioner mellem begge sider af cellemembranerne og undgå det hydrofobiske miljø på den indre membran. F.eks. udløses muskelsammentrækninger ved åbning af kanaler, der reducerer en eksisterende ionisk gradient.
Semipermeabilitet påvirkes af membranernes lipidsammensætning. F.eks. er kolesterolindholdet vigtigt i plasmamembranen. En forøgelse af kolesterolindholdet mindsker fluiditeten og øger hydrofobiciteten, hvilket i begge tilfælde gør membranen mere uigennemtrængelig. En stigning i kolesterolindholdet på over 30 % (hvilket er en høj værdi) gør således myelinmembraner meget velegnede til at isolere axonerne og optimere udbredelsen af aktionspotentialet langs axonet.
Fluiditet og laterale domæner
Fluiditet er en egenskab ved membraner. Den er relateret til molekylers evne til at bevæge sig inde i membranerne. En højere fluiditet betyder, at bevægelserne er hyppigere. Cellemembraner er faktisk et fedtlag, hvor molekylerne befinder sig i en halvflydende viskøs tilstand. Man kan derfor gætte sig til, at molekyler kan bevæge sig ved diffusion. F.eks. kan en glycerofosfolipid, der befinder sig i det ydre monolag i plasmamembranen, have to typer bevægelser: laterale, dvs. i det samme monolag, og flip-flop, dvs. springe fra det ene monolag til det andet (figur 2). I kunstige membraner er disse to typer bevægelser blevet observeret, idet de laterale bevægelser er langt hyppigere end flip-flop-bevægelser. Ved lateral diffusion kan lipider bevæge sig 30 µm på 20 sekunder; de kan bevæge sig over hele omkredsen af en mellemstor celle på et minut. Flip-flop-bevægelser er imidlertid meget sjældne, fordi lipidmolekylets hydrofile hoved skal krydse det indre lag af fedtsyrekæder, og dette er termodynamisk vanskeligt. For et lipidmolekyle er sandsynligheden for en flip-flop-forskydning ca. én gang om måneden. Kolesterol opfører sig imidlertid anderledes og kan ret let foretage flip-flop.

Membranfluiditeten kan ændre sig afhængigt af den kemiske sammensætning. Generelt øger kortere fedtsyrekæder og en større mængde umættede bindinger mellem fedtsyrernes kulbrinter membranfluiditet. Mængden af kolesterol har også indflydelse på membranens fluiditet, men nettoeffekten afhænger af temperaturen og typen af lipider i membranen. Kolesterol har to virkninger: det hæmmer overgangen til en fast geltilstand (mindre fluiditet), men mindsker også fleksibiliteten af de umættede fedtsyrekæder. Generelt kan man sige, at en stigning i kolesterolkoncentrationen mindsker membranens fluiditet, selv om virkningen ved lave temperaturer er den modsatte. Celleinterne membraner, som f.eks. i det endoplasmatiske retikulum, indeholder meget lidt kolesterol og er derfor mere flydende. Desuden giver kolesterol membranerne en anden egenskab, der kaldes hidrofobicitet, og som gør membranerne mere uigennemtrængelige.
Den forskellige molekylære sammensætning mellem de to monolag i en membran, kendt som membranasymmetri, kan generere en tydelig fluiditet i hvert monolag. Afhængigt af den molekylære sammensætning kan lipiderne være i to fysiske faser: flydende ordnede (mindre fluiditet) og flydende uordnede (mere fluiditet). Plasmamembranens ydre monolag formodes oftere at være i den flydende ordnede fase, mens det indre monolag er tilbøjeligt til at være i den flydende uordnede fase.
Cellerne kan ændre membranernes fluiditet ved at ændre deres kemiske sammensætning. Bakterier justerer f.eks. mætningen og længden af fedtsyrekæderne, så membranens fluiditet kan tilpasses til miljøforholdene. Variation i glycerophospholipidkoncentrationen, f.eks. fosfatidylethanolamin, kan også modulere fluiditeten. Nogle insekter kan ikke syntetisere steroler, som f.eks. kolesterol, og sterolerne i deres membraner kommer fra føden. De ændrer deres cellemembraners fluiditet ved hjælp af forskellige koncentrationer af phosphatidylethanolamin.
Mitokondriernes indre membran skal være en stærk uigennemtrængelig barriere for at skabe og opretholde en protongradient. Det kunne ske ved en forøgelse af kolesterolindholdet. På denne måde bliver den hidrofobiske egenskab større, men til gengæld mindsker kolesterol fluiditeten, hvilket synes at være meget vigtigt for proteinernes funktion i denne membran. Mitokondrier løser problemet med cardiolipin, en umættet fosfolipid, der øger den hidrofobiske egenskab, men ikke reducerer membranens fluiditet meget.
3. Heterogenitet
På grund af fluiditeten kan man tro, at proteinerne er tilfældigt fordelt, og at membranerne derfor er homogene med hensyn til den molekylære sammensætning, dvs. at de udviser samme molekylære indhold og andel uafhængigt af membranområdet. Dette er ikke sandt. Der er begrænsninger for den laterale diffusion af molekyler, som forårsager heterogenitet i membranen, hvilket betyder, at der findes regioner af en membran med forskellig molekylær sammensætning. I ikke-polariserede celler og på skalaer større end 200 nm ser plasmamembranen ud til at være homogen, men på skalaer under 200 nm er den heterogen. Man mener, at membranernes mikrodomæner har en størrelse på omkring 60 µm. Lipider og proteiner viser laterale bevægelser, der for det meste er begrænset til områder på 60-200 nm i løbet af nogle få millisekunder, hvorefter de hopper til et andet tilstødende område, hvor de forbliver der i endnu et kort stykke tid. Denne adfærd kaldes saltatorisk diffusion.
Begrænsninger i molekylers laterale bevægelser kan skyldes flere mekanismer: interaktioner med cytoskelettet eller den ekstracellulære matrix, interaktioner mellem membranmolekyler indbyrdes, forskellige tætheder af lokale membranområder (ændringer i fluiditeten), mængden af elektriske ladninger, membranens krumning og forskellige tykkelser af membrandomæner (figur 3).
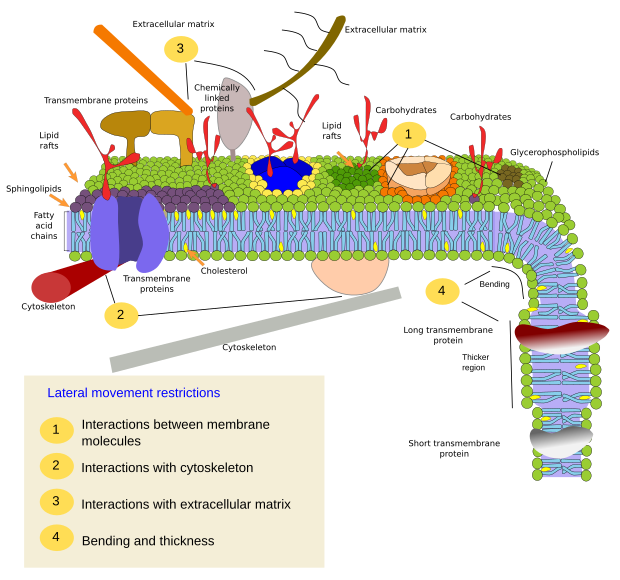
Indre interaktioner
Membranmolekylers interaktioner mellem hinanden begrænser den laterale bevægelse. Både proteiners og lipiders bevægelser påvirkes af disse interaktioner, hvilket fører til dannelse af mikrodomæner med forskellig molekylær sammensætning (figur 4). Resultatet er en lateral heterogen fordeling af molekyler i membraner. Afhængigt af de molekylære proportioner kan lipidmikrodomæner have forskellig tæthed (dvs. fluiditet): faste, flydende ordnede og flydende uordnede. Den mest almindelige tæthed er flydende uordnet, som er den mest flydende.
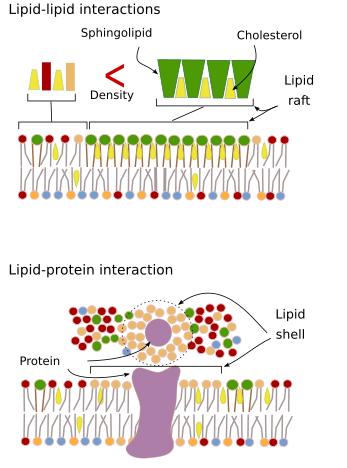
Sfingolipider og kolesterol kan blive associeret spontant mellem hinanden, hvilket reducerer deres bevægelighed og øger den molekylære tæthed i forhold til naboområder. Der dannes en lille særskilt gruppe af molekyler som en tømmerflåde i et hav af lipider. Faktisk er disse molekylære sammenslutninger kendt som lipidflåder, og man mener, at de er meget talrige og i cellemembraner. Lipidflåder udviser en meget dynamisk adfærd, de kan bevæge sig, vokse, formindskes, dukke op og forsvinde. Membraner består nemlig af mange tætte domæner, der bevæger sig lateralt mellem glycerofosfolipiderne, så membranerne er ret heterogene med hensyn til deres molekylære fordeling. Nogle eksperimenter tyder på, at visse typer proteiner “føler” sig bedre tilpas i lipidflåder. Disse proteiner tilbringer mere tid inden for end uden for lipidflåterne, og de bevæger sig derfor i et vist tidsrum inden for disse tætheder. Dette medfører en adskillelse af molekyler langs membranen og øger sandsynligheden for, at forskellige molekyler befinder sig tæt på hinanden i længere tid end tilfældigt (diffusion), hvilket øger sandsynligheden for visse molekylære reaktioner. Endvidere antages det, at en høj koncentration af visse typer lipider i lipidflåterne skaber et særskilt kemisk miljø, som gør visse kemiske reaktioner eller molekylære interaktioner lettere. Det er blevet foreslået, at lipidflåder er til stede i plasmamembranens ydre monolag, fordi det er i denne side, at sfingolipiderne er talrige. Det er blevet foreslået, at membrandomæner også findes i organellernes membraner, og man mener, at nogle af deres funktioner er afhængige af disse membrandomæner.
I plasmamembranens indre monolag dannes mikrodomæner ved elektrostatiske vekselvirkninger mellem basiske cytosoliske domæner eller tosidige kationdomæner i proteiner og lipidernes negative polære hoveder. Et andet mindre kendt eksempel er forbindelsen mellem fosfatidylinositolbisfosfat og kolesterol, som danner mikrodomæner i dette monolag. Disse mikrodomæner, der vender ud mod cytosolen, kan påvirke intracellulære proteinstilladser.
Traditionelt har man troet, at der ikke er nogen interaktioner mellem de to monolag af membraner, og at de fordeler deres mikrodomæner uafhængigt af hinanden. Der er imidlertid tegn på, at der er interaktioner mellem hinanden. Transmembranproteiner påvirker samtidig begge monolag, da de krydser hele membranen. En anden måde at synkronisere mellem de to monolag kan være medieret af de lange fedtsyrekæder, som f.eks. nogle sfingolipier, der kan have en længde på 24 kulstofatomer (den normale længde er 18). Disse lange kæder kan være indsat blandt fedtsyrekæderne i lipiderne i det andet monolag og påvirke lipidfordelingen. Desuden menes lipiddomæner med lange fedtsyrekæder at blive udlignet af lipidmikrodomæner med korte fedtsyrekæder i det andet monolag, hvorved membranens tykkelse holdes konstant.
Membranproteiner, både integrale og associerede, kan også interagere indbyrdes og samles til makromolekylære stilladser for at lette informationsoverførsel, celle-cellegenkendelse, starte nogle enzymatiske aktiviteter og cellulær bevægelse. Der findes også multimeriske proteiner, der kun er aktive, når alle underenhederne holdes sammen. Insulinreceptoren består f.eks. af fire underenheder. Proteiner og lipider kan også interagere for at danne membrandomæner. I det indre monolag er f.eks. fosfatidylinositol forbundet omkring proteiner ved hjælp af elektriske vekselvirkninger, som kan reguleres ved at ændre fosfaterne i lipidernes polære hoved.
Interaktioner med ydre elementer
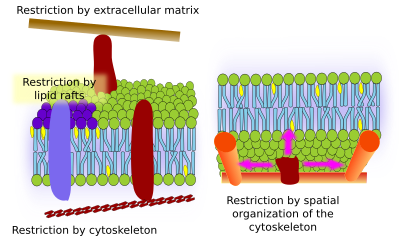
Integrale membranproteiner kan også have laterale bevægelser, men de er mere begrænsede end lipider, hovedsagelig på grund af interaktioner med den ekstracellulære matrix og cytoskelettet gennem deres ekstracellulære og intracellulære domæner, henholdsvis (figur 5). Disse interaktioner kan holde proteinerne i små områder af membranen i længere tid end blot ved diffusion. Cytoskelettet kan danne hegn lige under plasmamembranen, som holder proteinerne begrænset til små områder. Aktinfilamenter og mikrotubuli kan omslutte små områder, der begrænser difusionen af proteiner og lipider. Interaktioner med cytoskelettet er vigtige, fordi membranen bliver meget mere homogen, hvis cytoskelettet eksperimentelt desorganiseres. Cellerne har andre mekanismer til at begrænse proteiner til bestemte områder. F.eks. har tarmepitelceller nogle transportstoffer og enzymer placeret i den apikale plasmamembran, men ikke i det baso-laterale domæne på grund af et bælte af stramme junctions, en molekylær lynlås, der forhindrer diffusion mellem det apikale og baso-laterale domæne. Denne asymmetriske fordeling er afgørende for epithelcellens fysiologi.
Membranbøjning er en anden måde at skabe mikrodomæner på. En membranbøjning kan være udgangspunktet for at danne en vesikel, en cytoplasmaudvidelse til celleudvidelse, en formændring eller vækst af en organel, eller blot for at starte en barriere til begrænsning af molekylers laterale bevægelse. Der er tale om en fysisk begrænsning som følge af lipidernes 3D-disposition i den mindre vinkel af membranfolden.
De molekylære værktøjer, der er nødvendige for at bøje en membran, rekrutteres til specifikke områder af membranen. Disse mikrodomæner kan have en specifik lipidsammensætning eller et særligt elektrisk ladningsmiljø. Phosphoinositider (PIP’er), hovedsagelig PIP2 og PIP3, er lipider, der bidrager til rekruttering af proteiner til bøjning af membranen. De er nyttige molekyler, fordi den elektriske ladning og den molekylære struktur af deres polære hoveder let kan ændres ved kemiske reaktioner. På denne måde kan egenskaberne i et bestemt membranområde ændres efter behov og rekruttere specifikke proteiner. Phosphatidylserin er også i stand til at initiere et mikrodomæne til membranbøjning, når det transloceres fra det ene monolag til det andet af flipasaser.
Bøjning og tykkelse
Lipidmikrodomæner rekrutterer proteiner, der effektivt bøjer membranen. Der findes specialiserede proteiner i denne rolle (figur 6). BAR-domæneproteiner (Bin/amphyphysin/Rsv161) er et af dem. Bøjning kan induceres ved to mekanismer: samling af et buet stillads af proteiner, der trækker eller skubber membranen, og ved at indsætte aminosyresekvenser blandt lipiderne som en kile. F.eks. forårsager caveolinerne en krumning af membranen for at danne caveloae, tetraspain tvinger membraner til at danne tubuli, ESCRT hjælper med vesikeldannelse inde i endosomer for at danne multivesikulære legemer. Actin er et stærkt membranbøjningsmiddel ved polymerisering af actinfilamenter, der skubber plasmamembranen udad, hvilket fører til celleudvidelser. Mange proteiner, der kan krumme plasmamembranen, aktiverer også actinpolymerisation.
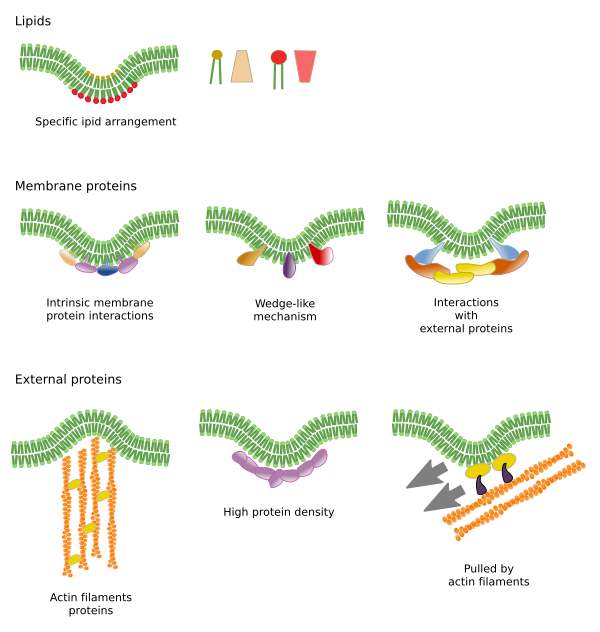
Der findes andre domæner i membraner, fysiske domæner, der dannes af molekyler som transmembranproteiner. Disse områder viser forskellig membrantykkelse, fordi de indeholder proteiner med længere hydrofobiske aminosyresekvenser, der bliver omgivet af lipider med længere fedtsyrekæder (figur 7). Disse proteiner og lipider “føles” mere behagelige, når de er sammen, da de passer ordentligt til deres hydrofobiske dele. De danner membrandomæner, der udelukker andre molekyler, enten proteiner eller lipider, med kortere hydrofobiske områder.

Bibliografía
Honigmann A, Pralle A. (2016). Kompartmentalisering af cellemembranen. Journal of mollecular biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Membran-krumning i cellebiologi: en integration af molekylære mekanismer. Journal of cell biology. 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). Højt kolesterol / lavt kolesterol: effekter i biologiskemembraner: en gennemgang Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.