1. Läpäisevyys
2. Fluiditeetti
3. Heterogeenisuus
– Sisäinen
– Ulkoinen
– Taivutus, paksuus
Solukalvojen toiminnot määräytyvät niiden molekyylikoostumuksen mukaan. Näiden molekyylien tyyppi ja osuus määräävät kalvon fysikaalis-kemialliset ominaisuudet: semipermeabiliteetti, epäsymmetria, juoksevuus, korjautuminen ja kierrätys.
Permeabiliteetti
Kalvojen semipermeabiliteetti on seurausta lipidien rasvahappoketjujen synnyttämästä membraanien sisäisestä hydrofobisesta ympäristöstä, jota sähköisesti varautuneiden molekyylien on vaikea ylittää. Estämällä molekyylien vapaan diffuusion kalvot voivat muodostaa lokeroita, jotka säilyttävät erilliset sisäiset ja ulkoiset ympäristöt. Läpäisevyys on kuitenkin valikoiva. Napaisuus ja koko ovat molekyylien tärkeimpiä ominaisuuksia, jotka vaikuttavat kykyyn läpäistä kalvoja. Pienet molekyylit, joilla ei ole sähkövarausta, kuten CO2, N2, O2, ja molekyylit, joilla on suuri liukoisuus rasvaan, kuten etanoli, voivat läpäistä kalvot lähes vapaasti passiivisen diffuusion avulla (kuva 1). Läpäisevyys on alhaisempi molekyyleille, joilla on sähkövarauksia, kun positiivisten varausten määrä on yhtä suuri kuin negatiivisten varausten määrä, joita kutsutaan varauksettomiksi molekyyleiksi, kuten vesi ja glyseroli. Voidaan ajatella, että vesi voi kulkea kalvojen läpi vapaasti, mutta joitakin rajoituksia on olemassa, ja siksi joissakin kalvoissa on akvaporiineja, eräänlaisia transmembraaniproteiineja, joissa on kanava, jonka kautta vesi voi kulkea vapaasti. Suurten varauksettomien molekyylien, kuten glukoosin, kyky ylittää kalvoja on vähäinen. Kalvot ovat erittäin läpäisemättömiä ioneille ja varautuneille molekyyleille. Passiivisen diffuusion läpäisykertoimen arvot ovat: O2: 2,3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, glyseroli: 10 -6 cm/s, natrium ja kalium: 10 -14 cm/s.
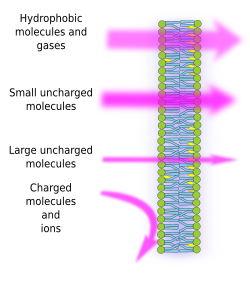
Ionien ja molekyylien epätasainen jakautuminen kalvon molemmille puolille mahdollistaa sähkökemiallisen gradientin synnyn ja ylläpitämisen. Sähkövarausten sisä- ja ulkopuolisten pitoisuuksien välistä eroa kutsutaan kalvopotentiaaliksi. Tätä gradienttia käytetään monissa solutoiminnoissa, kuten ATP-synteesissä ja tiedonsiirrossa hermoja pitkin. Semipermeabiliteetti on vastuussa myös osmoottisista prosesseista, jotka ovat veden liikkumista kalvojen läpi toisella puolella olevasta vähemmän väkevästä liuoksesta toisella puolella olevaan väkevämpään liuokseen molempien pitoisuuksien tasaamiseksi. Tällä tavoin kasvisolut pystyvät kasvamaan kooltaan joidenkin liuottimien korkeamman solunsisäisen konsentraation ansiosta, joka saa aikaan veden pääsyn soluun, mikä puolestaan tuottaa sisäisen hydrostaattisen paineen (ns. turgoripaineen), joka työntää soluseinämiä ulospäin. Molekyylit, jotka eivät läpäise kalvoja vapaasti, ovat hyödyllisiä soluille, koska ne voivat luoda gradientteja, jotka voivat toimia informaatiomekanismeina tai energiavarastoina. Soluilla on transmembraaniproteiineja, jotka mahdollistavat kalvon ylittämisen tai varautuneiden molekyylien ja ionien siirtämisen solukalvojen molemmin puolin välttäen sisäkalvon hydrofobista ympäristöä. Esimerkiksi lihassupistus käynnistyy avaamalla kanavia, jotka vähentävät olemassa olevaa ionigradienttia.
Semipermeabiliteettiin vaikuttaa kalvojen lipidikoostumus. Esimerkiksi kolesterolipitoisuus on tärkeä plasmakalvossa. Kolesterolipitoisuuden lisääntyminen vähentää juoksevuutta ja lisää hydrofobisuutta, molemmat ominaisuudet tekevät kalvosta läpäisemättömämmän. Näin ollen kolesterolin lisääminen yli 30 prosenttiin (mikä on korkea arvo) tekee myeliinikalvoista erittäin sopivia eristämään aksoneita ja optimoimaan toimintapotentiaalin etenemisen aksonia pitkin.
Fluiditeetti ja lateraalialueet
Fluiditeetti on kalvojen ominaisuus. Se liittyy molekyylien kykyyn liikkua kalvojen sisällä. Suurempi fluiditeetti tarkoittaa, että liikkeet ovat tiheämpiä. Solukalvot ovat itse asiassa rasva-arkki, jossa molekyylit ovat puoliksi nestemäisessä viskoosissa tilassa. Näin ollen voidaan arvata, että molekyylit voivat liikkua diffuusion avulla. Esimerkiksi glyserofosfolipidillä, joka sijaitsee plasmakalvon ulkoisessa monokerroksessa, voi olla kahdenlaisia liikkeitä: lateraalisia eli samassa monokerroksessa tapahtuvia liikkeitä ja flip-flop-liikkeitä eli monokerroksesta toiseen hyppäämistä (kuva 2). Keinotekoisissa kalvoissa on havaittu näitä kahta liiketyyppiä, ja lateraaliset liikkeet ovat paljon yleisempiä kuin flip-flop-liikkeet. Sivuttaisdiffuusion avulla lipidit voivat kulkea 30 µm:n matkan 20 sekunnissa; ne voivat kulkea keskikokoisen solun koko ympärysmitan minuutissa. Flip-flop-liikkeet ovat kuitenkin todella harvinaisia, koska lipidimolekyylin hydrofiilisen pään on ylitettävä rasvahappoketjujen sisäinen kerros, ja tämä on termodynaamisesti vaikeaa. Yhden lipidimolekyylin osalta flip-flop-siirtymän todennäköisyys on noin kerran kuukaudessa. Kolesteroli käyttäytyy kuitenkin toisin ja voi tehdä flip-flopin melko helposti.

Kalvon juoksevuus voi muuttua kemiallisen koostumuksen mukaan. Yleensä lyhyemmät rasvahappoketjut ja suurempi määrä tyydyttymättömiä sidoksia rasvahappojen hiilivetyjen välillä lisäävät kalvon juoksevuutta. Myös kolesterolin määrä vaikuttaa kalvon juoksevuuteen, mutta nettovaikutus riippuu lämpötilasta ja kalvon sisältämien lipidien tyypistä. Kolesterolilla on kaksi vaikutusta: se estää siirtymistä kiinteään geelitilaan (vähemmän juoksevuutta), mutta vähentää myös tyydyttymättömien rasvahappoketjujen joustavuutta. Yleisesti voidaan sanoa, että kolesterolipitoisuuden kasvu vähentää kalvon juoksevuutta, vaikka matalissa lämpötiloissa vaikutus on päinvastainen. Solun sisäiset kalvot, kuten endoplasmisen retikulumin kalvot, sisältävät hyvin vähän kolesterolia ja ovat siksi juoksevampia. Lisäksi kolesteroli antaa kalvoille toisen ominaisuuden, jota kutsutaan hidrofobisuudeksi ja joka tekee kalvoista läpäisemättömämpiä.
Kalvon kahden monokerroksen välinen erilainen molekyylikoostumus, jota kutsutaan kalvon epäsymmetriaksi, voi synnyttää erilaista juoksevuutta kummassakin monokerroksessa. Molekyylikoostumuksesta riippuen lipidit voivat olla kahdessa fysikaalisessa faasissa: nestemäisessä järjestyksessä (vähemmän juoksevuutta) ja nestemäisessä epäjärjestyksessä (enemmän juoksevuutta). Plasmakalvon ulomman monokerroksen oletetaan olevan useammin nestemäisesti järjestäytyneessä faasissa, kun taas sisempi monokerros on taipuvainen olemaan nestemäisesti epäjärjestyneessä faasissa.
Solut voivat muuttaa kalvojen juoksevuutta muuttamalla niiden kemiallista koostumusta. Esimerkiksi bakteerit säätävät rasvahappoketjujen kylläisyyttä ja pituutta niin, että kalvon juoksevuus voidaan mukauttaa ympäristöolosuhteisiin. Glyserofosfolipidien, kuten fosfatidyylietanoliamiinin, pitoisuuden vaihtelu voi myös muokata juoksevuutta. Jotkin hyönteiset eivät pysty syntetisoimaan steroleja, kuten kolesterolia, ja niiden kalvojen sterolit ovat peräisin ravinnosta. Ne muuttavat solukalvojensa juoksevuutta erilaisilla fosfatidyylietanoliamiinipitoisuuksilla.
Mitokondrioiden sisemmän kalvon on oltava vahva läpäisemätön este protonigradientin luomiseksi ja ylläpitämiseksi. Se voitaisiin tehdä lisäämällä kolesterolipitoisuutta. Näin hidrofobisuus on korkeampi, mutta vuorostaan kolesteroli vähentää juoksevuutta, joka näyttää olevan hyvin tärkeää proteiinien toiminnalle tässä kalvossa. Mitokondriot ratkaisevat ongelman kardiolipiinillä, tyydyttymättömällä fosfolipidillä, joka lisää hidrofobisuutta mutta ei juurikaan vähennä kalvon juoksevuutta.
3. Heterogeenisuus
Juoksevuuden vuoksi voidaan ajatella, että proteiinit jakautuvat satunnaisesti ja siksi kalvot ovat molekyylikoostumukseltaan homogeenisia eli niissä on sama molekyylipitoisuus ja -osuus kalvoalueesta riippumatta. Tämä ei pidä paikkaansa. Molekyylien lateraaliselle diffuusiolle on rajoituksia, jotka aiheuttavat kalvojen heterogeenisuutta, mikä tarkoittaa, että kalvolla on alueita, joilla on erilainen molekyylikoostumus. Polarisoimattomissa soluissa ja yli 200 nm:n mittakaavassa plasmakalvo näyttää homogeeniselta, mutta alle 200 nm:n mittakaavassa se on heterogeeninen. Kalvojen mikroalueiden ajatellaan olevan kooltaan noin 60 µm. Lipideillä ja proteiineilla on lateraalisia liikkeitä, jotka rajoittuvat enimmäkseen 60-200 nm:n alueisiin muutaman millisekunnin ajan ja hyppäävät sitten toiselle viereiselle alueelle, jossa ne pysyvät vielä lyhyen aikaa. Tätä käyttäytymistä kutsutaan saltatoriseksi diffuusioksi.
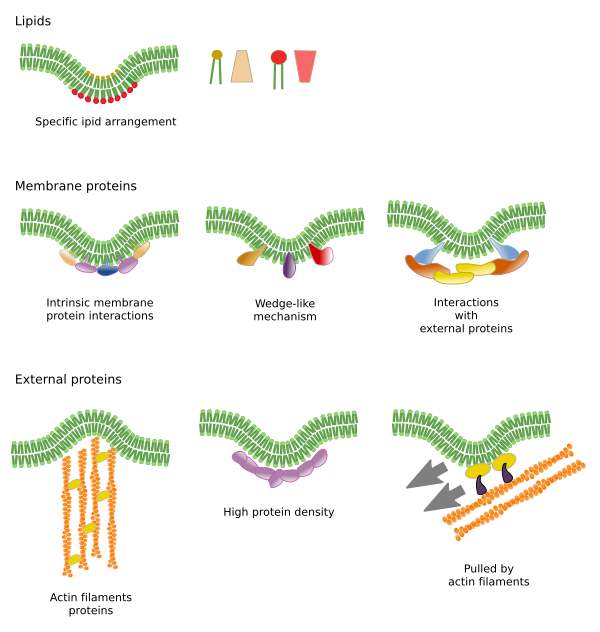
Molekyylien sivuttaisliikkeitä rajoittavat tekijät voivat johtua useista mekanismeista: vuorovaikutukset sytoskeletin tai solunulkoisen matriksin kanssa, kalvomolekyylien keskinäiset vuorovaikutukset, paikallisten kalvoalueiden erilaiset tiheydet (nestemäisyyden muutokset), sähköisten varausten määrä, kalvojen kaarevuus ja kalvodomeenien erilainen paksuus (kuva 3).
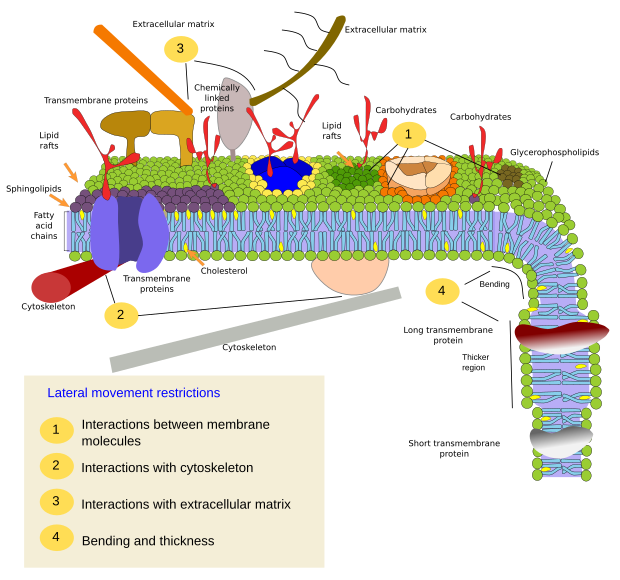
Sisäiset vuorovaikutukset
Kalvomolekyylien keskinäiset vuorovaikutukset rajoittavat sivuttaisliikettä. Nämä vuorovaikutukset vaikuttavat sekä proteiinien että lipidien liikkeisiin, mikä johtaa sellaisten mikroalueiden muodostumiseen, joilla on erilainen molekyylikoostumus (kuva 4). Tuloksena on molekyylien lateraalinen heterogeeninen jakautuminen kalvoissa. Molekyylisuhteista riippuen lipidien mikroalueilla voi olla erilainen tiheys (eli juoksevuus): kiinteä, nestemäinen järjestetty ja nestemäinen epäjärjestetty. Yleisin tiheys on liquid disordered, joka on kaikkein juoksevin.
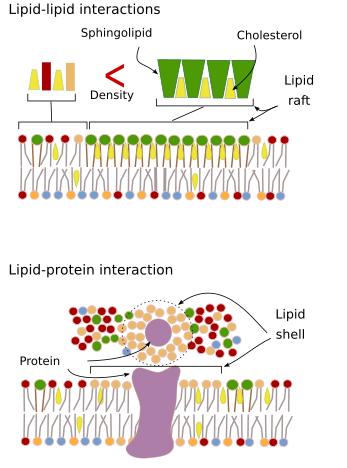
Sfingolipidit ja kolesteroli voivat assosioitua spontaanisti toistensa välille, jolloin niiden liikkuvuus vähenee ja molekyylitiheys kasvaa naapurialueisiin verrattuna. Pieni erillinen molekyyliryhmä muodostuu kuin lautta lipidien meressä. Itse asiassa nämä molekyyliyhdistymät tunnetaan nimellä lipidilautat, ja niiden uskotaan olevan hyvin runsaita ja solukalvoissa. Lipidilautat käyttäytyvät erittäin dynaamisesti, ne voivat liikkua, kasvaa, pienentyä, ilmestyä ja kadota. Kalvot koostuvat monista tiheistä alueista, jotka kulkevat sivusuunnassa glyserofosfolipidien joukossa, joten kalvot ovat varsin heterogeenisiä molekyylijakauman suhteen. Jotkut kokeet viittaavat siihen, että tietyntyyppiset proteiinit ”viihtyvät” paremmin lipidilauttojen sisällä. Nämä proteiinit viettävät enemmän aikaa lipidilauttojen sisällä kuin niiden ulkopuolella, joten ne liikkuvat jonkin aikaa näiden tiheyksien sisällä. Tämä aiheuttaa molekyylien erottumisen kalvoa pitkin ja lisää eri molekyylien todennäköisyyttä olla toistensa läheisyydessä enemmän aikaa kuin sattumalta (diffuusio), mikä lisää tällä tavoin tiettyjen molekyylireaktioiden todennäköisyyttä. Lisäksi oletetaan, että tietynlaisten lipidien suuri pitoisuus lipidilautoissa luo omanlaisensa kemiallisen ympäristön, joka helpottaa joitakin kemiallisia reaktioita tai molekyylien välisiä vuorovaikutuksia. Lipidilauttoja on ehdotettu esiintyvän plasmakalvon ulommassa monokerroksessa, koska juuri tällä puolella sfingolipidit ovat runsaita. Kalvodomeeneja on ehdotettu esiintyvän myös organellien kalvoissa, ja joidenkin niiden toimintojen uskotaan perustuvan näihin kalvodomeeneihin.
Plasmakalvon sisemmässä monokerroksessa mikrodomeenit muodostuvat sytosolisten emäksisten domeenien tai proteiinien kahdenarvoisten kationien domeenien ja lipidien negatiivisten polaaristen päiden välisistä sähköstaattisista vuorovaikutuksista. Toinen vähemmän tunnettu esimerkki on fosfatidyyliinositolibisfosfaatin ja kolesterolin välinen assosiaatio, joka muodostaa mikroalueet tässä monokerroksessa. Nämä sytosoliin päin olevat mikroalueet voivat vaikuttaa solunsisäisiin proteiinitelineisiin.
Perinteisesti on ajateltu, että molempien kalvomonikerrosten välillä ei ole vuorovaikutuksia ja että ne jakavat mikroalueensa itsenäisesti. Todisteet viittaavat kuitenkin siihen, että toistensa välillä on vuorovaikutuksia. Transmembraaniproteiinit vaikuttavat samanaikaisesti molempiin monokerroksiin, koska ne ylittävät koko kalvon. Toinen tapa synkronoida molempien monokerrosten välillä voi olla pitkien rasvahappoketjujen välittämä, kuten joidenkin sfingolipidien, joiden pituus voi olla 24 hiiltä (normaali pituus on 18). Nämä pitkät ketjut voivat asettua toisen monokerroksen lipidien rasvahappoketjujen joukkoon ja vaikuttaa lipidijakaumaan. Lisäksi pitkillä rasvahappoketjuilla varustettujen lipidialueiden ajatellaan olevan vastapainona toisessa monokerroksessa oleville lyhyillä rasvahappoketjuilla varustetuille lipidien mikroalueille, jolloin kalvon paksuus pysyy vakiona.
Kalvoproteiinit, sekä integraaliset että assosioituneet, voivat myös olla vuorovaikutuksessa toistensa kanssa ja yhdistyä makromolekyylitelineiksi helpottaakseen informaation välittämistä, solu-solu-tunnistusta, joidenkin entsymaattisten aktiviteettien käynnistämistä ja solujen liikkumista. On myös multimeerisiä proteiineja, jotka ovat aktiivisia vain silloin, kun kaikki alayksiköt ovat yhdessä. Esimerkiksi insuliinireseptori koostuu neljästä alayksiköstä. Proteiinit ja lipidit voivat myös olla vuorovaikutuksessa keskenään muodostaen kalvodomeeneja. Esimerkiksi sisäisessä monokerroksessa fosfatidylinositoli liittyy proteiinien ympärille sähköisillä vuorovaikutuksilla, joita voidaan säätää lipidien polaarisen pään fosfaatteja muuttamalla.
Vuorovaikutukset ulompien elementtien kanssa
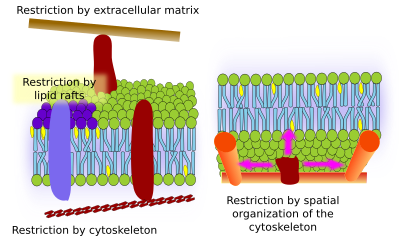
Kalvon sisäisillä proteiineilla voi myös olla sivuttaisliikkeitä, mutta ne ovat rajoitetumpia kuin lipidit, mikä johtuu enimmäkseen vuorovaikutuksesta solunulkoisen matriksin ja sytoskeletin kanssa niiden solunulkoisen ja solunsisäisen domeenin kautta (kuva 5). Nämä vuorovaikutukset saattavat pitää proteiinit pienillä kalvoalueilla pidempään kuin pelkän diffuusion avulla. Sytoskeletti voi muodostaa juuri plasmakalvon alapuolella aitoja, jotka pitävät proteiinit rajoitettuina pienille alueille. Aktiinifilamentit ja mikrotubulukset voivat sulkea sisäänsä pieniä alueita, jotka rajoittavat proteiinien ja lipidien diffuusiota. Vuorovaikutukset sytoskeletin kanssa ovat tärkeitä, koska jos sytoskeletti on kokeellisesti epäjärjestyksessä, kalvo muuttuu paljon homogeenisemmaksi. Soluilla on muitakin mekanismeja proteiinien rajoittamiseksi tiettyihin alueisiin. Esimerkiksi suoliston epiteelisoluissa jotkut transporterit ja entsyymit sijaitsevat apikaalisessa plasmakalvossa, mutta eivät baso-lateraalisessa domeenissa, koska tiukkojen liitosten vyö, molekulaarinen vetoketju, estää diffuusion apikaalisen ja baso-lateraalisen domeenin välillä. Tällainen epäsymmetrinen jakautuminen on välttämätöntä epiteelisolun fysiologian kannalta.
Membraanin taivutus on toinen tapa luoda mikroalueet. Kalvon kaarevuus voi olla lähtökohtana vesikkelin muodostamiselle, sytoplasman laajentumiselle solun laajenemista varten, organellin muodonmuutokselle tai kasvulle tai vain esteen aloittamiselle molekyylien lateraalisen liikkeen rajoittamiseksi. Tämä on fysikaalinen rajoitus, joka johtuu lipidien 3D-sijoittelusta kalvon poimun pienemmässä kulmassa.
Kalvon taivuttamiseen tarvittavat molekulaariset välineet rekrytoidaan kalvon tietyille alueille. Näillä mikroalueilla voi olla erityinen lipidikoostumus tai erityinen sähkövarausympäristö. Fosfoinositidit (PIP:t), lähinnä PIP2 ja PIP3, ovat lipidejä, jotka edistävät proteiinien rekrytointia kalvon taivuttamiseksi. Ne ovat hyödyllisiä molekyylejä, koska niiden polaaristen päiden sähkövarausta ja molekyylirakennetta voidaan helposti muuttaa kemiallisilla reaktioilla. Näin tietyn kalvoalueen ominaisuudet voivat tarvittaessa muuttua ja rekrytoida tiettyjä proteiineja. Fosfatidyyliseriini pystyy myös käynnistämään mikroalueet kalvon taipumista varten, kun flipasaasit siirtävät niitä monokerroksesta toiseen.
Taipuminen ja paksuus
Lipidimikroalueet rekrytoivat proteiineja, jotka tehokkaasti taivuttavat kalvoa. Tähän tehtävään on erikoistuneita proteiineja (kuva 6). BAR-domeeniproteiinit (Bin/amphyphysin/Rsv161) ovat yksi niistä. Taivutus voidaan saada aikaan kahdella mekanismilla: kokoamalla kaareva teline proteiineista, jotka vetävät tai työntävät kalvoa, ja asettamalla aminohapposekvenssejä lipidien väliin kiilaksi. Esimerkiksi kaveoliinit aiheuttavat kalvon kaarevuuden muodostaen kaveoleoita, tetraspaiini pakottaa kalvot muodostamaan tubuluksia, ESCRT auttaa vesikkelien muodostumisessa endosomien sisällä multivesikulaaristen kappaleiden muodostamiseksi. Aktiini taivuttaa kalvoja voimakkaasti aktiinifilamenttien polymerisaation avulla, mikä työntää plasmakalvoa ulospäin ja johtaa solun laajenemiseen. Monet proteiinit, jotka voivat kaartaa plasmakalvoa, aktivoivat myös aktiinin polymerisaatiota.
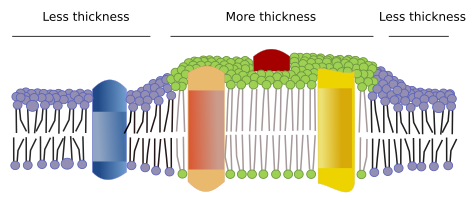
Kalvoissa on muitakin domeeneja, fysikaalisia domeeneja, joita muodostavat molekyylit, kuten transmembraaniproteiinit. Näillä alueilla on erilainen kalvon paksuus, koska ne sisältävät proteiineja, joilla on pidempiä hydrofobisia aminohapposekvenssejä ja joita ympäröivät lipidit, joilla on pidempiä rasvahappoketjuja (kuva 7). Nämä proteiinit ja lipidit ”tuntevat” olonsa mukavammaksi, kun ne ovat yhdessä, koska ne sopivat kunnolla yhteen hydrofobisten osiensa kanssa. Ne muodostavat kalvodomeeneja, jotka sulkevat pois muut molekyylit, joko proteiinit tai lipidit, joilla on lyhyemmät hydrofobiset alueet.
Bibliografía
Honigmann A, Pralle A. (2016). Solukalvon kompartmentalisaatio. Journal of mollecular biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Kalvon kaarevuus solubiologiassa: molekyylimekanismien integrointi. Journal of cell biology. 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). Korkea kolesteroli / matala kolesteroli: vaikutukset biologisissa kalvoissa: katsaus Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.