Introducción
Según la Organización Mundial de la Salud, la depresión afecta a unos 350 millones de personas en todo el mundo (Organización, 2017). Los pacientes con depresión indican síntomas de trastornos de ansiedad y acompañados con una incapacidad de experimentar placer e interés, pérdida de concentración, dudas sobre sí mismos, ansiedad social, trastorno del sueño y del apetito (Namola et al., 2015). Los principales factores que causan la depresión son sustancias químicas u hormonas desequilibradas en el cerebro. La principal hormona asociada a la depresión es la serotonina. Otras hormonas son la norepinefrina y la dopamina (Yi et al., 2008). Estas hormonas son necesarias para el funcionamiento normal del cerebro y para controlar los sentimientos. La destrucción de estas hormonas puede causar un desequilibrio químico en el cerebro que da lugar a la depresión.
La depresión puede tratarse, dependiendo de su gravedad, mediante psicoterapia o medicación. Los antidepresivos son los principales tipos de medicamentos utilizados para tratar la depresión. Hay muchos tipos diferentes de fármacos antidepresivos disponibles, y sólo se diferencian en la forma en que actúan en el cerebro, su coste y su perfil de efectos secundarios. En el tratamiento de primera línea, a la mayoría de los pacientes se les prescribe un antidepresivo tricíclico (ATC) o un inhibidor selectivo de la recaptación de serotonina (ISRS; McCarthy et al., 2016). Los fármacos que se utilizan habitualmente para el tratamiento de la ansiedad son las benzodiacepinas. Aunque hay muchos fármacos antidepresivos en el mercado utilizados para tratar la depresión, los efectos posteriores del uso de estos fármacos son muy preocupantes (Binfaré et al., 2009). Una terapia alternativa para la depresión es el uso de hierbas medicinales (Fajemiroye et al., 2016). El uso de extractos de hierbas está ganando una mayor aceptación entre la profesión médica y los pacientes. La mayoría de los remedios a base de hierbas utilizados para el tratamiento de la depresión son extractos crudos o semipurificados (Calixto et al., 2000; Carlini, 2003; Guan y Liu, 2016).
Hay escasez en los informes sobre la investigación del principio activo capaz de inducir actividad en el sistema nervioso central (SNC). Una revisión de Carlini (2003) incluye información sólo sobre efectos psicoanalépticos, psicolépticos y psicodislépticos. Una revisión reciente de Guan y Liu (2016) analiza la relación estructura-actividad de los efectos antidepresivos de los flavonoides aislados de fuentes naturales y sintéticas. Los alcaloides indólicos sintéticos, su actividad y su potencial uso en medicina ya han sido revisados en varios artículos (de Sa et al., 2009). Sin embargo, no se ha publicado ningún artículo de revisión que correlacione los alcaloides indólicos vegetales aislados con la actividad antidepresiva. Esta revisión proporciona información sobre el potencial de los alcaloides indólicos naturales para el tratamiento de los trastornos neurológicos, los estudios de la relación estructura-actividad, y la extensión de estos a otros metabolitos bioactivos como posibles pistas de fármacos antidepresivos desde la perspectiva de la estructura química. Se recopila a través de la investigación bibliográfica de revistas científicas y de la literatura relevante identificada a través de las bases de datos electrónicas de Web of Science.
Plantas Antidepresivas
Este artículo de revisión trata de las plantas que poseen actividad sobre el SNC. Aunque muchos tipos de plantas entran en esta categoría, destacaremos sólo las plantas que presentan propiedades antidepresivas. Dos plantas que contienen alcaloides indólicos son Passiflora incarnata L. (pasionaria) y Mitragyna speciosa (Korth.) Havil (kratom), mientras que las otras dos plantas que no mostraron la presencia de alcaloides indólicos son Piper methysticum G. Forst (kava) y Valeriana officinalis L., merecen una atención especial. La estructura química de los compuestos aislados de estas plantas puede servir de base para el desarrollo de nuevos fármacos.
Passiflora incarnata y otras especies como P. alata Curtis, P. coerulea L. y P. edulis Sims se utilizan ampliamente como sedantes en la medicina tradicional de la mayoría de los países europeos y de América (Houghton y Seth, 2003). La estructura de los fármacos benzodiacepínicos consiste en un anillo de benceno fusionado a un sistema de diazepina que comprende una fracción heterocíclica de siete miembros con dos átomos de nitrógeno en las posiciones 1 y 2 del anillo. Los alcaloides indólicos aislados de P. incarnata, a saber, harman, harmol, harmina, harmalol y harmalina, consisten en un anillo de benceno fusionado a un heterociclo de cinco miembros que contiene un átomo de nitrógeno.
Varios estudios han indicado que P. incarnata tiene un perfil farmacológico similar al de las benzodiazepinas y actúa a través de los receptores del ácido gamma-aminobutírico (GABA) (Jawna-Zboiñska et al., 2016). Las hojas de M. speciosa se han utilizado como medicina tradicional para tratar la diarrea, la diabetes y para mejorar la circulación sanguínea (Vicknasingam et al., 2010). La mitraginina es el principal alcaloide indólico presente en M. speciosa, junto con sus análogos, la especioginina, la paynantheina y la speciociliatina (León et al., 2009). Dos estudios realizados con el extracto acuoso y el extracto alcaloide de M. speciosa indujeron un efecto similar al de los antidepresivos en modelos de ratón de desesperación conductual (Kumarnsit et al., 2007). Un estudio realizado por Idayu et al. (2011) sobre la mitraginina muestra el efecto de los antidepresivos en el modelo de comportamiento animal de la depresión a través de la interacción con el eje hipotálamo-hipófisis-suprarrenal (HPA) en el sistema neuroendocrino (Idayu et al., 2011).
El Piper methysticum G. Forst se consume como una bebida llamada kava que induce un estado mental agradable hacia la sensación de alegría, mientras que reduce la fatiga y la ansiedad (Bilia et al., 2002). El estudio muestra que la mayoría de las actividades farmacológicas se conservan en el extracto liposoluble en comparación con el extracto acuoso. El extracto liposoluble contiene al menos siete pironas, conocidas como kavalactonas. Las kavalactonas suelen interactuar con las neurotransmisiones dopaminérgica, serotoninérgica, del ácido gamma aminobutírico (GABA) y glutamatérgica, evitan la monoamino oxidasa B (MOB) y también proporcionan una variedad de efectos en los canales iónicos (Grunze et al., 2001). La dihidrometaticina es una de las seis principales kavalactonas que se encuentran en la planta de kava. La estructura de la dihidrometaticina comprende una ariletileno-α-pirona unida a una fracción de tipo indol que comprende dos oxígenos en lugar de nitrógenos. Contribuye a la actividad ansiolítica y actúa como fármaco antidepresivo. Los estudios doblemente ciegos y controlados con placebo demostraron que las kavalactonas ejercen actividades ansiolíticas sin deprimir las funciones mentales y motoras y mejoran la calidad del sueño. Las kavalactonas son una alternativa para sustituir el uso de las benzodiacepinas en la terapia de la depresión (Malsch y Kieser, 2001).
La valeriana officinalis L., también conocida como valeriana, se utiliza ampliamente en muchos países como sedante, anticonvulsivo, por sus efectos hipnóticos y su actividad ansiolítica (Ghaderi y Jafari, 2014). El ácido valerénico y los valepotriatos han sido reportados como ingredientes activos en preparaciones farmacéuticas y los extractos crudos comerciales de valeriana han registrado su uso en muchos países (Bos et al., 2002). Los valepotriatos, que comprenden triésteres de polihidroxiciclopenta-(c)-piranos con los ácidos carboxílicos: acético, valérico, isovalérico, α-isovaleroxi-isovalérico, β-metilvalérico, β-acetoxi-isovalérico, β-hidroxiisovalérico y β-acetoxi-β-metilvalérico, se utilizan como sedantes. Los valepotriatos son inestables, termolábiles y se descomponen rápidamente en condiciones ácidas o alcalinas en agua, así como en soluciones alcohólicas (Bos et al., 2002). Los valepotriatos son útiles para mejorar las condiciones de los animales y las personas durante la retirada de las benzodiacepinas (Poyares et al., 2002).
Aunque hay una variedad de componentes químicos diferentes, se informa de que el mecanismo de acción es la interacción de la valeriana con el sistema GABA en el cerebro a través de la inhibición de la transaminasa GABA, la interacción con el receptor GABA/benzodiazepina y la interferencia en la captación y el reclutamiento de GABA en los sinaptosomas (Sichardt et al., 2007). Se han utilizado varios modelos para investigar los efectos antidepresivos de las plantas. Se utilizaron modelos farmacodinámicos in vitro, in vivo y clínicos para evaluar los efectos (Tabla 1). La mayoría de las especies de plantas seleccionadas que se revisaron se estudiaron a nivel in vivo, unas pocas se estudiaron in vitro y sólo la kava se sometió a ensayos clínicos. En todos los casos, es necesario realizar más investigaciones para establecer los compuestos activos, la dosis más efectiva y determinar si ésta varía entre los diferentes tipos de depresiones.

TABLA 1. Información de los estudios farmacológicos de las plantas revisadas.
Los alcaloides indólicos
Los alcaloides indólicos tienen una estructura bicíclica, que consiste en un anillo de benceno de seis miembros fusionado a un anillo de pirrol con nitrógeno de cinco miembros. Este anillo de pirrol con átomo de nitrógeno da lugar a las propiedades básicas de los alcaloides indólicos que los hacen especialmente activos desde el punto de vista farmacológico (El-Sayed y Verpoorte, 2007). Los alcaloides indólicos están ampliamente distribuidos en plantas pertenecientes a las familias Apocynaceae, Loganiaceae, Rubiaceae y Nyssaceae. Entre los alcaloides indólicos importantes que se han aislado de las plantas se encuentran el fármaco antihipertensivo reserpina de Rauvolfia serpentina (Sagi et al., 2016) y los potentes fármacos antitumorales vinblastina y vincristina de Catharanthus roseus (El-Sayed y Verpoorte, 2007). Los estudios sobre la eficacia de los alcaloides indólicos en el tratamiento de la depresión no son nuevos y se llevan a cabo desde 1952, pero actualmente la comunidad científica ha prestado muy poca atención a los beneficios de la utilidad terapéutica de las plantas dotadas de propiedades antidepresivas.
Los alcaloides indólicos se asocian a menudo con la función de los receptores de la proteína G, en particular para la transmisión de señales neuronales a través de los receptores para la serotonina (5-HT/hidroxitriptamina). Además del donante de hidrógeno a través del N-H libre, la presencia de la densidad de electrones π contribuye a la energía del orbital molecular más ocupado (HOMO) del esqueleto de indol plano. Esto permite la interacción con las nucleobases, en particular el átomo protonado, así como con las proteínas objetivo (de Sa et al., 2009). La estructura química del neurotransmisor serotonina se basa en un anillo de indol aromático rico en electrones. La presencia del átomo de nitrógeno en el anillo de indol es para mantener el sistema aromático y hace que la unión de N-H sea ácida en lugar de básica. El anillo de indol es capaz de formar enlaces de hidrógeno a través de la fracción N-H y el apilamiento π-π o las interacciones catión-π, a través de la fracción aromática (Shimazaki et al., 2009). La hidrofobicidad de los anillos de indol es casi la misma que la de la subunidad de fenilo y menos hidrofóbica que la de los clásicos anillos isostéricos de benzotiofeno y benzofurano. El grupo N-H del indol desempeña un papel decisivo en la interacción con el biorreceptor diana, mientras que los derivados sintetizados de benzotiofeno y benzofurano muestran una afinidad de moderada a limitada por el biorreceptor diana (de Sa et al., 2009). La reserpina es uno de los ejemplos de alcaloides indólicos aislados durante los últimos 60 años que muestran una acción sedante sobre el SNC. Por cierto, dos sustancias químicas, a saber, la triptamina y la serotonina, que se encuentran en el cerebro, son también derivados de alcaloides indólicos.
En la actualidad, los componentes activos de los extractos de plantas responsables del efecto antidepresivo siguen sin estar claros. Por lo tanto, tratamos de identificar algunas estructuras químicas importantes aisladas de extractos de plantas que presentan actividades antidepresivas y determinar la similitud del patrón del esqueleto que podría contribuir a la actividad antidepresiva. Se han realizado los primeros intentos de identificar las similitudes estructurales entre la serotonina y los alcaloides indólicos. La similitud más evidente consiste en anillos heterocíclicos de seis miembros fusionados con anillos de cinco miembros. La diferencia es la presencia de un átomo de nitrógeno o la distribución de electrones π (Figura 1). A través de un estudio de relación estructura-actividad Nichols (2012) informó que la variación en la actividad de los diferentes tipos de moléculas sugiere que el receptor es muy sensible a la naturaleza de la triptamina. En este artículo de revisión se mencionan otros compuestos químicos que se han aislado con éxito de las plantas antidepresivas porque quizá sean agonistas específicos con patrones de sustitución particulares que pueden activar selectivamente un subconjunto de efectores. Este fenómeno se conoce ahora como selectividad funcional.
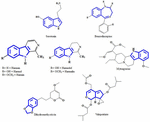
FIGURA 1. Estructuras químicas de la serotonina, la benzodiazepina y los compuestos aislados de las plantas antidepresivas. Similitud en el patrón del esqueleto, que consiste en anillos heterocíclicos de seis miembros, unidos con anillos de cinco miembros.
La serotonina, es ampliamente utilizada en la función cerebral y la cognición como agonista del receptor endógeno (Fink y Göthert, 2007). La serotonina ejerce sus funciones a través de siete familias de receptores (5-HT1-5-HT7) que son miembros de la familia de receptores acoplados a proteínas G. Se ha descrito que una serie de compuestos con la fracción de indol poseen afinidad hacia diferentes receptores de serotonina (Kochanowska-Karamyan y Hamann, 2010). La similitud estructural de los alcaloides indólicos (agonistas exógenos) con neurotransmisores endógenos como la serotonina ha llevado a los investigadores a predecir la potencial actividad neurológica de estas moléculas. El esquema de los procesos asociados a la neurotransmisión de los agonistas exógenos se describe en la Figura 2.
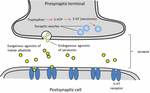
FIGURA 2. Esquema de los procesos asociados a la neurotransmisión. Agonistas exógenos de alcaloides indólicos de plantas que comparten similitudes de estructura con la serotonina, lo que les permite unirse a los receptores de serotonina (receptores 5-HT).
El anillo indólico también se conoce como bioisóteres y tiene similitudes químicas y físicas con las moléculas biológicas. Esta similitud se utiliza en el desarrollo del fármaco prototipo que pretende mejorar la actividad farmacológica y optimizar el perfil farmacocinético. En otro estudio de evaluación farmacológica de benzofuranos y tienopirrol se obtuvieron moléculas bioisotéricas que poseen una actividad similar a la de la dimetiltriptamina. Los primeros trabajos con benzotiofenos y 3-indenalkilaminas demostraron que, en el caso de los compuestos que carecen de sustituyentes en el anillo, la capacidad de actuar como agonistas en el fondo de ojo de la rata era aproximadamente la misma que la de las triptaminas. Los resultados revelaron que el NH del indol no era esencial para activar el receptor 5-HT2 en el fondo de la rata (Nichols, 2012). Una serie de antagonistas del receptor NK1 del indol 2-arilo y sus derivados son buenos ligandos pero tienen una baja biodisponibilidad oral en ratas. Con el fin de aumentar la solubilidad y la absorción, se introdujo el nitrógeno básico, dando lugar al azaindole análogo y a los compuestos relacionados que presentan la misma afinidad de unión a NK1 con la serie de antagonistas del receptor NK1 del indol 2-arilo (Cooper et al., 2001). El acoplamiento molecular de 2 ligandos derivados del fenilindol con los receptores de serotonina 5-HT6 y melanocortina-4 indica que el andamiaje privilegiado puede acomodarse en función de la naturaleza conservada del subbolsillo y del bolsillo de unión no conservado. Las interacciones de las partes no conservadas del bolsillo de unión son responsables de importantes diferencias en el reconocimiento molecular por parte del receptor diana correspondiente (Bondensgaard et al., 2004).
Según de Sa et al. (2009) los alcaloides indólicos comunes encontrados en fuentes naturales son los aminoácidos triptófanos en la nutrición humana y el descubrimiento de hormonas vegetales que tienen efectos terapéuticos como antiinflamatorios, un inhibidor de la fosfodiesterasa, agonistas y antagonistas del receptor 5-HT, agonistas del receptor cannabinoide e inhibidores de la HMG-CoA reductasa. El andamio del indol tiene bolsillos de unión y posee un dominio de unión complementario común al receptor objetivo, que pertenece a una clase de GPCR (receptores de membrana importantes de la proteína G acoplados). La mayoría de los fármacos del mercado contienen la subestructura indol. Entre ellos se encuentran la indometacina, la ergotamina, el frovatriptán, el ondansetrón y el tadalafil.
Conclusión
Esta revisión encontró que la mayoría de los remedios a base de plantas indicados para el tratamiento de dolencias psiquiátricas eran crudos o semipurificados. Los resultados in vivo e in vitro varían y no son reproducibles porque en diferentes regiones biogeográficas el contenido de metabolitos secundarios de las plantas se correlaciona con la disponibilidad de nutrientes, el clima y las condiciones ecológicas. Además, la bioactividad de las plantas podría ser aportada por un solo compuesto o una mezcla de compuestos. Los autores sugieren que el esfuerzo por obtener principios activos, la identificación de fitoquímicos y el estudio de metabolómica se realicen con inspecciones in vitro e in vivo para una mejor caracterización de los fármacos de origen vegetal. En la mayoría de los casos, la síntesis de los alcaloides indólicos se inspiró en las moléculas naturales y en su similitud con la serotonina.
Los alcaloides indólicos de origen vegetal son bastante complejos en comparación con los sintéticos. La importancia de los alcaloides indólicos sintéticos ya está establecida, ya que la estructura está disponible en varios receptores de ligandos, inhibidores de enzimas y moduladores de biorreceptores. Algunos de los alcaloides indólicos de origen natural no pueden sintetizarse con los métodos conocidos actualmente. Además, la mayor parte de la información sobre la eficacia de los alcaloides indólicos se ha obtenido a partir de alcaloides indólicos sintéticos. En consecuencia, el potencial de muchos alcaloides indólicos de origen natural como nuevos fármacos para diversos trastornos psiquiátricos sigue sin explotarse. Históricamente, los compuestos de origen vegetal han sido la fuente de varios de los fármacos más exitosos utilizados en medicina. Esto indica que podría haber más por descubrir.
En conclusión, varios alcaloides indólicos se han empleado como antidepresivos o proporcionan estructuras de pista para su desarrollo. Basándonos en nuestros hallazgos, las plantas contienen una reserva de alcaloides indólicos que son valiosos puntos de partida para el desarrollo de futuros antidepresivos.
Contribuciones de los autores
HH: Preparación del manuscrito. MY: Editar el idioma inglés y sugerir alguna información importante para mejorar el manuscrito. AR: Contribuir a la comprensión del esquema de los procesos asociados con la neurotransmisión.
Financiación
El apoyo a este trabajo fue proporcionado por la Universiti Malaysia Pahang a través de la beca de investigación UMP RDU170302 a HH.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Bilia, A. R., Gallori, S., y Vincieri, F. F. (2002). Kava-kava y la ansiedad: aumento de los conocimientos sobre la eficacia y la seguridad. Life Sci. 70, 2581-2597. doi: 10.1016/S0024-3205(02)01555-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Binfaré, R. W., Rosa, A. O., Lobato, K. R., Santos, A. R., and Rodrigues, A. L. S. (2009). La administración de ácido ascórbico produce un efecto similar al antidepresivo: evidencia de la participación de la neurotransmisión monoaminérgica. Prog. Neuropsychopharmacol. Biol. Psychiatry 33, 530-540. doi: 10.1016/j.pnpbp.2009.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Bondensgaard, K., Ankersen, M., Thøgersen, H., Hansen, B. S., Wulff, B. S., and Bywater, R. P. (2004). Reconocimiento de estructuras privilegiadas por los receptores acoplados a proteínas G. J. Med. Chem. 47, 888-899. doi: 10.1021/jm0309452
PubMed Abstract | CrossRef Full Text | Google Scholar
Bos, R., Woerdenbag, H. J., and Pras, N. (2002). Determinación de valepotriatos. J. Chromatogr. A 967, 131-146. doi: 10.1016/S0021-9673(02)00036-5
CrossRef Full Text | Google Scholar
Calixto, J. B., Beirith, A., Ferreira, J., Santos, A. R., and Yunes, R. A. (2000). Naturally occurring antinociceptive substances from plants. Phytother. Res. 14, 401-418. doi: 10.1002/1099-1573(200009)14:6<401::AID-PTR762>3.0.CO;2-H
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlini, E. (2003). Las plantas y el sistema nervioso central. Pharmacol. Biochem. Behav. 75, 501-512. doi: 10.1016/S0091-3057(03)00112-6
CrossRef Full Text | Google Scholar
Cooper, L. C., Chicchi, G. G., Dinnell, K., Elliott, J. M., Hollingworth, G. J., Kurtz, M. M., et al. (2001). 2-Aryl indole NK 1 receptor antagonists: optimisation of indole substitution. Bioorg. Med. Chem. Lett. 11, 1233-1236. doi: 10.1016/S0960-894X(01)00182-2
CrossRef Full Text | Google Scholar
de Sa, A., Fernando, R., Barreiro, E. J., Fraga, M., y Alberto, C. (2009). De la naturaleza al descubrimiento de fármacos: el andamio indólico como «estructura privilegiada». Mini Rev. Med. Chem. 9, 782-793. doi: 10.2174/138955709788452649
CrossRef Full Text | Google Scholar
El-Sayed, M., and Verpoorte, R. (2007). Catharanthus terpenoid indole alkaloids: biosynthesis and regulation. Phytochem. Rev. 6, 277-305. doi: 10.1007/s11101-006-9047-8
CrossRef Full Text | Google Scholar
Fajemiroye, J. O., Silva, D. M., Oliveira, D. R., and Costa, E. A. (2016). Tratamiento de la ansiedad y la depresión: plantas medicinales en retrospectiva. Fundam. Clin. Pharmacol. 30, 198-215. doi: 10.1111/fcp.12186
PubMed Abstract | CrossRef Full Text | Google Scholar
Fiebich, B. L., Knörle, R., Appel, K., Kammler, T., and Weiss, G. (2011). Estudios farmacológicos en una combinación de medicamentos a base de hierbas de la hierba de San Juan (Hypericum perforatum) y la flor de la pasión (Passiflora incarnata): evidencia in vitro e in vivo de la sinergia entre Hypericum y Passiflora en modelos farmacológicos antidepresivos. Fitoterapia 82, 474-480. doi: 10.1016/j.fitote.2010.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Fink, K. B., and Göthert, M. (2007). 5-HT receptor regulation of neurotransmitter release. Pharmacol. Rev. 59, 360-417. doi: 10.1124/pr.59.07103
CrossRef Full Text | Google Scholar
Ghaderi, N., and Jafari, M. (2014). Regeneración vegetal eficiente, fidelidad genética y acumulación de alto nivel de dos compuestos farmacéuticos en plantas regeneradas de Valeriana officinalis L. S. Afr. J. Bot. 92, 19-27. doi: 10.1016/j.sajb.2014.01.010
CrossRef Full Text | Google Scholar
Grunze, H., Langosch, J., Schirrmacher, K., Bingmann, D., Von Wegerer, J., y Walden, J. (2001). Kava pyrones exert effects on neuronal transmission and transmembraneous cation currents similar to established mood stabilizers-a review. Prog. Neuropsychopharmacol. Biol. Psychiatry 25, 1555-1570.
Google Scholar
Guan, L.-P., y Liu, B.-Y. (2016). Efectos y mecanismos antidepresivos de los flavonoides y análogos relacionados. Eur. J. Med. Chem. 121, 47-57. doi: 10.1016/j.ejmech.2016.05.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hattesohl, M., Feistel, B., Sievers, H., Lehnfeld, R., Hegger, M., and Winterhoff, H. (2008). Extracts of Valeriana officinalis L. sl show anxiolytic and antidepressant effects but neither sedative nor myorelaxant properties. Phytomedicine 15, 2-15. doi: 10.1016/j.phymed.2007.11.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Houghton, P. J., and Seth, P. (2003). Las plantas y el sistema nervioso central. Pharmacol. Biochem. Behav. 75, 497-499. doi: 10.1016/S0091-3057(03)00161-8
CrossRef Full Text | Google Scholar
Idayu, N. F., Hidayat, M. T., Moklas, M., Sharida, F., Raudzah, A. N., Shamima, A., et al. (2011). Efecto antidepresivo de la mitraginina aislada de Mitragyna speciosa Korth en un modelo de depresión en ratones. Phytomedicine 18, 402-407. doi: 10.1016/j.phymed.2010.08.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Jawna-Zboiñska, K., Blecharz-Klin, K., Joniec-Maciejak, I., Wawer, A., Pyrzanowska, J., Piechal, A., et al. (2016). Passiflora incarnata L. Improves spatial memory, reduces stress, and affects neurotransmission in rats. Phytother. Res. 30, 781-789. doi: 10.1002/ptr.5578
PubMed Abstract | CrossRef Full Text | Google Scholar
Kochanowska-Karamyan, A. J., and Hamann, M. T. (2010). Marine indole alkaloids: potential new drug leads for the control of depression and anxiety. Chem. Rev. 110, 4489-4497. doi: 10.1021/cr900211p
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumarnsit, E., Vongvatcharanon, U., Keawpradub, N., and Intasaro, P. (2007). Fos-like immunoreactivity in rat dorsal raphe nuclei induced by alkaloid extract of Mitragyna speciosa. Neurosci. Lett. 416, 128-132. doi: 10.1016/j.neulet.2007.01.061
PubMed Abstract | CrossRef Full Text | Google Scholar
León, F., Habib, E., Adkins, J. E., Furr, E. B., McCurdy, C. R., and Cutler, S. J. (2009). Caracterización fitoquímica de las hojas de Mitragyna speciosa cultivadas en EEUU. Nat. Prod. Commun. 4, 907-910.
PubMed Abstract | Google Scholar
Malsch, U., and Kieser, M. (2001). Eficacia del kava-kava en el tratamiento de la ansiedad no psicótica, tras el tratamiento previo con benzodiacepinas. Psychopharmacology 157, 277-283. doi: 10.1007/s002130100792
PubMed Abstract | CrossRef Full Text
McCarthy, A., Wafford, K., Shanks, E., Ligocki, M., Edgar, D. M., and Dijk, D.-J. (2016). Homeostasis del sueño REM en ausencia de sueño REM: Efectos de los antidepresivos. Neuropharmacology 108, 415-425. doi: 10.1016/j.neuropharm.2016.04.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Namola, V., Ratan, P., y Kothiyal, P. (2015). Depresión y papel de los biomateriales marinos: una revisión. Eur. J. Biomed. Pharm. Sci. 2, 137-148.
Nichols, D. E. (2012). Relaciones estructura-actividad de los agonistas de la serotonina 5-HT 2A. WIREs Membr. Transp. Signaling 1, 559-579. doi: 10.1002/wmts.42
CrossRef Full Text | Google Scholar
Organización, W. H. (2017). Hoja informativa sobre la depresión 2016. Disponible en: http://www.who.int/mediacentre/factsheets/fs369/en/
Google Scholar
Poyares, D. R., Guilleminault, C., Ohayon, M. M., y Tufik, S. (2002). ¿Puede la valeriana mejorar el sueño de los insomnes tras la abstinencia de benzodiazepinas? Prog. Neuropsychopharmacol. Biol. Psychiatry 26, 539-545.
PubMed Abstract | Google Scholar
Sagi, S., Avula, B., Wang, Y.-H., y Khan, I. A. (2016). Quantification and characterization of alkaloids from roots of Rauwolfia serpentina using ultra-high performance liquid chromatography-photo diode array-mass spectrometry. Anal. Bioanal. Chem. 408, 177-190. doi: 10.1007/s00216-015-9093-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Sarris, J., Kavanagh, D., Byrne, G., Bone, K., Adams, J., and Deed, G. (2009). The Kava Anxiety Depression Spectrum Study (KADSS): a randomized, placebo-controlled crossover trial using an aqueous extract of Piper methysticum. Psychopharmacology 205, 399-407. doi: 10.1007/s00213-009-1549-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Shimazaki, Y., Yajima, T., Takani, M., and Yamauchi, O. (2009). Metal complexes involving indole rings: structures and effects of metal-indole interactions. Coord. Chem. Rev. 253, 479-492. doi: 10.1016/j.ccr.2008.04.012
CrossRef Full Text | Google Scholar
Sichardt, K., Vissiennon, Z., Koetter, U., Brattström, A., and Nieber, K. (2007). Modulation of postsynaptic potentials in rat cortical neurons by valerian extracts macerated with different alcohols: involvement of adenosine A1-and GABAA-receptors. Phytother. Res. 21, 932-937. doi: 10.1002/ptr.2197
PubMed Abstract | CrossRef Full Text | Google Scholar
Vicknasingam, B., Narayanan, S., Beng, G. T., and Mansor, S. M. (2010). The informal use of ketum (Mitragyna speciosa) for opioid withdrawal in the northern states of peninsular Malaysia and implications for drug substitution therapy. Int. J. Drug Policy 21, 283-288. doi: 10.1016/j.drugpo.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Vijeepallam, K., Pandy, V., Kunasegaran, T., Murugan, D. D., and Naidu, M. (2016). El extracto de hoja de Mitragyna speciosa exhibe un efecto similar al de los antipsicóticos con el potencial de aliviar los síntomas positivos y negativos de la psicosis en ratones. Front. Pharmacol. 7:464. doi: 10.3389/fphar.2016.00464
PubMed Abstract | CrossRef Full Text | Google Scholar
Yi, L.-T., Li, J.-M., Li, Y.-C., Pan, Y., Xu, Q., y Kong, L.-D. (2008). Antidepressant-like behavioral and neurochemical effects of the citrus-associated chemical apigenin. Life Sci. 82, 741-751. doi: 10.1016/j.lfs.2008.01.007
PubMed Abstract | CrossRef Full Text | Google Scholar
.