Antecedentes
Artemisia annua es una hierba medicinal china (también conocida como «qing hao» o «ajenjo dulce») con una actividad antipalúdica bien probada (1). La Organización Mundial de la Salud (OMS) recomienda las terapias combinadas basadas en derivados de la artemisinina para el tratamiento de la malaria no complicada en combinación con agentes antipalúdicos eficaces (2). La quimioprofilaxis para los viajeros depende del destino de viaje con paludismo endémico e incluye una combinación deatovaquon/proguanil, cloroquina, doxiciclina, mefloquina o primaquina (3, 4). Se han descrito casos de infección por paludismo bajo quimioprofilaxis con derivados de la artemisina (5) y la OMS no recomienda el uso de material vegetal de A. annua, en cualquiera de sus formas, incluido el té, para el tratamiento o la prevención del paludismo (6).
Los suplementos herbales y dietéticos (HDS) se utilizan cada vez más en todo el mundo y las lesiones hepáticas inducidas por los HDS se están convirtiendo en una preocupación creciente (7). A pesar del amplio uso de TCA en las zonas donde la malaria es endémica, las lesiones hepáticas derivadas de la artemisinina son poco frecuentes (8, 9). Kumar informó de un caso de un paciente que desarrolló una lesión hepática colestásica 6 semanas después de tomar un suplemento de hierbas que contenía artemisinina por vía oral para el mantenimiento de la salud general (10). Hay otras pocas publicaciones relacionadas con la lesión hepática inducida por Artemisia annua (9, 11-14). La Asociación China de Medicina China ha propuesto recientemente una guía clínica para evaluar la causalidad y hacer el diagnóstico de la lesión hepática inducida por hierbas (15). Presentamos un caso de hepatitis colestásica aguda debida a la ingesta de té de Artemisia como quimioprofilaxis en un paciente que regresaba de Etiopía.
Informe del caso
Un hombre de 51 años se presentó en el servicio de urgencias del Hospital Universitario de Basilea, Suiza, con malestar, molestias abdominales, heces amarillas flotantes, ictericia y coluria de 4 días de duración y una pérdida de peso de 6-8 kg en las últimas 6 semanas. Había regresado de un viaje de 4 semanas a Etiopía 3 semanas antes de buscar atención médica. Durante su estancia en Etiopía, consumía diariamente 1,25 g de té en polvo de Artemisia annua como quimioprofilaxis de la malaria. En un 90% de los casos diluyó el polvo en agua hirviendo, y en el 10% restante lo ingirió mezclado con alimentos. El suplemento se había comprado por Internet. El paciente nos proporcionó el envase, que originalmente contenía 50 g de un polvo verde oscuro (Figura 1). En el momento de la presentación había 2 g en el envase, lo que indica que había consumido un total de 48 g. Durante su estancia en Etiopía, también había consumido otros preparados similares al té. Hasta donde sabemos, no se ha descrito ninguna hepatotoxicidad relacionada con estas sustancias. Negó haber tomado otros medicamentos con receta, sin receta o a base de hierbas. No tenía antecedentes previos ni familiares de enfermedad hepática, abuso de alcohol o drogas, ni factores de riesgo de hepatitis viral. Informó de que su esposa, que le acompañó en su viaje a Etiopía, también había consumido té de Artemesia annua para la profilaxis de la malaria. Ella se mantuvo bien en todo momento.

Figura 1. Té de polvo de Artemisia annua.
Aparte de la ictericia marcada, se encontraba en buen estado general y tenía unos signos vitales poco llamativos (afebril con presión arterial, frecuencia cardíaca y respiratoria normales).
Las pruebas de laboratorio mostraron: alanina aminotransferasa (ALAT) 91 U/L (normal, 9-59); aspartato aminotransferasa (ASAT) 42 U/L (normal, 9-34); fosfatasa alcalina (ALP) 151 U/L (normal, 40-130); gamma-glutamil transferasa (GGT) 416 U/L (normal, 12-68); bilirrubina total 186.6 μmol/L (normal, 0-24) (bilirrubina conjugada 168,5 μmol/L); y ratio internacional normalizado (INR) 0,9 (normal, 0,9-1,3). El nivel de ácidos biliares estaba elevado a un nivel de 460,5 μmol/L (normal, 0-8,0). El recuento sanguíneo diferencial y la proteína c-reactiva eran normales. Había una leve hiponatremia e hipocloremia, consistentes con el aumento de la ingesta de agua del paciente en los días anteriores. Las pruebas serológicas para las hepatitis A, B, C y E agudas, el virus de Epstein-Barr y la infección por citomegalovirus fueron negativas. La coeruloplasmina era normal. Los autoanticuerpos específicos del hígado (anticuerpos antinucleares, anticuerpos antineutrófilos, anticuerpos antimúsculo liso, anticuerpos antimitocondriales, anticuerpos antiproteinasa 3 y anticuerpos antimieloperoxidasa) eran negativos y las IgA, IgM e IgG estaban dentro del rango normal. La ecografía abdominal mostró un parénquima hepático, vasos y conductos biliares normales. La elastografía hepática era elevada (FibroScan, 12,7 kPa, rango normal <5 kPa).
La paciente también fue evaluada en el Instituto Suizo de Salud Pública y Tropical para detectar varias posibles condiciones infecciosas subyacentes. Los anticuerpos contra la rickettsia fueron positivos, pero se consideró que esto no estaba relacionado con la presentación clínica y no se inició ningún tratamiento antibiótico.
La biopsia hepática inicial mostró una hepatitis portal con infiltración linfocítica de los conductos biliares y bilirrubinostasis difusa intracanalicular e intracitoplasmática. No se observó fibrosis ni material parasitario (Figuras 2A,B). Un análisis de secuenciación de nueva generación en el ADN de los leucocitos de sangre periférica en busca de variantes genéticas en los genes que codifican los 3 transportadores hepáticos más importantes para la homeostasis de los ácidos biliares, a saber, BSEP, MDR3 y FIC1, no encontró variantes típicamente asociadas a las enfermedades hepáticas colestásicas hereditarias.
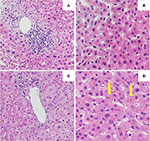
Figura 2. Histología de la primera (A,B) y segunda (C,D) biopsia hepática. (A) Vista de bajo poder de la biopsia hepática que muestra un infiltrado linfocítico portal . (B) Parénquima hepático con bilirrubinostasis intracelular (HE, 20x). (C) Vista a bajo poder de la biopsia hepática sin inflamación portal significativa (HE, 10x). (D) Parénquima hepático con bilirrubinostasis intracelular y extracelular significativa (flecha) (HE, 20x).
El análisis toxicológico del té de Artemisia mediante cromatografía líquida-espectrometría de masas y cromatografía de gases-espectrometría de masas reveló los siguientes ingredientes: arteannuin b, deoxyartemisin, camphor y scopoletin.
Se inició un tratamiento con prednisona 20 mg dos veces al día y ácido ursodesoxicólico 500 mg dos veces al día. Debido a la ictericia persistente así como al aumento de la bilirrubina durante 4 semanas a pesar del tratamiento, se realizó una segunda biopsia hepática. La segunda biopsia mostró una severa bilirrubinostasis intracitoplasmática así como intracanalicular, con una mínima inflamación en comparación con la primera biopsia (Figuras 2C,D). Se suspendió el tratamiento con corticosteroides, se continuó con ácido ursodesoxicólico hasta la resolución de la ictericia y la normalización de la bilirrubina (15,3 μmol/l) (Figura 3) y la disminución relevante de los ácidos biliares (19,5 μmol/l) que se produjo tres meses después del inicio de la enfermedad.
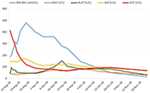
Figura 3. Evolución de la bilirrubina y las enzimas hepáticas a lo largo del tiempo.
El caso se notificó a la unidad de farmacovigilancia de la autoridad nacional suiza de productos terapéuticos (Swissmedic). Se obtuvo el consentimiento informado por escrito del participante para la publicación de este informe de caso.
Discusión
Los derivados de la artemisina son una piedra angular para el tratamiento pero no para la quimioprevención de la malaria (2). A pesar de su amplio uso, rara vez se han descrito lesiones hepáticas causadas por los derivados de la artemisinina (8, 10). Por lo que sabemos, éste es el primer caso descrito de una hepatitis colestásica aguda debida a la ingesta de té de Artemisia annua.
La lesión hepática inducida por hierbas y suplementos dietéticos es un tema de creciente interés desde que los HDS se utilizan cada vez más en todo el mundo (7). La ingesta de HDS suele considerarse inofensiva; sin embargo, se ha notificado un número creciente de acontecimientos adversos que se producen junto con su uso (16). Además, como la concentración y la composición de las HDS no suelen declararse en las etiquetas de los productos, se desconoce la calidad y la cantidad de sus ingredientes. En nuestro caso, el diagnóstico de lesión hepática inducida por HDS debido a la ingesta de té de Artemisia annua se basó en la fuerte relación temporal entre la exposición y el desarrollo de la reacción adversa y la ausencia de otras posibles etiologías. Se calculó la puntuación de evaluación de la causalidad según el método RUCAM (Roussel Uclaf Causality Assessment Method) (17) y se obtuvo una puntuación de 6 correspondiente a una causalidad «probable» del fármaco incriminado. Los diferentes ítems se puntuaron de la siguiente manera: tiempo de aparición (+2), curso (+1), factores de riesgo (+1), fármacos concomitantes (-1), exclusión de otras causas de lesión hepática (+2), información previa sobre hepatotoxicidad del fármaco (+1), respuesta a la readministración (0). No hubo otras etiologías identificables de la enfermedad hepática.
El caso descrito previamente por Kumar presentó un patrón hepatocelular de lesión hepática, seguido de una fase colestática prolongada (10). Nuestro paciente presentó un patrón de lesión hepática predominantemente colestático 5 semanas después de la primera ingestión de té de Artemisia annua. Suponemos que la historia natural fue similar a la del caso de Kumar, pero que nuestra paciente se presentó en una fase posterior durante la evolución de la lesión hepática. En el análisis toxicológico de la tisana ingerida identificamos además escopoletina y alcanfor, que se encuentran de forma natural en la Artemisia annua (18, 19) y pueden haber contribuido a la aparición de la lesión hepática colestásica.
El mecanismo de la lesión hepática inducida por los derivados de la artemisinina sigue sin estar claro. Los componentes químicos de Artemisiae spp incluyen aceites volátiles, flavonoides, taninos, triterpenos y polisacáridos. Los aceites volátiles de Artemisiae spp tienen una fuerte actividad farmacológica y toxicidad, y un reciente enfoque bioinformático identificó varias vías que pueden estar implicadas en el desarrollo de la lesión hepática (20). La predisposición a la lesión hepática colestásica inducida por fármacos se ha asociado a polimorfismos de la bomba de exportación de sales biliares (21, 22). Por tanto, buscamos variantes en los transportadores de ácidos biliares mediante secuenciación de nueva generación. No detectamos ninguna deleción, duplicación o variante patológica en las secuencias de los genes ABCB11, ATP8B1 y ABCB4 (regiones codificantes y flanqueantes) que codifican BSEP, FIC1 y MDR3, respectivamente (Figura 4). Sin embargo, se identificaron varias variantes de secuencia comunes. Nuestra paciente albergaba de forma homocigótica una variante del gen ABCB11 . Se ha debatido si este polimorfismo está asociado a la colestasis intrahepática familiar benigna recurrente y/o progresiva y a la colestasis intrahepática del embarazo (23, 24). Además, se detectó otra variante común en el gen ABCB11 en estado heterocigoto . Esta variante se ha asociado con una expresión reducida de la proteína (25) y con la cirrosis biliar primaria (26, 27). Sin embargo, ambas variantes genéticas son demasiado frecuentes en la población general para ser causales de enfermedades hepáticas colestásicas (28). La secuenciación sistemática del transcriptoma en estos casos puede identificar variantes en otras regiones de las secuencias genéticas o en otros genes que codifican para otros transportadores hepáticos o proteínas implicadas en la generación de bilis, como ABCC2, ABCC3, ABCC4 y la proteína de unión estrecha 2 (TJP2), respectivamente (21).
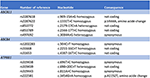
Figura 4. Análisis genético molecular de los genes ABCB11, ABCB4 y ATP8B1.
En conclusión, describimos un caso de lesión hepática colestásica grave inducida por el HDS compatible con la ingesta de té de Artemisia annua. Deberían realizarse esfuerzos para desaconsejar el uso de derivados de la artemisina para la prevención de la malaria, que es ineficaz según las recomendaciones de la OMS y puede causar daños adicionales. Además, el caso demuestra nuestro todavía inadecuado conocimiento de la fisiopatología y la susceptibilidad a la lesión hepática inducida por la HDS.
Declaración de disponibilidad de datos
Todos los conjuntos de datos de este estudio están incluidos en el manuscrito/archivos suplementarios.
Declaración de ética
No se requirió la revisión y aprobación ética para el informe de un solo caso clínico aquí de acuerdo con la legislación local y los requisitos institucionales. El paciente/participante dio su consentimiento informado por escrito para participar.
Contribuciones de los autores
FR-R escribió el primer borrador del manuscrito. SH, CB, AL-T, MZ, y AJ escribió secciones del manuscrito. FR-R, SH, SR, MZ, KR, JB, AJ, MH, AL-T, LT y CB contribuyeron al manejo clínico del paciente, a la revisión del manuscrito, leyeron y aprobaron la versión presentada.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
1. Klayman DL. Qinghaosu (artemisinina): un fármaco antipalúdico de China. Science. (1985) 228:1049-55. doi: 10.1126/science.3887571
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Organización Mundial de la Salud. Directrices de la OMS para el tratamiento del paludismo, 2ª ed. (2010). Disponible en línea en: http://www.who.int/malaria/publications/atoz/9789241547925/en/index.html (consultado el 23 de noviembre de 2018).
Google Scholar
3. SafeTravel.ch. Reismedizinische Beratung. Malariavorbeugung (Chemoprophylaxe) (2016). Disponible en línea en: http://www.safetravel.ch/safetravel2/servlet/ch.ofac.wv.wv204j.pages.Wv204ConseilsSanteListeCtrl?action=afficheDetail&elementCourant=1 (consultado el 23 de noviembre de 2018).
Google Scholar
4. Centros para el Control y la Prevención de Enfermedades. Cómo elegir un medicamento para prevenir la malaria (2018). Disponible en línea en: https://www.cdc.gov/malaria/travelers/drugs.html
Google Scholar
5. Shahinas D, Lau R, Khairnar K, Hancock D, Pillai DR. Uso indebido de artesunato y malaria por Plasmodium falciparum en viajeros que regresan de África. Emerg Infect Dis. (2010) 16:1608-10. doi: 10.3201/eid1610.100427
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Organización Mundial de la Salud. OMS, declaración de posición. Effectiveness of Non-Pharmaceutical Forms of Artemisia annua L. Against Malaria. Ginebra: Organización Mundial de la Salud (2012).
Google Scholar
7. Navarro VJ, Khan I, Björnsson E, Seeff LB, Serrano J, Hoofnagle JH. Lesión hepática por suplementos herbales y dietéticos. Hepatology. (2017) 65:363-73. doi: 10.1002/hep.28813
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Guevart E, Aguemon A. Dos casos de hepatitis fulminante durante un tratamiento curativo con una combinación de artesunato-amodiaquina. Med Mal Infect. (2009) 39:57-60. doi: 10.1016/j.medmal.2008.09.024
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Centros para el Control y la Prevención de Enfermedades (CDC). Hepatitis temporalmente asociada a un suplemento de hierbas que contiene artemisinina – Washington, 2008. Morb Mortal Wkly Rep. (2009) 58:854-6.
Google Scholar
10. Kumar S. Cholestatic liver injury secondary to artemisinin. Hepatology. (2015) 62:973-4. doi: 10.1002/hep.27900
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Stebbings S, Beattie E, McNamara D, Hunt S. A pilot randomized, placebo-controlled clinical trial to investigate the efficacy and safety of an extract of Artemisia annua administered over 12 weeks, for managing pain, stiffness, and functional limitation associated with osteoarthritis of the hip and knee. Clin Rheumatol. (2016) 35:1829-36. doi: 10.1007/s10067-015-3110-z
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Medsafe. Arthrem – Potential Risk of Harm to the Liver -Statement Under Section 98 of the Medicines Act 1981 (2018). Disponible en línea en: http://www.medsafe.govt.nz/safety/EWS/2018/Arthrem.asp
Google Scholar
13. Institutos Nacionales de Salud, LiverTox, Información clínica y de investigación sobre lesiones hepáticas inducidas por fármacos. Derivados de la artemisinina. (2019). Disponible en línea en: https://livertox.nih.gov/ArtemisininDerivatives.htm
Google Scholar
14. Savage RL, Tatley MV, Barnes J. Hepatotoxicidad con un suplemento dietético natural, extracto de Artemisia annua L. en aceite de semilla de uva. Informes del Centro de Farmacovigilancia de Nueva Zelanda. Drug Safety (2018). En: 18ª Reunión Anual de la ISoP «Farmacovigilancia sin fronteras». Ginebra (consultado del 11 al 14 de noviembre de 2018).
Google Scholar
15. Wang JB, Zhu Y, Bai ZF, Wang FS, Li XH, Xiao XH, et al. Directrices para el diagnóstico y el manejo de la lesión hepática inducida por hierbas. Chin J Integr Med. (2018) 24:696-706. doi: 10.1007/s11655-018-3000-8
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Clarke TC, Black LI, Stussman BJ, Barnes PM, Nahin RL. Tendencias en el uso de enfoques de salud complementarios entre los adultos: Estados Unidos, 2002-2012. Natl Health Stat Rep. (2015) 79:1-16.
Google Scholar
17. Danan G, Teschke R. RUCAM en la lesión hepática inducida por drogas y hierbas: la actualización. Int J Mol Sci. (2015) 17:E14. doi: 10.3390/ijms17010014
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Zhang X, Zhao Y, Guo L, Qiu Z, Huang L, Qu X. Differences in chemical constituents of Artemisia annua L from different geographical regions in China. PLoS ONE. (2017) 12:e0183047. doi: 10.1371/journal.pone.0183047
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Ogwang Engeu P, Omujal F, Agwaya M, Kyakulaga H, Obua C. Variaciones en los componentes antimaláricos de Artemisia annua Linn de tres regiones de Uganda. Afr Health Sci. (2015) 15:828-34. doi: 10.4314/ahs.v15i3.17
CrossRef Full Text | Google Scholar
20. Liu H, Zhan S, Zhang Y, Ma Y, Chen L, Chen L, et al. Molecular network-based analysis of the mechanism of liver injury induced by volatile oils from Artemisiae argyi folium. BMC Complement Altern Med. (2017) 17:491. doi: 10.1186/s12906-017-1997-4
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Morgan RE, Trauner M, van Staden CJ, Lee PH, Ramachandran B, Eschenberg M, et al. La interferencia con la función de la bomba de exportación de sales biliares es un factor de susceptibilidad para la lesión hepática humana en el desarrollo de fármacos. Toxicol Sci. (2010) 118:485-500. doi: 10.1093/toxsci/kfq269
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Kubitz R, Dröge C, Stindt J, Weissenberger K, Häussinger D. The bile sal export pump (BSEP) in health and disease. Clin Res Hepatol Gastroenterol. (2012) 36:536-53. doi: 10.1016/j.clinre.2012.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Alissa FT, Jaffe R, Shneider BL. Actualización de la colestasis intrahepática familiar progresiva. J Pediatr Gastroenterol Nutr. (2008) 46:241-52.21. doi: 10.1097/MPG.0b013e3181596060
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Dixon PH, Williamson C. The molecular genetics of intrahepatic cholestasis of pregnancy. Obstet Med. (2008) 1:65-71. doi: 10.1258/om.2008.080010
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Stieger B. The role of the sodium-taurocholate cotransporting polypeptide (NTCP) and of the bile salt export pump (BSEP) in physiology and pathophysiology of bile formation. Handb Exp Pharmacol. (2011) 201:205-59. doi: 10.1007/978-3-642-14541-4_5
CrossRef Full Text | Google Scholar
26. Pauli-Magnus C, Kerb R, Fattinger K, Lang T, Anwald B, Kullak-Ublick GA, et al. Estructura del haplotipo BSEP y MDR3 en caucásicos sanos, cirrosis biliar primaria y colangitis esclerosante primaria. Hepatology. (2004) 39:779-91. doi: 10.1002/hep.20159
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pan S, Li X, Jiang P, Jiang Y, Shuai L, He Y, et al. Las variaciones de los genes ABCB4 y ABCB11 están asociadas a los cálculos intrahepáticos primarios. Mol Med Rep. (2015) 11:434-46. doi: 10.3892/mmr.2014.2645
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dröge C, Bonus M, Baumann U, Klindt C, Lainka E, Kathemann S, et al. La secuenciación de FIC1, BSEP y MDR3 en una gran cohorte de pacientes con colestasis reveló un alto número de variantes genéticas diferentes. J Hepatol. (2017) 67:1253-64. doi: 10.1016/j.jhep.2017.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar