1. Permeabilidad
2. Fluidez
3. Heterogeneidad
– Interior
– Exterior
– Doblado, espesor
Las funciones de las membranas celulares están determinadas por su composición molecular. El tipo y la proporción de estas moléculas fijarán las características fisicoquímicas de la membrana: semipermeabilidad, asimetría, fluidez, reparación y reciclaje.
Permeabilidad
La semipermeabilidad de la membrana es una consecuencia del entorno hidrofóbico interno de las membranas, creado por las cadenas de ácidos grasos de los lípidos, que es difícil de atravesar por moléculas con cargas eléctricas. Así, al impedir la difusión libre de las moléculas, las membranas pueden formar compartimentos que mantienen entornos internos y externos distintos. Sin embargo, la permeabilidad es selectiva. La polaridad y el tamaño son las características moleculares más importantes que influyen en la capacidad de atravesar las membranas. Las moléculas pequeñas sin cargas eléctricas, como el CO2, el N2 y el O2, y las moléculas con alta solubilidad en la grasa, como el etanol, pueden atravesar las membranas casi libremente por difusión pasiva (Figura 1). La permeabilidad es menor para las moléculas que tienen cargas eléctricas cuando el número de cargas positivas es igual a las negativas, conocidas como moléculas no cargadas, como el agua y el glicerol. Podría pensarse que el agua puede atravesar las membranas libremente, pero hay algunas restricciones, y por eso algunas membranas contienen acuaporinas, un tipo de proteína transmembrana con un canal que permite que el agua cruce libremente. La capacidad de las grandes moléculas sin carga, como la glucosa, para atravesar las membranas es baja. Las membranas son muy impermeables a los iones y a las moléculas cargadas. Algunos valores del coeficiente de permeabilidad por difusión pasiva son O2: 2,3 cm/s, CO2 0,35 cm/s, H2O: 0,0034 cm/s, glicerol: 10 -6 cm/s, sodio y potasio: 10 -14 cm/s.
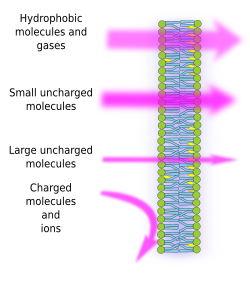
La distribución desigual de iones y moléculas entre ambos lados de una membrana permite generar y mantener gradientes electroquímicos. La diferencia entre la concentración interior y exterior de cargas eléctricas se conoce como potencial de membrana. Este gradiente se utiliza para muchas funciones celulares, como la síntesis de ATP y la transmisión de información a lo largo de los nervios. La semipermeabilidad también es responsable de los procesos osmóticos, que son movimientos de agua a través de las membranas desde una solución menos concentrada en un lado hasta una solución más concentrada en el otro, con el fin de igualar ambas concentraciones. De este modo, las células vegetales son capaces de aumentar de tamaño gracias a una mayor concentración intracelular de algunos solutos que provocan la entrada de agua en la célula, lo que a su vez produce una presión hidrostática interna (llamada presión de turgencia) que empuja las paredes celulares hacia fuera. Las moléculas que no atraviesan las membranas libremente son útiles para las células porque pueden crear gradientes que pueden funcionar como mecanismos de información o como almacenes de energía. Las células tienen proteínas transmembrana que permiten atravesar la membrana o mover moléculas cargadas e iones entre ambos lados de las membranas celulares, evitando el entorno hidrofóbico de la membrana interna. Por ejemplo, la contracción muscular se desencadena por la apertura de canales que reducen un gradiente iónico existente.
La semipermeabilidad está influida por la composición lipídica de las membranas. Por ejemplo, el contenido de colesterol es importante en la membrana plasmática. Un aumento en el contenido de colesterol disminuye la fluidez y aumenta la hidrofobicidad, ambas características hacen que la membrana sea más impermeable. Así, el aumento del colesterol por encima del 30 % (que es un valor elevado) hace que las membranas de mielina sean muy adecuadas para aislar los axones y optimizar la propagación del potencial de acción a lo largo del axón.
Fluidez y dominios laterales
La fluidez es una propiedad de las membranas. Está relacionada con la capacidad de las moléculas para moverse dentro de las membranas. Una mayor fluidez significa que los movimientos son más frecuentes. Las membranas celulares son en realidad una lámina de grasa, donde las moléculas se encuentran en un estado viscoso semilíquido. Por lo tanto, se puede adivinar que las moléculas pueden moverse por difusión. Por ejemplo, un glicerofosfolípido situado en la monocapa externa de la membrana plasmática puede tener dos tipos de movimientos: lateral, es decir, en la misma monocapa, y flip-flop, es decir, saltando de una monocapa a otra (Figura 2). En las membranas artificiales se han observado estos dos tipos de movimientos, siendo los laterales mucho más frecuentes que los flip-flop. Por difusión lateral, los lípidos pueden recorrer 30 µm en 20 segundos; pueden recorrer toda la circunferencia de una célula de tamaño medio en un minuto. Sin embargo, los movimientos flip-flop son realmente infrecuentes porque la cabeza hidrofílica de la molécula lipídica debe atravesar la capa interna de cadenas de ácidos grasos, y esto es termodinámicamente difícil. Para una molécula lipídica, la probabilidad de que se produzca un desplazamiento de flip-flop es de aproximadamente una vez al mes. Sin embargo, el colesterol se comporta de manera diferente y puede hacer flip-flop con bastante facilidad.

La fluidez de la membrana puede cambiar dependiendo de la composición química. En general, las cadenas de ácidos grasos más cortas y la mayor cantidad de enlaces insaturados entre los carbonos de los ácidos grasos aumentan la fluidez de la membrana. La cantidad de colesterol también influye en la fluidez de la membrana, pero el efecto neto depende de la temperatura y del tipo de lípidos de la membrana. El colesterol tiene dos efectos: inhibe la transición al estado de gel sólido (menos fluidez), pero también disminuye la flexibilidad de las cadenas de ácidos grasos insaturados. En general, se puede decir que un aumento de la concentración de colesterol disminuye la fluidez de la membrana, aunque a bajas temperaturas el efecto es el contrario. Las membranas internas de la célula, como las del retículo endoplásmico, contienen muy poco colesterol y, por tanto, son más fluidas. Además, el colesterol proporciona a las membranas otra propiedad conocida como hidrofobicidad, que hace que las membranas sean más impermeables.
La diferente composición molecular entre las dos monocapas de una membrana, conocida como asimetría de la membrana, puede generar una fluidez distinta en cada monocapa. Dependiendo de la composición molecular, los lípidos pueden estar en dos fases físicas: líquido-ordenado (menos fluidez) y líquido-desordenado (más fluidez). Se supone que la monocapa exterior de la membrana plasmática se encuentra con más frecuencia en la fase de ordenación líquida, mientras que la monocapa interior es propensa a estar en fase de desordenación líquida.
Las células pueden modificar la fluidez de las membranas cambiando su composición química. Por ejemplo, las bacterias ajustan la saturación y la longitud de las cadenas de ácidos grasos para que la fluidez de la membrana pueda adaptarse a las condiciones ambientales. La variación de la concentración de glicerofosfolípidos, como la fosfatidiletanolamina, también puede modular la fluidez. Algunos insectos no pueden sintetizar esteroles, como el colesterol, y los esteroles de sus membranas provienen de los alimentos. Modifican la fluidez de sus membranas celulares mediante diferentes concentraciones de fosfatidiletanolamina.
La membrana interna de la mitocondria necesita ser una barrera impermeable fuerte para crear y mantener un gradiente de protones. Podría hacerse mediante un aumento del contenido de colesterol. De esta manera la hidrofobicidad es mayor, pero a su vez el colesterol disminuye la fluidez, que parece ser muy importante para la función de las proteínas en esta membrana. Las mitocondrias resuelven el problema con cardiolipina, un fosfolípido insaturado que aumenta la hidrofobicidad, pero no reduce mucho la fluidez de la membrana.
3. Heterogeneidad
Debido a la fluidez, puede pensarse que las proteínas se distribuyen al azar y, por tanto, las membranas son homogéneas en cuanto a la composición molecular, es decir, muestran el mismo contenido y proporción molecular independientemente de la región de la membrana. Esto no es cierto. Existen restricciones a la difusión lateral de las moléculas que causan la heterogeneidad de la membrana, lo que significa que hay regiones de una membrana con diferente composición molecular. En las células no polarizadas, y a escalas superiores a 200 nm, la membrana plasmática parece homogénea, pero a escalas inferiores a 200 nm es heterogénea. Se cree que los microdominios de las membranas tienen un tamaño de unos 60 µm. Los lípidos y las proteínas muestran movimientos laterales restringidos en su mayoría a zonas de 60-200 nm durante unos pocos milisegundos, y luego saltan a otra zona adyacente donde permanecen allí durante otro corto tiempo. Este comportamiento se denomina difusión salatoria.
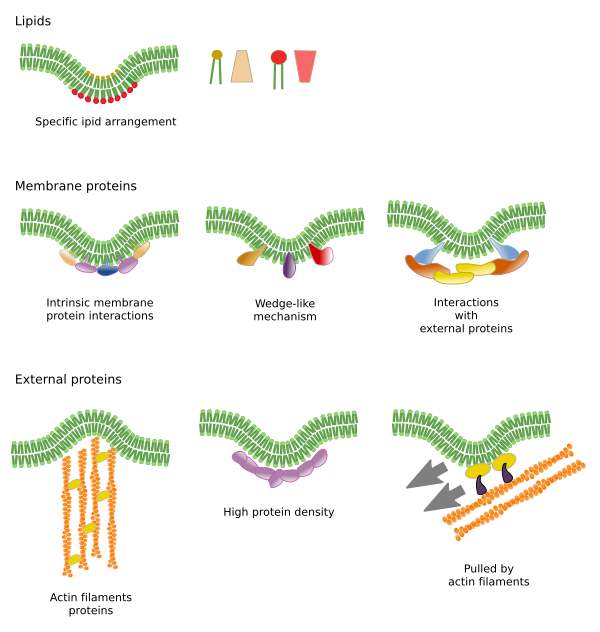
Las restricciones a los movimientos laterales de las moléculas pueden estar causadas por varios mecanismos: interacciones con el citoesqueleto o la matriz extracelular, interacciones de las moléculas de la membrana entre sí, diferentes densidades de las áreas locales de la membrana (cambios en la fluidez), cantidad de cargas eléctricas, curvatura de la membrana y diferente grosor de los dominios de la membrana (Figura 3).
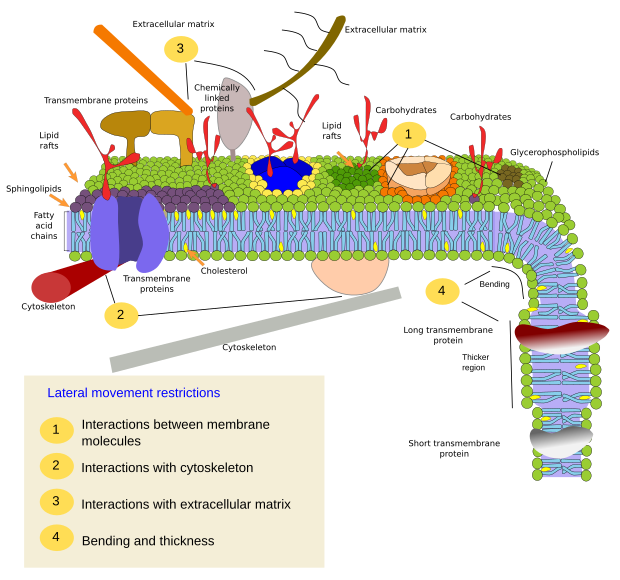
Interacciones internas
Las interacciones de las moléculas de la membrana entre sí restringen el movimiento lateral. Tanto los movimientos de las proteínas como los de los lípidos se ven influidos por estas interacciones, lo que conduce a la formación de microdominios con una composición molecular diferencial (Figura 4). El resultado es una distribución lateral heterogénea de las moléculas en las membranas. Dependiendo de las proporciones moleculares, los microdominios lipídicos pueden tener diferente densidad (es decir, fluidez): sólida, líquida ordenada y líquida desordenada. La densidad más común es la de líquido desordenado, que es la más fluida.
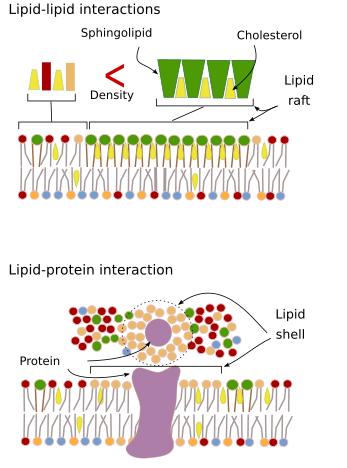
Los esfingolípidos y el colesterol pueden asociarse espontáneamente entre sí, reduciendo su movilidad y aumentando la densidad molecular en comparación con las áreas vecinas. Se forma un pequeño grupo distinto de moléculas como una balsa en un mar de lípidos. En realidad, estas asociaciones moleculares se conocen como balsas lipídicas, y se cree que son muy abundantes y en las membranas celulares. Las balsas lipídicas muestran un comportamiento muy dinámico, pueden moverse, crecer, disminuir, aparecer y desaparecer. De hecho, las membranas están formadas por muchos dominios densos que viajan lateralmente entre los glicerofosfolípidos, por lo que las membranas son bastante heterogéneas en cuanto a su distribución molecular. Algunos experimentos sugieren que ciertos tipos de proteínas se «sienten» más cómodos dentro de las balsas lipídicas. Estas proteínas pasan más tiempo dentro que fuera de las balsas lipídicas, por lo que se desplazan durante algún tiempo dentro de estas densidades. Esto provoca una segregación de las moléculas a lo largo de la membrana, y aumenta la probabilidad de que diferentes moléculas estén cerca unas de otras más tiempo que por simple azar (difusión), aumentando así la probabilidad de ciertas reacciones moleculares. Además, se sugiere que una alta concentración de ciertos tipos de lípidos en las balsas lipídicas crea un entorno químico distinto que facilita algunas reacciones químicas o interacciones moleculares. Se ha propuesto que las balsas lipídicas están presentes en la monocapa externa de la membrana plasmática porque es en este lado donde abundan los esfingolípidos. Se ha sugerido que los dominios de membrana existen también en las membranas de los orgánulos, y se piensa que algunas de sus funciones dependen de estos dominios de membrana.
En la monocapa interna de la membrana plasmática, los microdominios se forman por interacciones electrostáticas entre dominios citosólicos básicos o dominios de cationes divalentes de las proteínas y las cabezas polares negativas de los lípidos. Otro ejemplo menos conocido es la asociación entre el fosfatidilinositol bifosfato y el colesterol que forma microdominios en esta monocapa. Estos microdominios orientados hacia el citosol pueden influir en los andamios proteicos intracelulares.
Tradicionalmente, se ha pensado que no hay interacciones entre ambas monocapas de membranas y que distribuyen sus microdominios de forma independiente. Sin embargo, las evidencias sugieren que existen interacciones entre ellas. Las proteínas transmembrana afectan simultáneamente a ambas monocapas ya que atraviesan toda la membrana. Otra forma de sincronización entre ambas monocapas puede estar mediada por las largas cadenas de ácidos grasos, como algunos esfingolípidos que pueden tener 24 carbonos de longitud (la longitud normal es de 18). Estas cadenas largas pueden insertarse entre las cadenas de ácidos grasos de los lípidos de la otra monocapa e influir en la distribución lipídica. Además, se cree que los dominios lipídicos con cadenas de ácidos grasos largas son contrarrestados por microdominios lipídicos de cadenas de ácidos grasos cortas en la otra monocapa, manteniendo constante el grosor de la membrana.
Las proteínas de membrana, tanto integrales como asociadas, también pueden interactuar entre sí y ensamblarse en andamios macromoleculares para facilitar la transmisión de información, el reconocimiento célula-célula, poner en marcha algunas actividades enzimáticas y el movimiento celular. También hay proteínas multiméricas que sólo son activas cuando todas las subunidades se mantienen juntas. Por ejemplo, el receptor de la insulina está formado por cuatro subunidades. Las proteínas y los lípidos también pueden interactuar para formar dominios de membrana. Por ejemplo, en la monocapa interna, el fosfatidilinositol se asocia alrededor de las proteínas mediante interacciones eléctricas, que pueden regularse modificando los fosfatos de la cabeza polar de los lípidos.
Interacciones con elementos externos
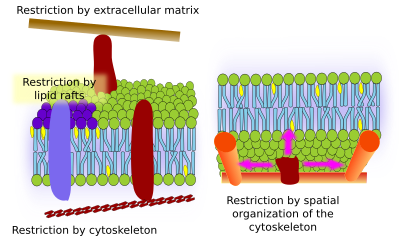
Las proteínas integrales de la membrana también pueden tener movimientos laterales, pero están más restringidos que los lípidos, principalmente debido a las interacciones con la matriz extracelular y el citoesqueleto a través de sus dominios extracelulares e intracelulares, respectivamente (Figura 5). Estas interacciones pueden mantener a las proteínas en pequeñas zonas de la membrana durante más tiempo que por simple difusión. El citoesqueleto puede formar cercos justo debajo de la membrana plasmática que mantienen a las proteínas restringidas en pequeñas áreas. Los filamentos de actina y los microtúbulos pueden encerrar pequeñas zonas que limitan la difusión de proteínas y lípidos. Las interacciones con el citoesqueleto son importantes porque si el citoesqueleto se desorganiza experimentalmente la membrana se vuelve mucho más homogénea. Las células tienen otros mecanismos para confinar las proteínas en dominios específicos. Por ejemplo, las células epiteliales del intestino tienen algunos transportadores y enzimas localizados en la membrana plasmática apical, pero no en el dominio basolateral debido a un cinturón de uniones estrechas, una cremallera molecular que impide la difusión entre los dominios apical y basolateral. Esta distribución asimétrica es esencial para la fisiología de la célula epitelial.
La curvatura de la membrana es otra forma de crear microdominios. Una curvatura de la membrana puede ser el punto de partida para formar una vesícula, una extensión del citoplasma para la expansión celular, un cambio de forma o crecimiento de un orgánulo, o simplemente para iniciar una barrera para restringir el movimiento lateral de las moléculas. Se trata de una restricción física por la disposición tridimensional de los lípidos en el ángulo menor del pliegue de la membrana.
Las herramientas moleculares necesarias para doblar una membrana se reclutan en regiones específicas de la membrana. Estos microdominios pueden tener una composición lipídica específica o un entorno de carga eléctrica particular. Los fosfoinosítidos (PIP), sobre todo los PIP2 y PIP3, son lípidos que contribuyen al reclutamiento de proteínas para doblar la membrana. Son moléculas útiles porque la carga eléctrica y la estructura molecular de sus cabezas polares pueden modificarse fácilmente mediante reacciones químicas. De este modo, las propiedades de una determinada región de la membrana pueden cambiar cuando sea necesario y reclutar proteínas específicas. La fosfatidilserina también es capaz de iniciar un microdominio para la flexión de la membrana cuando es translocada de una monocapa a otra por las flipasas.
Doblado y engrosamiento
Los microdominios lipídicos reclutan proteínas que doblan la membrana de forma efectiva. Existen proteínas especializadas en esta función (Figura 6). Las proteínas de dominio BAR (Bin/anfisina/Rsv161) son una de ellas. La flexión puede ser inducida por dos mecanismos: el ensamblaje de un andamiaje curvo de proteínas que tiran o empujan la membrana, y la inserción de secuencias de aminoácidos entre los lípidos a modo de cuña. Por ejemplo, las caveolinas provocan la curvatura de la membrana para formar cavelos, la tetraspaína fuerza las membranas para formar túbulos, la ESCRT ayuda a la formación de vesículas dentro de los endosomas para formar cuerpos multivesiculares. La actina es un fuerte agente de curvatura de la membrana por la polimerización de los filamentos de actina que empuja la membrana plasmática hacia fuera dando lugar a expansiones celulares. Muchas proteínas que pueden curvar la membrana plasmática también activan la polimerización de actina.
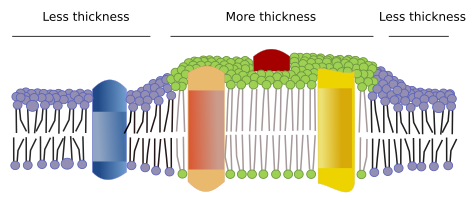
Existen otros dominios en las membranas, dominios físicos, formados por moléculas como las proteínas transmembrana. Estas zonas presentan un grosor de membrana diferente porque contienen proteínas con secuencias de aminoácidos hidrofóbicas más largas que se rodean de lípidos con cadenas de ácidos grasos más largas (Figura 7). Estas proteínas y lípidos se «sienten» más cómodos cuando están juntos ya que encajan bien sus partes hidrofóbicas. Forman dominios de membrana que excluyen a otras moléculas, ya sean proteínas o lípidos, con regiones hidrofóbicas más cortas.
Bibliografía
Honigmann A, Pralle A. (2016). Compartimentación de la membrana celular. Journal of mollecular biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). La curvatura de la membrana en la biología celular: una integración de los mecanismos moleculares. Journal of cell biology. 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). Colesterol alto/colesterol bajo: efectos en las membranas biológicas: una revisión Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.