Oxid lithný Chemické vlastnosti,použití,výroba
Chemické vlastnosti
Oxid lithný (Li2O) je jedním z nejjednodušších iontových oxidů a je izoelektrický k H2O. Dva atomy lithia předají každý jeden elektron atomu kyslíku. tvoří iontovou vazbu mezi lithiem a kyslíkem. Vzorec oxidu lithného je Li2O.
Oxid lithný je velmi korozivní. Reaguje s vodou za vzniku hydroxidu lithného. Je toxický, protože je silně alkalický (je to zásada).
Je to vysoce nerozpustný tepelně stabilní zdroj lithia vhodný pro použití ve skle, optice a keramice. Oxid lithný je bílá pevná látka známá také jako lithium, vzniká při hoření kovového lithia za přítomnosti kyslíku. Sloučeniny oxidu nejsou vodivé pro elektrický proud. Některé oxidy s perovskitovou strukturou jsou však elektronicky vodivé a nacházejí uplatnění v katodě pevných oxidových palivových článků a v systémech výroby kyslíku. Jsou to sloučeniny obsahující alespoň jeden kyslíkový aniont a jeden kovový kationt.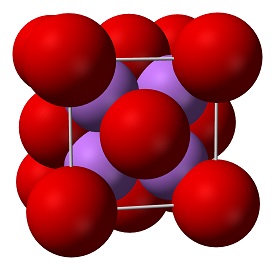
Oxid lithný se používá jako tavidlo v keramických glazurách; a vytváří modré s mědí a růžové s kobaltem. Oxid lithný reaguje s vodou a vodní párou za vzniku hydroxidu lithného a měl by být od nich izolován. Jeho použití se také zkoumá pro nedestruktivní vyhodnocování emisní spektroskopie a sledování degradace v rámci tepelně bariérových nátěrových systémů. Může být přidáván jako ko-dopant s yttriem do vrchního povlaku zirkoniové keramiky, aniž by došlo k velkému snížení očekávané životnosti povlaku.
Použití
V současné době neexistuje žádné průmyslové použití, které by spotřebovávalo velké množství oxidu lithného.
Oxid lithný se používá jako tavidlo v keramických glazurách; a vytváří modré barvy s mědí a růžové s kobaltem. Oxid lithný reaguje s vodou a vodní párou za vzniku hydroxidu lithného a měl by od nich být izolován. jeho použití se také zkoumá pro nedestruktivní vyhodnocování emisní spektroskopie a sledování degradace v rámci tepelně bariérových nátěrových systémů. Lze jej přidávat jako ko-dopant s yttriem do vrchního povlaku zirkoniové keramiky, aniž by došlo k velkému snížení očekávané životnosti povlaku.
Reakce
Oxid lithný při rozpouštění reaguje s vodou za vzniku roztoku hydroxidu lithného.
Oxid lithný je silná zásada a reaguje obvykle s kyselými plyny a kapalinami za vzniku lithných solí. Za zvýšených teplot reaguje oxid lithný také s mnoha pevnými nekovovými oxidy (SiO2, B2O3 atd.) a oxidy kovů (A12O3, Fe2O3 atd.). Reakce při vysokých teplotách jsou základem tavicího účinku oxidu lithného, hydroxidu lithného a uhličitanu lithného. Je třeba dbát na to, aby nedošlo k reakci oxidu lithného s reakčními nádobami při vysokých teplotách.
Příprava
Oxid lithný se připravuje zahříváním kovového lithia v suchém kyslíku při teplotě nad 100 °C:
4Li + O2→2Li2O
Další způsob přípravy, při kterém vzniká čistý oxid lithný, zahrnuje tepelný rozklad peroxidu lithného:
2Li2O2→2Li2O + O2
Také lze oxid vyrobit zahříváním čistého hydroxidu lithného při 800°C ve vakuu:
2LiOH→Li2O + H2O
Zdravotní nebezpečnost
Podle našich znalostí nebyly chemické, fyzikální a toxikologické vlastnosti oxidu lithného důkladně prozkoumány a popsány.
Toxicita sloučenin lithia je funkcí jejich rozpustnosti ve vodě. Ionty lithia mají toxicitu pro centrální nervový systém. Počáteční účinky expozice lithiu jsou třes rukou, nevolnost, mikce, nezřetelná řeč, ospalost, ospalost, závrať, žízeň a zvýšený objem moči. Účinky při pokračující expozici jsou apatie, anorexie, únava, letargie, svalová slabost a změny ekg. Dlouhodobá expozice vede k hypotyreóze, leukocytóze, edémům, zvýšení hmotnosti, polydipsii/polyurii (zvýšený příjem vody vedoucí ke zvýšenému vylučování moči), poruchám paměti, záchvatům, poškození ledvin, šoku, hypotenzi, srdečním arytmiím, kómatu, smrti.
Chemické vlastnosti
jemně rozdělený bílý prášek (prášky) nebo krustovitý materiál; snadno absorbuje CO2 a H2O z atmosféry; vyrábí se zahříváním LiOH na ~800 °C ve vakuu nebo tepelným rozkladem peroxidu lithného; používá se v keramice a speciálních skleněných přípravcích a v lithiových termálních bateriích
Použití
Oxid lithný je silná zásada, která absorbuje oxid uhličitý a vodu z atmosféry. Používá se při výrobě keramiky a speciálních druhů skla.
Použití
Keramika a speciální skleněné přípravky, absorbent oxidu uhličitého
Příprava
Průmyslové a laboratorní přípravky. Průmyslově se připravují pouze malé objemy materiálu. Průmyslové i laboratorní přípravky vyžadují tepelný rozklad peroxidu lithného nebo hydroxidu lithného.
Peroxid lithný, Li202 , se zahříváním na 450° v proudu plynného helia přeměňuje na oxid lithný, Li20, a kyslík.
Termická dehydratace hydroxidu lithného se provádí při 675 °C ± 10° ve vakuu v niklové nádobě vyložené stříbrnou fólií.
Uhličitan lithný lze převést na oxid lithný a oxid uhličitý zahřátím materiálu na 700 °C ve vakuu v platinové lodi.
Průmyslové použití. V současné době neexistuje žádné průmyslové využití, při kterém by se spotřebovalo velké množství oxidu lithného.
Oxid lithný reaguje s vodou, když se rozpouští, za vzniku roztoku hydroxidu lithného.Oxid lithný je silná zásada a reaguje obvykle s kyselými plyny a kapalinami za vzniku solí lithia. Při zvýšených teplotách reaguje oxid lithný také s mnoha pevnými nemetaloxidy (Si02, B2O3 atd.) a oxidy kovů (A1203 , Fe2C>3 atd.). Vysokoteplotníreakce jsou základem tavného působení oxidu lithného, hydroxidu lithného a uhličitanu lithného. Je třeba dbát na to, aby nedošlo k reakci oxidu lithného s reakčními nádobami při vysokých teplotách.