1. Propustnost
2. Tekutost
3. Heterogenita
– Vnitřní
– Vnější
– Ohyb, tloušťka
Funkce buněčných membrán jsou určeny jejich molekulárním složením. Typ a podíl těchto molekul určuje fyzikálně-chemické vlastnosti membrán: semipermeabilitu, asymetrii, tekutost, opravu a recyklaci.
Propustnost
Semipermeabilita membrán je důsledkem vnitřního hydrofobního prostředí membrán, které vytvářejí řetězce mastných kyselin lipidů a které je obtížně překonatelné molekulami s elektrickým nábojem. Tím, že brání volné difuzi molekul, mohou membrány vytvářet kompartmenty, které udržují odlišné vnitřní a vnější prostředí. Propustnost je však selektivní. Polarita a velikost jsou důležitější vlastnosti molekul, které ovlivňují schopnost procházet membránami. Malé molekuly bez elektrického náboje, jako jsou CO2, N2, O2, a molekuly s vysokou rozpustností v tucích, jako je ethanol, mohou téměř volně procházet membránami pasivní difuzí (obr. 1). Propustnost je nižší u molekul, které mají elektrické náboje, kdy se počet kladných nábojů rovná záporným, tzv. nenabité molekuly, jako je voda a glycerol. Mohlo by se zdát, že voda může volně procházet membránami, ale existují určitá omezení, a proto některé membrány obsahují akvaporiny, typ transmembránového proteinu s kanálem, který umožňuje vodě volně procházet. Schopnost velkých nenabitých molekul, jako je glukóza, procházet membránami je nízká. Membrány jsou vysoce nepropustné pro ionty a nabité molekuly. Některé hodnoty koeficientu propustnosti pasivní difuzí jsou: O2: 2,3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, glycerol: 10 -6 cm/s, sodík a draslík:
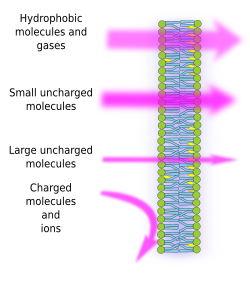
Nerovnoměrné rozložení iontů a molekul mezi oběma stranami membrány umožňuje vytvářet a udržovat elektrochemické gradienty. Rozdíl mezi vnitřní a vnější koncentrací elektrických nábojů se nazývá membránový potenciál. Tento gradient se využívá pro mnoho buněčných funkcí, jako je syntéza ATP a přenos informací po nervech. Semipermeabilita je také zodpovědná za osmotické procesy, což jsou pohyby vody přes membrány z méně koncentrovaného roztoku na jedné straně do koncentrovanějšího roztoku na straně druhé, aby se obě koncentrace vyrovnaly. Rostlinné buňky se tak mohou zvětšovat díky vyšší vnitrobuněčné koncentraci některých rozpuštěných látek, které způsobují vstup vody do buňky, což následně vyvolává vnitřní hydrostatický tlak (tzv. turgorový tlak), který vytlačuje buněčné stěny směrem ven. Molekuly, které neprocházejí volně přes membrány, jsou pro buňky užitečné, protože mohou vytvářet gradienty, které mohou fungovat jako informační mechanismy nebo jako zásobárny energie. Buňky mají transmembránové proteiny, které umožňují překračovat membránu nebo přesouvat nabité molekuly a ionty mezi oběma stranami buněčných membrán, a vyhnout se tak hydrofobnímu prostředí vnitřní membrány. Například svalová kontrakce je vyvolána otevřením kanálů, které snižují existující iontový gradient.
Semipermeabilita je ovlivněna lipidovým složením membrán. V plazmatické membráně je například důležitý obsah cholesterolu. Zvýšení obsahu cholesterolu snižuje fluiditu a zvyšuje hydrofobicitu, přičemž obě vlastnosti činí membránu nepropustnější. Zvýšení obsahu cholesterolu nad 30 % (což je vysoká hodnota) tak činí myelinové membrány velmi vhodnými pro izolaci axonů a optimalizaci šíření akčního potenciálu podél axonu.
Fluidita a laterální domény
Fluidita je vlastnost membrán. Souvisí se schopností molekul pohybovat se uvnitř membrán. Vyšší fluidita znamená, že pohyby jsou častější. Buněčné membrány jsou vlastně vrstvou tuku, kde jsou molekuly v polotekutém viskózním stavu. Lze tedy odhadnout, že se molekuly mohou pohybovat difuzí. Například glycerofosfolipid nacházející se ve vnější monovrstvě plazmatické membrány může mít dva typy pohybu: laterální, tj. ve stejné monovrstvě, a flip-flop, tj. přeskakování z jedné monovrstvy do druhé (obrázek 2). U umělých membrán byly pozorovány tyto dva typy pohybů, přičemž laterální pohyby jsou mnohem častější než flip-flop. Laterální difuzí mohou lipidy urazit 30 µm za 20 sekund; celý obvod středně velké buňky mohou překonat za minutu. Překlápěcí pohyby jsou však opravdu vzácné, protože hydrofilní hlava lipidové molekuly musí překonat vnitřní vrstvu řetězců mastných kyselin, a to je termodynamicky obtížné. U jedné lipidové molekuly je pravděpodobnost flip-flop posunu přibližně jednou za měsíc. Cholesterol se však chová jinak a může provést flip-flop poměrně snadno.

Fluidita membrány se může měnit v závislosti na chemickém složení. Obecně platí, že kratší řetězce mastných kyselin a vyšší množství nenasycených vazeb mezi uhlíky mastných kyselin zvyšují fluiditu membrán. Množství cholesterolu také ovlivňuje fluiditu membrány, ale čistý účinek závisí na teplotě a typu lipidů v membráně. Cholesterol má dva účinky: brání přechodu do pevného gelového stavu (menší tekutost), ale také snižuje pružnost nenasycených řetězců mastných kyselin. Obecně lze říci, že zvýšení koncentrace cholesterolu snižuje fluiditu membrán, i když při nízkých teplotách je účinek opačný. Vnitřní membrány buňky, jako například membrány endoplazmatického retikula, obsahují velmi málo cholesterolu, a proto jsou tekutější. Kromě toho cholesterol poskytuje membránám další vlastnost známou jako hidrofobicita, která činí membrány nepropustnějšími.
Různé molekulární složení mezi dvěma monovrstvami membrány, známé jako asymetrie membrán, může vytvářet odlišnou tekutost v každé monovrstvě. V závislosti na molekulárním složení mohou být lipidy ve dvou fyzikálních fázích: uspořádané v kapalině (menší tekutost) a neuspořádané v kapalině (větší tekutost). Předpokládá se, že vnější monovrstva plazmatické membrány je častěji ve fázi uspořádané kapaliny, zatímco vnitřní monovrstva má sklon být ve fázi neuspořádané kapaliny.
Buňky mohou měnit tekutost membrán změnou jejich chemického složení. Bakterie například upravují nasycení a délku řetězců mastných kyselin tak, aby se tekutost membrán mohla přizpůsobit podmínkám prostředí. Fluiditu může rovněž modulovat změna koncentrace glycerofosfolipidů, například fosfatidyletanolaminu. Některý hmyz nedokáže syntetizovat steroly, jako je cholesterol, a steroly jeho membrán pocházejí z potravy. Fluiditu svých buněčných membrán mění různými koncentracemi fosfatidyletanolaminu.
Vnitřní membrána mitochondrií musí být silnou nepropustnou bariérou, aby se vytvořil a udržel protonový gradient. Toho by mohlo být dosaženo zvýšením obsahu cholesterolu. Tím se zvýší hidrofobicita, ale cholesterol zase sníží fluiditu, což se zdá být velmi důležité pro funkci proteinů v této membráně. Mitochondrie tento problém řeší kardiolipinem, nenasyceným fosfolipidem, který zvyšuje hidrofobicitu, ale nesnižuje příliš fluiditu membrány.
3. Heterogenita
Kvůli fluiditě se lze domnívat, že proteiny jsou náhodně rozmístěny, a proto jsou membrány homogenní, pokud jde o molekulární složení, tj. vykazují stejný molekulární obsah a poměr nezávisle na oblasti membrány. To však není pravda. Existují omezení laterální difúze molekul, která způsobují heterogenitu membrán, což znamená, že existují oblasti membrány s různým molekulárním složením. V nepolarizovaných buňkách a v měřítku větším než 200 nm vypadá plazmatická membrána jako homogenní, ale v měřítku pod 200 nm je heterogenní. Předpokládá se, že mikrodomény membrán mají velikost kolem 60 µm. Lipidy a proteiny vykazují laterální pohyby většinou omezené na oblasti 60-200 nm během několika milisekund a poté přeskakují do jiné sousední oblasti, kde zůstávají po další krátkou dobu. Toto chování se nazývá slaná difúze.
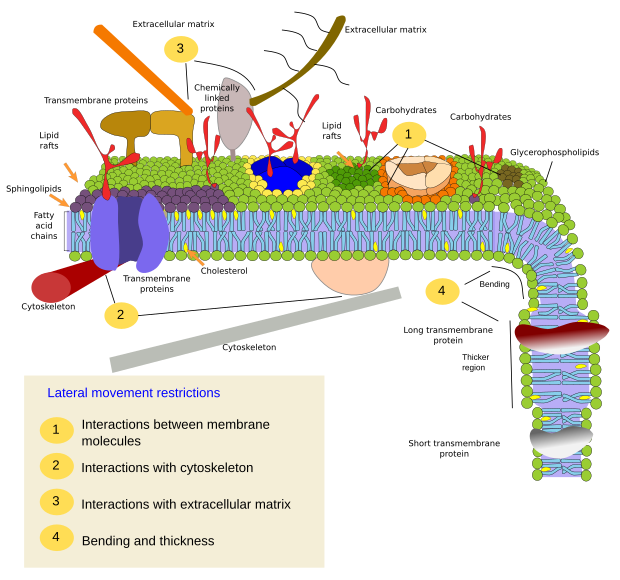
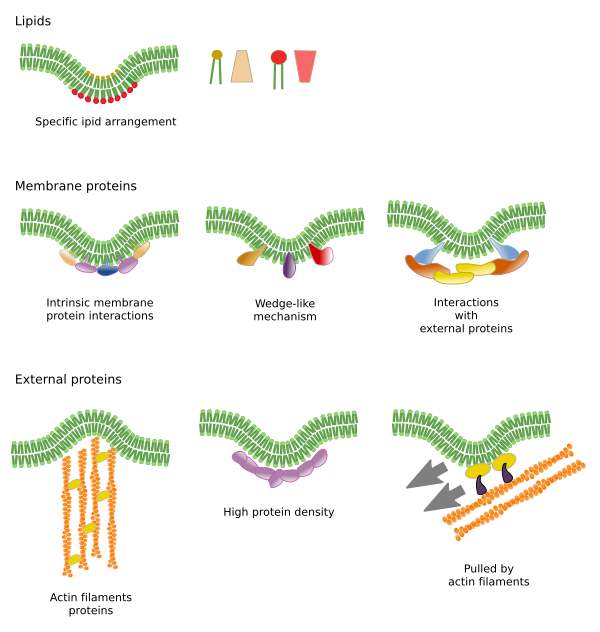
Omezení laterálních pohybů molekul může být způsobeno několika mechanismy: interakcemi s cytoskeletem nebo extracelulární matrix, interakcemi membránových molekul mezi sebou, různou hustotou lokálních membránových oblastí (změny tekutosti), množstvím elektrických nábojů, zakřivením membrány a různou tloušťkou membránových domén (obr. 3).
Vnitřní interakce
Interakce membránových molekul mezi sebou omezují laterální pohyb. Tyto interakce ovlivňují pohyb proteinů i lipidů, což vede k vytváření mikrodomén s rozdílným molekulárním složením (obr. 4). Výsledkem je laterální heterogenní rozložení molekul v membránách. V závislosti na poměru molekul mohou mít lipidové mikrodomény různou hustotu (tj. tekutost): pevnou, uspořádanou a neuspořádanou kapalinu. Nejběžnější hustota je kapalná neuspořádaná, která je nejplynulejší.
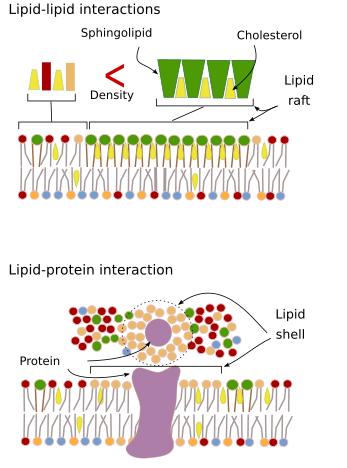
Sfingolipidy a cholesterol se mohou samovolně sdružovat mezi sebou, což snižuje jejich pohyblivost a zvyšuje molekulární hustotu ve srovnání se sousedními oblastmi. Vytvoří se malá odlišná skupina molekul jako vor v moři lipidů. Ve skutečnosti jsou tato molekulární sdružení známá jako lipidové rafty a předpokládá se, že jsou velmi hojná a v buněčných membránách. Lipidové rafty vykazují velmi dynamické chování, mohou se pohybovat, růst, zmenšovat se, objevovat se a mizet. Membrány se totiž skládají z mnoha hustých domén pohybujících se laterálně mezi glycerofosfolipidy, takže membrány jsou poměrně heterogenní, pokud jde o jejich molekulární rozložení. Některé experimenty naznačují, že určité typy proteinů se „cítí“ lépe uvnitř lipidových raftů. Tyto proteiny tráví více času uvnitř lipidových raftů než mimo ně, a proto se nějakou dobu pohybují uvnitř těchto hustot. To způsobuje segregaci molekul podél membrány a zvyšuje pravděpodobnost, že různé molekuly budou v blízkosti sebe více času než jen náhodou (difúze), čímž se zvyšuje pravděpodobnost určitých molekulárních reakcí. Dále se předpokládá, že vysoká koncentrace určitých typů lipidů v lipidových raftech vytváří odlišné chemické prostředí, které usnadňuje některé chemické reakce nebo molekulární interakce. Předpokládá se, že lipidové rafty jsou přítomny ve vnější monovrstvě plazmatické membrány, protože právě na této straně se hojně vyskytují sfingolipidy. Bylo navrženo, že membránové domény existují také v membránách organel, a předpokládá se, že některé jejich funkce závisí na těchto membránových doménách.
Ve vnitřní monovrstvě plazmatické membrány se mikrodomény vytvářejí elektrostatickými interakcemi mezi základními cytosolovými doménami nebo doménami dvojmocných kationtů proteinů a negativními polárními hlavami lipidů. Dalším méně známým příkladem je asociace mezi fosfatidylinositolbisfosfátem a cholesterolem, která vytváří mikrodomény v této monovrstvě. Tyto mikrodomény směřující do cytosolu mohou ovlivňovat intracelulární proteinová lešení.
Tradičně se předpokládalo, že mezi oběma monovrstvami membrán nedochází k interakcím a že si své mikrodomény rozdělují nezávisle. Důkazy však naznačují, že k vzájemným interakcím dochází. Transmembránové proteiny ovlivňují současně obě monovrstvy, protože procházejí celou membránou. Jiný způsob synchronizace mezi oběma monovrstvami mohou zprostředkovávat dlouhé řetězce mastných kyselin, jako jsou některé sfingolipy, které mohou mít délku 24 uhlíků (normální délka je 18). Tyto dlouhé řetězce mohou být vloženy mezi řetězce mastných kyselin lipidů druhé monovrstvy a ovlivňovat lipidové rozložení. Kromě toho se předpokládá, že lipidové domény s dlouhými řetězci mastných kyselin jsou vyvažovány lipidovými mikrodoménami s krátkými řetězci mastných kyselin v druhé monovrstvě, čímž se udržuje konstantní tloušťka membrány.
Membránové proteiny, integrální i asociované, mohou také interagovat mezi sebou a sestavovat se do makromolekulárních lešení, aby usnadnily přenos informací, rozpoznávání buněk, spuštění některých enzymatických aktivit a buněčný pohyb. Existují také multimerní proteiny aktivní pouze tehdy, když všechny podjednotky drží pohromadě. Například inzulinový receptor se skládá ze čtyř podjednotek. Proteiny a lipidy mohou také interagovat a vytvářet membránové domény. Například ve vnitřní monovrstvě se fosfatidylinositol sdružuje kolem proteinů pomocí elektrických interakcí, které lze regulovat úpravou fosfátů polární hlavy lipidů.
Interakce s vnějšími prvky
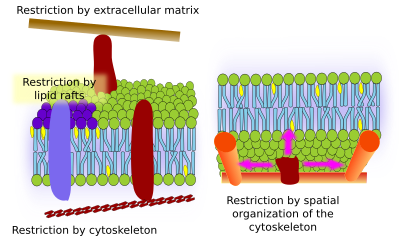
Integrální membránové proteiny mohou mít také laterální pohyby, ale jsou více omezené než lipidy, většinou kvůli interakcím s extracelulární matrix a cytoskeletem prostřednictvím jejich extracelulárních, respektive intracelulárních domén (obrázek 5). Tyto interakce mohou udržet proteiny v malých oblastech membrány po delší dobu než jen difuzí. Cytoskelet může těsně pod plazmatickou membránou vytvářet ploty, které udržují proteiny omezené v malých oblastech. Aktinová vlákna a mikrotubuly mohou uzavírat malé oblasti omezující difúzi proteinů a lipidů. Interakce s cytoskeletem jsou důležité, protože pokud je cytoskelet experimentálně dezorganizován, membrána se stává mnohem homogennější. Buňky mají další mechanismy, jak omezit proteiny na specifické domény. Například střevní epiteliální buňky mají některé přenašeče a enzymy umístěny v apikální plazmatické membráně, ale ne v bazo-laterální doméně kvůli pásu těsných spojů, molekulárnímu zipu, který brání difuzi mezi apikální a bazo-laterální doménou. Taková asymetrická distribuce je nezbytná pro fyziologii epiteliální buňky.
Membránové ohýbání je dalším způsobem vytváření mikrodomén. Zakřivení membrány může být výchozím bodem pro vytvoření vezikuly, rozšíření cytoplazmy pro buněčnou expanzi, změnu tvaru nebo růst organely, nebo jen pro zahájení bariéry pro omezení laterálního pohybu molekul. Jedná se o fyzikální omezení pomocí 3D uspořádání lipidů v menším úhlu membránového záhybu.
Molekulární nástroje potřebné pro ohýbání membrány se rekrutují ve specifických oblastech membrány. Tyto mikrodomény mohou mít specifické složení lipidů nebo specifické prostředí elektrického náboje. Fosfoinositidy (PIP), především PIP2 a PIP3, jsou lipidy, které přispívají k náboru proteinů pro ohýbání membrány. Jsou to užitečné molekuly, protože elektrický náboj a molekulární strukturu jejich polárních hlav lze snadno modifikovat chemickými reakcemi. Tímto způsobem se mohou v případě potřeby změnit vlastnosti určité oblasti membrány a rekrutovat specifické proteiny. Fosfatidylserin je také schopen iniciovat mikrodoménu pro ohýbání membrány, když je přemístěn z jedné monovrstvy do druhé pomocí flipasáz.
Ohýbání a tloušťka
Lipidové mikrodomény rekrutují proteiny, které účinně ohýbají membránu. V této úloze existují specializované proteiny (obr. 6). Jedním z nich jsou proteiny s doménou BAR (Bin/amphyphysin/Rsv161). Ohýbání může být vyvoláno dvěma mechanismy: sestavením zakřiveného lešení z proteinů, které membránu táhnou nebo tlačí, a vložením aminokyselinových sekvencí mezi lipidy jako klínu. Například kaveoliny způsobují zakřivení membrán a vytvářejí kavely, tetraspain nutí membrány vytvářet tubuly, ESCRT pomáhá s tvorbou vezikul uvnitř endozomů a vytváří multivesikulární tělíska. Aktin je silným činitelem ohýbání membrán polymerací aktinových vláken, která tlačí plazmatickou membránu směrem ven, což vede k rozšiřování buněk. Mnoho proteinů, které mohou zakřivovat plazmatickou membránu, také aktivuje polymerizaci aktinu.
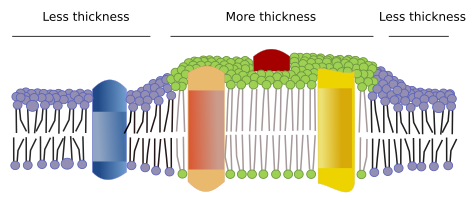
V membránách existují další domény, fyzikální domény, tvořené molekulami, jako jsou transmembránové proteiny. Tyto oblasti vykazují odlišnou tloušťku membrány, protože obsahují bílkoviny s delšími hydrofobními sekvencemi aminokyselin, které se obklopují lipidy s delšími řetězci mastných kyselin (obr. 7). Tyto bílkoviny a lipidy se „cítí“ pohodlněji, když jsou pohromadě, protože správně zapadají jejich hydrofobní části. Vytvářejí membránové domény, které vylučují jiné molekuly, buď proteiny, nebo lipidy, s kratšími hydrofobními oblastmi.
Bibliografie
Honigmann A, Pralle A. (2016). Kompartmentalizace buněčné membrány. Journal of mollecular biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Zakřivení membrán v buněčné biologii: integrace molekulárních mechanismů. Journal of cell biology. 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). High cholesterol/low cholesterol: effects in biologicalmembranes: a review Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.