Introdução
De acordo com a Organização Mundial de Saúde, a depressão afecta cerca de 350 milhões de pessoas em todo o mundo (Organização, 2017). Pacientes com depressão indicam sintomas de distúrbios de ansiedade e acompanhados com incapacidade de experimentar prazer e interesse, perda de concentração, dúvida própria, ansiedade social, distúrbio do sono e do apetite (Namola et al., 2015). Os principais factores que causam depressão são os desequilíbrios químicos ou hormonais no cérebro. A principal hormona associada à depressão é a serotonina. Outras hormonas são a norepinefrina e a dopamina (Yi et al., 2008). Estas hormonas são necessárias para o funcionamento normal do cérebro e para controlar os sentimentos. A destruição destas hormonas pode causar desequilíbrio químico no cérebro resultando em depressão.
Depressão pode ser tratada dependendo da sua gravidade, através de psicoterapia ou medicação. Os antidepressivos são os principais tipos de medicamentos usados para tratar a depressão. Há muitos tipos diferentes de medicamentos antidepressivos disponíveis, e eles diferem apenas na forma como agem no cérebro, no seu custo e no seu perfil de efeitos secundários. No tratamento de primeira linha, a maioria dos pacientes recebe um antidepressivo tricíclico (TCA) ou um inibidor seletivo de recaptação de serotonina (SSRI; McCarthy et al., 2016). Os medicamentos comumente usados para tratamentos de ansiedade são benzodiazepínicos. Embora existam muitos medicamentos antidepressivos no mercado usados para tratar a depressão, os efeitos secundários do uso desses medicamentos são de grande preocupação (Binfaré et al., 2009). Uma terapia alternativa da depressão é o uso de medicamentos fitoterápicos (Fajemiroye et al., 2016). O uso de extratos de ervas está ganhando maior aceitação entre a profissão médica e pelos pacientes. A maioria dos remédios herbais utilizados para o tratamento da depressão são extratos brutos ou semi-purificados (Calixto et al., 2000; Carlini, 2003; Guan e Liu, 2016).
Há escassez de relatos de pesquisas envolvendo o princípio ativo capaz de induzir atividade no sistema nervoso central (SNC). Uma revisão de Carlini (2003) inclui informações apenas sobre os efeitos psicanalépticos, psicolépticos e psicodislépticos. Uma revisão recente de Guan e Liu (2016) discutiu a relação estrutura-actividade dos efeitos antidepressivos dos flavonóides isolados de fontes naturais e sintéticas. Os alcalóides sintéticos intra-uterinos, sua atividade e uso potencial na medicina já foram revistos em vários artigos (de Sa et al., 2009). Entretanto, nenhum artigo de revisão foi publicado correlacionando os alcalóides indole vegetais isolados com a atividade antidepressiva. Esta revisão fornece informações sobre o potencial dos alcalóides indole naturais para o tratamento de distúrbios neurológicos, estudos de relação estrutura-actividade e extensão destes a outros metabolitos bioactivos como potencial antidepressivo leva sob a perspectiva da estrutura química. É compilado através de investigação bibliográfica de revistas científicas e literatura relevante identificada através de bases de dados eletrônicas da Web of Science.
Plantas Antidepressivas
Este artigo de revisão trata de plantas que possuem atividade sobre o SNC. Embora muitos tipos de plantas se enquadrem nesta categoria, destacaremos apenas as plantas que exibem propriedades antidepressivas. Duas plantas que contêm alcalóides indole são Passiflora incarnata L. (flor da paixão) e Mitragyna speciosa (Korth.) Havil (kratom), enquanto as outras duas plantas que não mostraram a presença de alcalóides indole são Piper methysticum G. Forst (kava) e Valeriana officinalis L., merecem atenção especial. A estrutura química dos compostos isolados destas plantas pode ser usada como base para o desenvolvimento de novas drogas.
Passiflora incarnata e outras espécies como P. alata Curtis, P. coerulea L. e P. edulis Sims são amplamente utilizadas como sedativo na medicina tradicional na maioria dos países europeus e na América (Houghton e Seth, 2003). A estrutura dos medicamentos benzodiazepínicos consiste num anel de benzeno fundido a um sistema diazepínico composto por um grupo heterocíclico de sete membros com dois átomos de azoto nas posições 1 e 2 do anel. Alcalóides indolares isolados de P. incarnata, nomeadamente harman, harmol, harmine, harmalol e harmaline consistem num anel de benzeno fundido a um heterociclo de cinco membros contendo um átomo de azoto.
Estudos transversais indicaram que P. incarnata tem um perfil farmacológico semelhante ao dos benzodiazepínicos e actua através de receptores de ácido gama-aminobutírico (GABA) (Jawna-Zboiñska et al., 2016). As folhas de M. speciosa têm sido usadas como medicina tradicional para tratar diarreia, diabetes e para melhorar a circulação sanguínea (Vicknasingam et al., 2010). A mitragina é o principal alcalóide indole presente na M. speciosa com os seus análogos, speciogynine, paynantheine e speciociliatine (León et al., 2009). Dois estudos realizados com extrato aquoso e extrato alcaloidal de M. speciosa induziram efeito antidepressivo em modelos de desespero comportamental em ratos (Kumarnsit et al., 2007). Um estudo conduzido por Idayu et al. (2011) sobre mitragina mostra o efeito dos antidepressivos no modelo comportamental animal de depressão através da interação com o eixo hipotálamo-hipófise-adrenal (HPA) no sistema neuroendócrino (Idayu et al., 2011).
Methysticum G. Forst é consumido como uma bebida chamada kava que induz um agradável estado mental em direção a uma sensação de alegria enquanto reduz a fadiga e ansiedade (Bilia et al., 2002). O estudo mostra que a maioria das atividades farmacológicas são retidas a partir do extrato lipossolúvel em comparação com o extrato aquoso. O extrato lipido-solúvel contém pelo menos sete pironas, conhecidas como kavalactone. As kavalactonas geralmente interagem com a dopaminérgica, serotonina, ácido gama-aminobutírico (GABA), neurotransmissões glutamátricas, previne a monoamina oxidase B (MOB) e também fornece uma variedade de efeitos nos canais iônicos (Grunze et al., 2001). A diidrometysticina é uma das seis principais kavalactonas encontradas na planta kava. A estrutura da dihidrometysticina compreende uma ariletilena-α-pirona ligada a uma meia semelhante à do indole, compreendendo dois oxigenados em vez de nitrogênios. Ela contribui para a atividade ansiolítica e atua como antidepressiva. Estudos duplo-cego controlados por placebo demonstraram que as kavalactones afectam as actividades ansiolíticas sem depressar as funções mentais e motoras e melhoram a qualidade do sono. As kavalactonas são uma alternativa para substituir o uso de benzodiazepinas na terapia da depressão (Malsch e Kieser, 2001).
Valeriana officinalis L., também conhecida como valeriana é amplamente utilizada por muitos países como sedativo, anticonvulsivo, para efeitos hipnóticos e actividade ansiolítica (Ghaderi e Jafari, 2014). O ácido valerénico e os valepotriatos têm sido reportados como ingredientes activos em preparações farmacêuticas e os extractos crus comerciais da valeriana têm sido utilizados em muitos países (Bos et al., 2002). Valepotriatos que compreendem triésteres de poli-hidroxiciclopenta-(c)-pirans com os ácidos carboxílicos: acético, valérico, isovalérico, α-isovaleroxi-isovalérico, β-metilvalérico, β-acetoxi-isovalérico, β-hidroxi-isovalérico e β-acetoxi-β- ácido metilvalérico, são usados como sedativos. Os valepotriatos são instáveis, termolábeis e se decompõem rapidamente sob condições ácidas ou alcalinas na água, assim como em soluções alcoólicas (Bos et al., 2002). Os valepotriatos são úteis na melhoria das condições animais e humanas durante a retirada de benzodiazepinas (Poyares et al.., 2002).
Embora haja uma variedade de diferentes constituintes químicos, o mecanismo de ação é relatado como interação da valeriana com o sistema GABA no cérebro através da inibição da transaminase GABA, a interação com o receptor GABA/benzodiazepina e interferência na absorção e recrutamento de GABA em sinaptosomas (Sichardt et al., 2007). Vários modelos têm sido utilizados para investigar os efeitos antidepressivos das plantas. Modelos farmacodinâmicos incluem modelos in vitro, in vivo e modelos clínicos foram utilizados para avaliar os efeitos (Tabela 1). A maioria das espécies de plantas selecionadas analisadas foram estudadas in vivo, alguns estudos in vitro e apenas kava foram submetidos a ensaios clínicos. Em todos os casos, é necessário realizar mais investigação para estabelecer os compostos activos, a dose mais eficaz e determinar se esta varia entre os diferentes tipos de depressões.

TABLE 1. Informação de estudos farmacológicos de plantas revistas.
Álcaloides indolares
Álcaloides indolares têm uma estrutura bicíclica, consistindo de um anel de benzeno de seis membros fundido a um anel de pirrol com cinco membros contendo nitrogênio. Este anel de pirólise com átomo de azoto dá origem às propriedades básicas dos alcalóides indole que os tornam particularmente activos farmacologicamente (El-Sayed e Verpoorte, 2007). Os alcalóides indole estão amplamente distribuídos em plantas pertencentes às famílias Apocynaceae, Loganiaceae, Rubiaceae, e Nyssaceae. Entre os alcalóides indole importantes que foram isolados das plantas incluem-se o medicamento anti-hipertensivo, a reserpina de Rauvolfia serpentina (Sagi et al., 2016) e os poderosos medicamentos antitumor, vinblastina e vincristina de Catharanthus roseus (El-Sayed e Verpoorte, 2007). Estudos sobre a eficácia dos alcalóides indole no tratamento da depressão não são novos e têm sido realizados desde 1952, mas atualmente muito pouca atenção tem sido dada pela comunidade científica aos benefícios da utilidade terapêutica das plantas dotadas de propriedades antidepressivas.
Os alcalóides indole estão frequentemente associados à função dos receptores de proteína G, em particular para a transmissão do sinal neuronal através dos receptores de serotonina (5-HT/hidroxitriptamina). Além do do doador de hidrogênio via N-H livre, a presença de π – densidade de elétrons contribui para a energia orbital molecular (HOMO) mais alta ocupada do esqueleto de indole planar. Isto permite a interacção com as nucleobases, em particular o átomo protonado, bem como as proteínas alvo (de Sa et al., 2009). A estrutura química do neurotransmissor serotonina é baseada no anel aromático de indole rico em electrões. A presença do átomo de nitrogênio no anel interno é para manter o sistema aromático e torna a ligação N-H ácida em vez de nitrogênio básico. O anel indole é capaz de formar ligações de hidrogênio através do N-H moiety e π-π empilhamento ou interações cation-π, através do moiety aromático (Shimazaki et al., 2009). A hidrofobicidade dos anéis de indole é quase a mesma da subunidade fenil e menos hidrofóbica do que o clássico benzotiofeno isostérico e o anel benzofurano. O grupo de N-H indole desempenha um papel decisivo na interacção com o bioreceptor alvo, enquanto os derivados sintetizados do benzotiofeno e benzofurano apresentam afinidade moderada a limitada para o bioreceptor alvo (de Sa et al., 2009). A reserpina é um dos exemplos de alcalóides indole isolados durante os últimos 60 anos que mostram ação sedativa sobre o SNC. A propósito, duas substâncias químicas, a triptamina e a serotonina encontradas no cérebro também são derivados alcalóides indole.
No presente os constituintes ativos dos extratos vegetais responsáveis pelo efeito antidepressivo ainda não está claro. Assim, tentamos identificar algumas estruturas químicas importantes isoladas de extratos de plantas que exibem atividade antidepressiva e verificar a similaridade do padrão esqueleto que pode contribuir para a atividade antidepressiva. As primeiras tentativas foram feitas para identificar semelhanças estruturais entre serotonina e alcalóides indole. A semelhança mais distinta consiste em seis anéis heterocíclicos de membros fundidos a cinco anéis de membros. A diferença é a presença de um átomo de nitrogênio ou distribuição de π elétrons (Figura 1). Através de um estudo de relação estrutura-actividade Nichols (2012) relatou que a variação de actividade de diferentes tipos de moléculas sugere que o receptor é muito sensível à natureza da triptamina. Outros compostos químicos que são isolados com sucesso de plantas antidepressivas são mencionados neste artigo de revisão porque são talvez agonistas específicos com padrões de substituição particulares que são capazes de ativar seletivamente um subconjunto de efetores. Este fenômeno é agora conhecido como seletividade funcional.
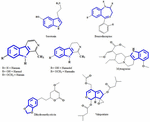
FIGURA 1. Estruturas químicas de serotonina, benzodiazepina e compostos isolados de plantas antidepressivas. Similaridade no padrão do esqueleto, que consiste de seis anéis heterocíclicos de membros, ligados com cinco anéis de membros.
Serotonina, é amplamente utilizada na função cerebral e cognição como agonista receptor endógeno (Fink e Göthert, 2007). A serotonina exerce suas funções através de sete famílias de receptores (5-HT1-5-HT7) que são membros da família de receptores acoplados à proteína G. Uma série de compostos que contêm a fracção de dentro da serotonina tem sido descrita como tendo afinidade com diferentes receptores de serotonina (Kochanowska-Karamyan e Hamann, 2010). A semelhança estrutural dos alcalóides indole (agonistas exógenos) com neurotransmissores endógenos como a serotonina tem levado os investigadores a prever a potencial atividade neurológica dessas moléculas. O esquema dos processos associados à neurotransmissão de agonistas exógenos é descrito na Figura 2.
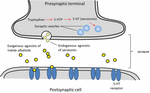
FIGURA 2. Esquema dos processos associados à neurotransmissão. Agonistas exógenos de alcalóides indole de plantas que partilham semelhanças estruturais com a serotonina, o que lhes permite ligarem-se a receptores de serotonina (receptores 5-HT).
O anel indole também é conhecido como bioisosteres e tem semelhanças químicas e físicas semelhantes às moléculas biológicas. Esta semelhança é utilizada no desenvolvimento do protótipo do medicamento que visa melhorar a actividade farmacológica e optimizar o perfil farmacocinético. Em outro estudo de avaliação farmacológica de benzofuranos e tienopirrol levou a moléculas bioisostéricas que possuem atividade semelhante à dimetiltriptamina. Os primeiros trabalhos com benzotiofenos e 3-indenalquilaminas demonstraram que para compostos sem substituto de anel, a capacidade de agir como agonistas no fundo do rato era mais ou menos a mesma que as triptaminas. Os resultados revelaram que o NH indole não era essencial para activar o receptor 5-HT2 no fundo do rato (Nichols, 2012). Uma série de antagonistas do receptor 2-aryl indole NK1 e seus derivados são bons ligantes, mas têm baixa biodisponibilidade oral em ratos. A fim de aumentar a solubilidade e absorção, o nitrogênio básico foi introduzido, levando ao azaindole analógico e compostos relacionados exibindo a mesma afinidade de ligação de NK1 com a série de antagonistas do receptor de 2-aril indole NK1 (Cooper et al., 2001). A doca molecular de 2 ligandos derivados de fenil-indole com receptores de serotonina 5-HT6 e melanocortina-4 indicam que o andaime privilegiado pode acomodar, dependendo da natureza conservada subpocket e bolsa de ligação não conservada. As interacções das partes não conservadas da bolsa de ligação são responsáveis por diferenças importantes no reconhecimento molecular pelo receptor alvo correspondente (Bondensgaard et al, 2004).
De acordo com de Sa et al. (2009) alcalóides indole comuns encontrados em fontes naturais são aminoácidos triptofanos na nutrição humana e a descoberta de hormônios vegetais que têm efeitos terapêuticos como anti-inflamatórios, um inibidor da fosfodiesterase, agonistas e antagonistas do receptor 5-HT, agonistas do receptor canabinoide e inibidores da HMG-CoA redutase. O andaime Indole tem bolsas de ligação e possui um domínio de ligação complementar comum ao receptor alvo, que pertence a uma classe de GPCRs (receptores de membrana importantes da proteína G acoplados). A maioria dos medicamentos no mercado contém a subestrutura indole. Estes incluem indometacina, ergotamina, frovatriptan, ondansetron e tadalafil.
Conclusão
Esta revisão encontrou que a maioria dos remédios à base de plantas indicados para o tratamento de doenças psiquiátricas eram cruas ou semipurificadas. Os resultados para in vivo e in vitro variam e não foram reprodutíveis porque em diferentes regiões biogeográficas o conteúdo de metabolitos secundários das plantas está correlacionado com a disponibilidade de nutrientes, clima e condições ecológicas. Além disso, a bioactividade das plantas pode ser contribuída por um único composto ou mistura de compostos. Os autores sugerem que o esforço para obter princípios ativos, identificação fitoquímica e estudo metabólico deve ser realizado com inspeções in vitro e in vivo para uma melhor caracterização das drogas baseadas em plantas. Na maioria dos casos, a síntese dos alcalóides indole foram inspirados pelas moléculas naturais e sua semelhança com a serotonina.
Os alcalóides indole de fontes vegetais são bastante complexos em comparação com os sintéticos. A importância dos alcalóides sintéticos do indole já está estabelecida, pois a estrutura está disponível em vários receptores ligand, inibidores enzimáticos e moduladores bioreceptores. Alguns dos alcalóides indole de ocorrência natural não podem ser sintetizados por métodos conhecidos atualmente. Além disso, a maioria das informações sobre a eficácia dos alcalóides indole foi relatada a partir dos alcalóides sintéticos indole. Como resultado, o potencial de muitos alcalóides indole de ocorrência natural como novos fármacos para vários distúrbios psiquiátricos ainda está inexplorado. Historicamente, os compostos à base de plantas têm sido a fonte de vários dos mais bem sucedidos indutores de drogas ou drogas usadas na medicina. Isto é indicativo de que mais podem estar por descobrir.
Em conclusão, vários alcalóides indole têm sido empregados como antidepressivos ou fornecem estruturas de chumbo para o seu desenvolvimento. Com base em nossas descobertas, as plantas contêm um reservatório de alcalóides indole que são pontos de partida valiosos para o desenvolvimento de futuros antidepressivos.
Contribuições dos autores
HH: Preparando o manuscrito. MY: Editar em inglês e sugerir algumas informações importantes para melhorar o manuscrito. AR: Contribuir para a compreensão do esquema dos processos associados à neurotransmissão.
Funding
O apoio para este trabalho foi fornecido pela Universiti Malaysia Pahang através da bolsa de pesquisa UMP RDU170302 para HH.
Declaração de conflito de interesses
Os autores declaram que a pesquisa foi realizada na ausência de qualquer relação comercial ou financeira que pudesse ser interpretada como um potencial conflito de interesses.
Bilia, A. R.., Gallori, S., e Vincieri, F. F. (2002). Kava-kava e ansiedade: conhecimento crescente sobre a eficácia e segurança. Life Sci. 70, 2581-2597. doi: 10.1016/S0024-3205(02)01555-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Binfaré, R. W., Rosa, A. O., Lobato, K. R., Santos, A. R., e Rodrigues, A. L. S. (2009). A administração de ácido ascórbico produz um efeito antidepressivo: evidência do envolvimento de neurotransmissão monoaminérgica. Prog. Neuropsicofarmacol. Biol. Psychiatry 33, 530-540. doi: 10.1016/j.pnpbp.2009.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Bondensgaard, K., Ankersen, M., Thøgersen, H., Hansen, B. S., Wulff, B. S., e Bywater, R. P. (2004). Recognition of privileged structures by G-protein coupled receptors. J. Med. Química. 47, 888-899. doi: 10.1021/jm0309452
PubMed Abstract | CrossRef Full Text | Google Scholar
Bos, R., Woerdenbag, H. J., e Pras, N. (2002). Determinação de valepotriados. J. Chromatogr. A 967, 131-146. doi: 10.1016/S0021-9673(02)00036-5
CrossRef Full Text | Google Scholar
Calixto, J. B., Beirith, A., Ferreira, J., Santos, A. R., e Yunes, R. A. (2000). Substâncias antinociceptivas de origem vegetal que ocorrem naturalmente. Fitoterápicos. Res. 14, 401-418. doi: 10.1002/1099-1573(200009)14:6<401::AID-PTR762>3.0.CO;2-H
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlini, E. (2003). As plantas e o sistema nervoso central. Farmacol. Bioquímica. Behav. 75, 501-512. doi: 10.1016/S0091-3057(03)00112-6
CrossRef Full Text | Google Scholar
Cooper, L. C., Chicchi, G. G., Dinnell, K., Elliott, J. M., Hollingworth, G. J., Kurtz, M. M., et al. (2001). 2-Aryl indole NK 1 antagonistas dos receptores: optimização da substituição do indole. Bioorg. Med. Quimioquímica. Lett. 11, 1233-1236. doi: 10.1016/S0960-894X(01)00182-2
CrossRef Full Text | Google Scholar
de Sa, A., Fernando, R., Barreiro, E. J., Fraga, M., e Alberto, C. (2009). Da natureza à descoberta de drogas: o andaime interior como uma “estrutura privilegiada”. Mini Rev. Med. Química. 9, 782-793. doi: 10.2174/138955709788452649
CrossRef Full Text | Google Scholar
El-Sayed, M., e Verpoorte, R. (2007). Catharanthus terpenoid alkaloids indole: biossíntese e regulação. Fitoquímica. Rev. 6, 277-305. doi: 10.1007/s11101-006-9047-8
CrossRef Full Text | Google Scholar
Fajemiroye, J. O., Silva, D. M., Oliveira, D. R., e Costa, E. A. (2016). Tratamento da ansiedade e da depressão: plantas medicinais em retrospectiva. Fundam. Clin. Farmacol. 30, 198-215. doi: 10.1111/fcp.12186
PubMed Abstract | CrossRef Full Text | Google Scholar
Fiebich, B. L., Knörle, R., Appel, K., K., Kammler, T., and Weiss, G. (2011). Estudos farmacológicos em uma combinação de drogas herbais de Hipericum perforatum e Passiflora incarnata: evidências in vitro e in vivo de sinergia entre Hypericum e Passiflora em modelos farmacológicos antidepressivos. Fitoterapia 82, 474-480. doi: 10.1016/j.fitote.2010.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Fink, K. B., e Göthert, M. (2007). 5-HT regulação do receptor de libertação de neurotransmissores. Farmacol. Rev. 59, 360-417. doi: 10.1124/pr.59.07103
CrossRef Full Text | Google Scholar
Ghaderi, N., e Jafari, M. (2014). Regeneração eficiente de plantas, fidelidade genética e acumulação de alto nível de dois compostos farmacêuticos em plantas regeneradas de Valeriana officinalis L. S. Afr. J. Bot. 92, 19-27. doi: 10.1016/j.sajb.2014.01.010
CrossRef Full Text | Google Scholar
Grunze, H., Langosch, J., Schirrmacher, K., Bingmann, D., Von Wegerer, J., and Walden, J. (2001). As pironas Kava exercem efeitos sobre a transmissão neuronal e correntes catiônicas transmembranas semelhantes aos estabilizadores de humor estabelecidos – uma revisão. Prog. Neuropsicofarmacol. Biol. Psychiatry 25, 1555-1570.
Google Scholar
Guan, L.-P., e Liu, B.-Y. (2016). Efeitos antidepressivos e mecanismos dos flavonoides e análogos relacionados. Eur. J. Med. Chem. 121, 47-57. doi: 10.1016/j.ejmech.2016.05.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hattesohl, M., Feistel, B., Sievers, H., Lehnfeld, R., Hegger, M., e Winterhoff, H. (2008). Extratos de Valeriana officinalis L. sl mostram efeitos ansiolíticos e antidepressivos, mas nem sedativos nem propriedades miorelaxantes. Phytomedicine 15, 2-15. doi: 10.1016/j.phymed.2007.11.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Houghton, P. J., e Seth, P. (2003). As plantas e o sistema nervoso central. Farmacol. Bioquímica. Behav. 75, 497-499. doi: 10.1016/S0091-3057(03)00161-8
CrossRef Full Text | Google Scholar
Idayu, N. F., Hidayat, M. T., Moklas, M., Sharida, F., Raudzah, A. N., Shamima, A., et al. (2011). Efeito antidepressivo da mitragina isolada da Mitragyna speciosa Korth em ratos modelo de depressão. Phytomedicine 18, 402-407. doi: 10.1016/j.phymed.2010.08.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Jawna-Zboiñska, K., Blecharz-Klin, K., Joniec-Maciejak, I., Wawer, A., Pyrzanowska, J., Piechal, A., et al. (2016). Passiflora incarnata L. Melhora a memória espacial, reduz o estresse e afeta a neurotransmissão em ratos. Fitoterapia. Res. 30, 781-789. doi: 10.1002/ptr.5578
PubMed Abstract | CrossRef Full Text | Google Scholar
Kochanowska-Karamyan, A. J., e Hamann, M. T. (2010). Alcalóides de interior marinho: novas drogas potenciais para o controle da depressão e ansiedade. Chem. Rev. 110, 4489-4497. doi: 10.1021/cr900211p
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumarnsit, E., Vongvatcharanon, U., Keawpradub, N., e Intasaro, P. (2007). Imunoreatividade tipo Fos em núcleos de ráquis dorsais de ratos induzidos por extrato alcalóide de Mitragyna speciosa. Neurosci. Lett. 416, 128-132. doi: 10.1016/j.neulet.2007.01.061
PubMed Abstract | CrossRef Full Text | Google Scholar
León, F., Habib, E., Adkins, J. E., Furr, E. B., McCurdy, C. R., e Cutler, S. J. (2009). Caracterização fitoquímica das folhas de Mitragyna speciosa cultivadas nos EUA. Nat. Prod. Commun. 4, 907-910.
PubMed Abstract | Google Scholar
Malsch, U., e Kieser, M. (2001). Eficácia da kava-kava no tratamento da ansiedade não-psicótica, após pré-tratamento com benzodiazepinas. Psicofarmacologia 157, 277-283. doi: 10.1007/s002130100792
PubMed Abstract | CrossRef Full Text
McCarthy, A., Wafford, K., Shanks, E., Ligocki, M., Edgar, D. M., e Dijk, D.-J. (2016). Homeostasia do sono REM na ausência do sono REM: Efeitos dos antidepressivos. Neurofarmacologia 108, 415-425. doi: 10.1016/j.neuropharm.2016.04.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Namola, V., Ratan, P., e Kothiyal, P. (2015). Depressão e papel dos biomateriais marinhos: uma revisão. Eur. J. Biomed. Pharm. Sci. 2, 137-148.
Nichols, D. E. (2012). Relações estrutura-actividade dos agonistas da serotonina 5-HT 2A. Membr. WIREs. Transp. Signaling 1, 559-579. doi: 10.1002/wmts.42
CrossRef Full Text | Google Scholar
Organization, W. H. (2017). Ficha de Depressão 2016. Disponível em: http://www.who.int/mediacentre/factsheets/fs369/en/
Pesquisador do Google
Poyares, D. R., Guilleminault, C., Ohayon, M. M., e Tufik, S. (2002). A valeriana pode melhorar o sono dos insones após a retirada da benzodiazepina? Prog. Neuropsicofarmacol. Biol. Psychiatry 26, 539-545.
PubMed Abstract | Google Scholar
Sagi, S., Avula, B., Wang, Y.-H., e Khan, I. A. (2016). Quantificação e caracterização de alcalóides a partir de raízes de Rauwolfia serpentina usando cromatografia líquida de ultra-alto desempenho – espectrometria de massa de matriz de diodos fotográficos. Anal. Bioanal. Chem. 408, 177-190. doi: 10.1007/s00216-015-9093-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Sarris, J., Kavanagh, D., Byrne, G., Bone, K., Adams, J., and Deed, G. (2009). The Kava Anxiety Anxiety Depression Spectrum Study (KADSS): um estudo randomizado, controlado por placebo, usando um extrato aquoso de Piper methysticum. Psicofarmacologia 205, 399-407. doi: 10.1007/s00213-009-1549-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Shimazaki, Y., Yajima, T., Takani, M., and Yamauchi, O. (2009). Complexos metálicos envolvendo anéis internos: estruturas e efeitos das interações metal-indole. Coord. Chem. Rev. 253, 479-492. doi: 10.1016/j.ccr.2008.04.012
CrossRef Full Text | Google Scholar
Sichardt, K., Vissiennon, Z., Koetter, U., Brattström, A., e Nieber, K. (2007). Modulation of postsynaptic potentials in rat cortical neurons by valerian extract macerated with different alcohols: involvement of adenosine A1-and GABAA-receptors. Phytother. Res. 21, 932-937. doi: 10.1002/ptr.2197
PubMed Abstract | CrossRef Full Text | Google Scholar
Vicknasingam, B., Narayanan, S., Beng, G. T., and Mansor, S. M. (2010). O uso informal do cetum (Mitragyna speciosa) para a retirada de opióides nos estados do norte da Malásia peninsular e implicações para a terapia de substituição de drogas. Int. J. Drug Policy 21, 283-288. doi: 10.1016/j.drugpo.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Vijeepallam, K., Pandy, V., Kunasegaran, T., Murugan, D. D., e Naidu, M. (2016). O extrato de folha de Mitragyna speciosa exibe efeito antipsicótico com potencial para aliviar sintomas positivos e negativos de psicose em camundongos. Frente. Pharmacol. 7:464. doi: 10.3389/fphar.2016.00464
PubMed Abstract | CrossRef Full Text | Google Scholar
Yi, L.-T., Li, J.-M., Li, Y.-C., Pan, Y., Xu, Q., and Kong, L.-D. (2008). Efeitos antidepressivos comportamentais e neuroquímicos da apigenina química associada aos cítricos. Life Sci. 82, 741-751. doi: 10.1016/j.lfs.2008.01.007
PubMed Abstract | CrossRef Full Text | Google Scholar