Background
Artemisia annua é uma erva medicinal chinesa (também conhecida como “qing hao” ou “madeira de verme doce”) com actividade anti-malária bem comprovada (1). As terapias combinadas baseadas em artemisinina (ACTs) são recomendadas pela Organização Mundial de Saúde (OMS) para o tratamento da malária sem complicações em combinação com agentes anti-maláricos eficazes (2). A quimioprofilaxia para viajantes depende do destino de viagem endêmico da malária e inclui uma combinação deatovaquon/proguanil, cloroquina, doxiciclina, mefloquina, ou primaquina (3, 4). Casos de infecção por malária sob quimioprofilaxia derivada da artemisinina foram descritos (5) e a OMS não recomenda o uso de material vegetal A. annua, sob qualquer forma, incluindo chá, para o tratamento ou prevenção da malária (6).
Suplementos dietéticos e de ervas (HDS) são cada vez mais utilizados em todo o mundo e a lesão hepática induzida pela HDS está se tornando uma preocupação crescente (7). Apesar do uso extensivo de ACTs em áreas endêmicas de malária, a lesão hepática derivada da artemisinina é rara (8, 9). Kumar relatou um caso de um paciente que desenvolveu uma lesão hepática colestática 6 semanas após tomar um suplemento herbal contendo artemisinina por via oral para manutenção geral da saúde (10). Há algumas outras publicações relacionadas à lesão hepática induzida por Artemisia annua (9, 11-14). Uma diretriz clínica para avaliar a causalidade e fazer o diagnóstico de lesão hepática induzida por ervas foi recentemente proposta pela Associação Chinesa de Medicina Chinesa (15). Apresentamos um caso de hepatite colestática aguda devido à ingestão de chá de Artemisia como quimioprofilaxia num paciente que regressava da Etiópia.
Case Report
Um homem de 51 anos de idade apresentou ao serviço de urgência do Hospital Universitário de Basileia, Suíça, com mal-estar, desconforto abdominal, fezes amarelas flutuantes, icterícia e colúria de 4 dias de duração e uma perda de peso de 6-8 kg nas últimas 6 semanas. Tinha regressado de uma viagem de 4 semanas à Etiópia 3 semanas antes de procurar cuidados médicos. Durante a sua estadia na Etiópia, consumiu diariamente 1,25 g de Artemisia annua em pó-tea como quimioprofilaxia para a malária. Em cerca de 90% dos casos ele diluiu o pó em água fervente, nos restantes 10% o pó foi ingerido misturado com alimentos. O suplemento tinha sido comprado através da Internet. O paciente forneceu-nos o recipiente, que originalmente continha 50 g de um pó verde escuro (Figura 1). Na apresentação 2 g estavam no recipiente, indicando que ele tinha consumido um total de 48 g. Durante a sua estadia na Etiópia, ele também tinha consumido outras preparações semelhantes ao chá . Tanto quanto sabemos, não há nenhuma hepatotoxicidade descrita relacionada a estas substâncias. Ele negou ter tomado qualquer outra prescrição, de venda livre, ou medicamentos à base de ervas. Ele não tinha antecedentes ou histórico familiar de doenças hepáticas, abuso de álcool ou drogas, ou fatores de risco para hepatite viral. Ele relatou que sua esposa, que o acompanhou em sua viagem à Etiópia, também tinha consumido chá Artemesia annua para a profilaxia da malária. Ela permaneceu bem durante todo o tempo.

Figura 1. Chá Artemisia annua em pó.
Parte de icterícia marcada, estava em bom estado geral e tinha sinais vitais notáveis (afebril com pressão arterial normal, frequência cardíaca e respiratória).
Testes laboratoriais mostraram: alanina-aminotransferase (ALAT) 91 U/L (normal, 9-59); aspartato aminotransferase (ASAT) 42 U/L (normal, 9-34); fosfatase alcalina (ALP) 151 U/L (normal, 40-130); gama-glutamil transferase (GGT) 416 U/L (normal, 12-68); bilirrubina total 186.6 μmol/L (normal, 0-24) (bilirrubina conjugada 168,5 μmol/L); e relação normalizada internacional (INR) 0,9 (normal, 0,9-1,3). O nível de ácido biliar foi elevado para 460,5 μmol/L (normal, 0-8,0). O hemograma diferencial e a proteína c-reativa foram normais. Hiponatremia leve e hipocloremia estavam presentes, consistentes com o aumento da ingestão de água do paciente nos dias anteriores. Os testes sorológicos para hepatite aguda A, B, C e E, vírus Epstein-Barr e infecção por citomegalovírus foram negativos. A coeruloplasmina estava normal. Autoanticorpos específicos do fígado (anticorpo anti-nuclear, anticorpo anti-neutrófilos, anticorpo anti-músculo liso, anticorpo anti-mitocondrial, anticorpo anti-proteinase 3 e anticorpo anti-mioeloperoxidase) foram negativos e IgA, IgM e IgG estavam dentro da faixa de normalidade. A ultrassonografia abdominal mostrou um parênquima hepático, vasos e ductos biliares normais. A elastografia hepática foi elevada (FibroScan, 12,7 kPa, intervalo normal <5 kPa).
O paciente também foi avaliado no Swiss Tropical and Public Health Institute para várias potenciais condições infecciosas subjacentes. Os anticorpos contra a febre maculosa por rickettsia foram positivos, entretanto, isto foi considerado não relacionado à apresentação clínica e nenhuma terapia antibiótica foi iniciada.
A biópsia hepática inicial mostrou uma hepatite portal com infiltração linfocítica dos ductos biliares e bilirrubinostase intra-canal e intra-citoplasmática difusa. Não foi observada fibrose nem material parasitário (Figuras 2A,B). Uma análise sequencial da próxima geração no DNA dos leucócitos do sangue periférico para variantes genéticas nos genes que codificam os 3 transportadores hepáticos mais importantes para a homeostase biliar ácida, nomeadamente BSEP, MDR3 e FIC1, não encontrou variantes tipicamente associadas a doenças hepáticas colestáticas hereditárias.
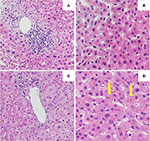
Figura 2. Histologia da primeira (A,B) e da segunda (C,D) biópsia hepática. (A) Vista de baixa potência da biópsia hepática mostrando um infiltrado linfocitário portal. (B) Parênquima hepático com bilirrubinostase intracelular (HE, 20x). (C) Visão de baixa potência da biópsia hepática sem inflamação portal significativa (HE, 10x). (D) Parênquima hepático com bilirrubinostase intracelular e extracelular significativa (HE, 20x).
A análise toxicológica do chá Artemisia por cromatografia líquida – espectrometria de massa e cromatografia gasosa – espectrometria de massa revelou os seguintes ingredientes: arteanuina b, deoxiartemisina, cânfora e escopoletina.
Tratamento com prednisona 20mg duas vezes ao dia e ácido ursodeoxicólico 500 mg duas vezes ao dia foi iniciado. Devido à icterícia persistente, bem como ao aumento da bilirrubina durante 4 semanas, apesar do tratamento, foi realizada uma segunda biópsia hepática. A segunda biópsia mostrou uma grave bilirrubinostase intracitoplasmática bem como intracanalicular, com apenas inflamação mínima em comparação à primeira biópsia (Figuras 2C,D). O tratamento com corticosteroides foi interrompido, o ácido ursodeoxicólico foi continuado até a resolução da icterícia e normalização da bilirrubina (15,3 μmol/l) (Figura 3) e redução relevante dos ácidos biliares (19,5 μmol/l) que ocorreu três meses após o início da doença.
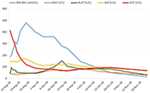
Figura 3. Curso de bilirrubina e enzimas hepáticas ao longo do tempo.
O caso foi relatado à unidade de farmacovigilância da autoridade nacional suíça para produtos terapêuticos (Swissmedic). O consentimento livre e esclarecido por escrito foi obtido do participante para a publicação deste relato de caso.
Discussão
Artemisina-derivados são uma pedra angular para o tratamento, mas não a quimioprevenção da malária (2). Apesar de seu uso extensivo, a lesão hepática derivada da artemisinina raramente tem sido descrita (8, 10). Tanto quanto sabemos, este é o primeiro relato de caso de uma hepatite colestática aguda devido à ingestão do chá Artemisia annua.
Herbal e suplementos dietéticos – a lesão hepática induzida é um tópico de crescente interesse uma vez que a HDS é cada vez mais utilizada em todo o mundo (7). A ingestão de HDS é muitas vezes considerada inofensiva, no entanto, um número crescente de eventos adversos que ocorrem paralelamente ao seu uso tem sido relatado (16). Além disso, como a concentração e composição da HDS muitas vezes não são declaradas nos rótulos dos produtos, a qualidade e quantidade dos ingredientes do produto permanecem desconhecidas. Em nosso caso, o diagnóstico de lesão hepática induzida pela HDS devido à ingestão do chá Artemisia annua foi baseado na forte relação temporal entre exposição e desenvolvimento da reação adversa e a ausência de outras etiologias possíveis. Nós calculamos a pontuação de avaliação da causalidade de acordo com o RUCAM (Roussel Uclaf Causality Assessment Method) (17) e obtivemos uma pontuação de 6 correspondente a uma causalidade “provável” da droga incriminada. Os diferentes itens foram pontuados da seguinte forma: tempo para início (+2), curso (+1), fatores de risco (+1), drogas concomitantes (-1), exclusão de outras causas de lesão hepática (+2), informação prévia sobre hepatotoxicidade da droga (+1), resposta à readministração (0). Não houve outras etiologias identificáveis de doença hepática.
O caso descrito anteriormente por Kumar apresentava padrão hepatocelular de lesão hepática, seguido de fase colestática prolongada (10). Nosso paciente apresentou um padrão predominantemente colestático de lesão hepática 5 semanas após a primeira ingestão do chá Artemisia annua. Assumimos que a história natural foi semelhante ao caso de Kumar, mas que nosso paciente apresentou numa fase posterior durante a evolução da lesão hepática. Na análise toxicológica do chá de ervas ingerido identificamos adicionalmente escopoletina e cânfora, que ocorrem naturalmente na Artemisia annua (18, 19) e podem ter contribuído para o início da lesão hepática colestática.
O mecanismo da lesão hepática induzida pela artemisina-derivada permanece pouco claro. Os componentes químicos da Artemisiae spp incluem óleos voláteis, flavonóides, taninos, triterpenos e polissacarídeos. Os óleos voláteis de Artemisiae spp têm forte actividade farmacológica e toxicidade, e uma abordagem bioinformática recente identificou várias vias que podem estar envolvidas no desenvolvimento de lesões hepáticas (20). A predisposição para lesões hepáticas colestáticas induzidas por drogas tem sido associada a polimorfismos da bomba de exportação de sal da bílis (21, 22). Por isso, procuramos variantes em transportadores de ácido biliar por sequenciamento de próxima geração. Não detectamos uma deleção, duplicação ou variante patológica nas seqüências dos genes ABCB11, ATP8B1 e ABCB4 (regiões de codificação e flanqueamento) codificação para BSEP, FIC1 e MDR3, respectivamente (Figura 4). Entretanto, foram identificadas várias variantes de seqüências comuns. Nosso paciente abrigava homozigamente uma variante do gene ABCB11. Tem sido debatido se este polimorfismo está associado à colestase benigna recorrente e/ou progressiva intra-hepática familiar e à colestase intra-hepática da gravidez (23, 24). Além disso, outra variante comum no gene ABCB11 foi detectada em estado heterozigótico . Esta variante tem sido associada com expressão reduzida de proteínas (25) e com cirrose biliar primária (26, 27). Entretanto, ambas as variantes genéticas são muito frequentes na população em geral para serem causadoras de doenças hepáticas colestáticas (28). O sequenciamento sistemático do transcriptoma nestes casos pode identificar variantes em outras regiões das sequências genéticas ou em outros genes codificadores para outros transportadores hepáticos ou proteínas envolvidas na geração biliar, como ABCC2, ABCC3, ABCC4 e proteína de junção apertada 2 (TJP2), respectivamente (21).
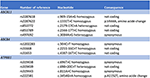
Figura 4. Análise genética molecular dos genes ABCB11, ABCB4, e ATP8B1.
Em conclusão, descrevemos um caso de lesão hepática colestática grave induzida por HDS compatível com a ingestão do chá Artemisia annua. Devem ser feitos esforços para desencorajar o uso de derivados de artemisinina na prevenção do paludismo, o que é ineficaz de acordo com as recomendações da OMS e pode, adicionalmente, causar danos. Além disso, o caso demonstra nossa ainda inadequada compreensão da fisiopatologia e suscetibilidade à HDS induzida por lesão hepática.
Data Availability Statement
Todos os conjuntos de dados para este estudo estão incluídos no manuscrito/arquivos complementares.
Ethics Statement
Não foi necessária a revisão e aprovação ética para o relato de um único caso clínico aqui, de acordo com a legislação local e requisitos institucionais. O paciente/participante forneceu seu consentimento informado por escrito para participar.
Contribuições do Autor
FR-R escreveu a primeira minuta do manuscrito. SH, CB, AL-T, MZ, e AJ escreveram seções do manuscrito. FR-R, SH, SR, MZ, KR, JB, AJ, MH, AL-T, LT e CB contribuíram para o manejo clínico do paciente, revisão do manuscrito, leitura e aprovação da versão submetida.
Conflito de Interesses
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
1. Klayman DL. Qinghaosu (artemisinina): um medicamento antimalárico da China. Ciência. (1985) 228:1049-55. doi: 10.1126/science.3887571
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Organização Mundial de Saúde. WHO Guidelines for the Treatment of Malaria, 2ª ed., OMS. (2010). Disponível online em: http://www.who.int/malaria/publications/atoz/9789241547925/en/index.html (acessado em 23 de novembro de 2018).
Google Scholar
3. SafeTravel.ch. Reismedizinische Beratung. Malariavorbeugung (Chemoprophylaxe) (2016). Disponível online em: http://www.safetravel.ch/safetravel2/servlet/ch.ofac.wv.wv204j.pages.Wv204ConseilsSanteListeCtrl?action=afficheDetail&elementCourant=1 (acedido a 23 de Novembro de 2018).
Google Scholar
4. Centros de Controle e Prevenção de Doenças. Escolhendo um Medicamento para Prevenir a Malária (2018). Disponível online em: https://www.cdc.gov/malaria/travelers/drugs.html
Google Scholar
5. Shahinas D, Lau R, Khairnar K, Hancock D, Pillai DR. Uso indevido artesanal e malária Plasmodium falciparum no viajante de regresso de África. Dis. Infecto Emergente. (2010) 16:1608-10. doi: 10.3201/eid1610.100427
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Organização Mundial de Saúde. OMS, declaração de posição. Eficácia das Formas Não-Farmacêuticas de Artemisia annua L. Contra a Malária. Genebra: Organização Mundial de Saúde (2012).
Google Scholar
7. Navarro VJ, Khan I, Björnsson E, Seeff LB, Serrano J, Hoofnagle JH. Lesão hepática por ervas e suplementos dietéticos. Hepatologia. (2017) 65:363-73. doi: 10.1002/hep.28813
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Guevart E, Aguemon A. Dois casos de hepatite fulminante durante um tratamento curativo com uma combinação artesunato-amodiaquina. Med Mal Infect. (2009) 39:57-60. doi: 10.1016/j.medmal.2008.09.024
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Centros de Controle e Prevenção de Doenças (CDC). Hepatite temporalmente associada a um suplemento herbal contendo artemisinina – Washington, 2008. Morb Mortal Wkly Rep. (2009) 58:854-6.
Google Scholar
10. Kumar S. Lesão hepática colestática secundária à artemisinina. Hepatologia. (2015) 62:973-4. doi: 10.1002/hep.27900
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Stebbings S, Beattie E, McNamara D, Hunt S. Um ensaio clínico piloto randomizado e controlado por placebo para investigar a eficácia e segurança de um extrato de Artemisia annua administrado durante 12 semanas, para o controle da dor, rigidez e limitação funcional associada à osteoartrose do quadril e do joelho. Clin Rheumatol. (2016) 35:1829-36. doi: 10.1007/s10067-015-3110-z
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Medsafe. Arthrem – Potential Risk of Harm to the Liver -Statement Under Section 98 of the Medicines Act 1981 (2018). Disponível online em: http://www.medsafe.govt.nz/safety/EWS/2018/Arthrem.asp
Google Scholar
13. National Institutes of Health, LiverTox, Clinical and Research Information on Drug-Induced Liver Injury. Derivados de Artemisinina. (2019). Disponível online em: https://livertox.nih.gov/ArtemisininDerivatives.htm
Google Scholar
14. Savage RL, Tatley MV, Barnes J. Hepatotoxicity with a Natural Dietary Supplement, Artemisia annua L. Extract in Grapeseed Oil. Relatórios do Centro de Farmacovigilância da Nova Zelândia. Segurança de Medicamentos (2018). In: 18ª Reunião Anual ISoP “Farmacovigilância sem fronteiras”. Genebra (acessado de 11 a 14 de novembro de 2018).
Google Scholar
15. Wang JB, Zhu Y, Bai ZF, Wang FS, Li XH, Xiao XH, et al. Guidelines for the Diagnosis and Management of Herb-Induced Liver Injury. Chin J Integr Med. (2018) 24:696-706. doi: 10.1007/s11655-018-3000-8
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Clarke TC, Black LI, Stussman BJ, Barnes PM, Nahin RL. Tendências no uso de abordagens de saúde complementar entre adultos: Estados Unidos, 2002-2012. Natl Health Stat Rep. (2015) 79:1-16.
Google Scholar
17. Danan G, Teschke R. RUCAM em drogas e ervas induzidas por lesões hepáticas: a atualização. Int J Mol Sci. (2015) 17:E14. doi: 10.3390/ijms17010014
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Zhang X, Zhao Y, Guo L, Qiu Z, Huang L, Qu X. Diferenças nos constituintes químicos de Artemisia annua L de diferentes regiões geográficas na China. PLoS UM. (2017) 12:e0183047. doi: 10.1371/journal.pone.0183047
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Ogwang Engeu P, Omujal F, Agwaya M, Kyakulaga H, Obua C. Variações nos componentes antimaláricos da Artemisia annua Linn de três regiões de Uganda. Afr Health Sci. (2015) 15:828-34. doi: 10.4314/ahs.v15i3.17
CrossRef Full Text | Google Scholar
20. Liu H, Zhan S, Zhang Y, Ma Y, Chen L, Chen L, et al. Análise do mecanismo de lesão hepática induzida por óleos voláteis de Artemisiae argyi folium. Complemento BMC Altern Med. (2017) 17:491. doi: 10.1186/s12906-017-1997-4
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Morgan RE, Trauner M, van Staden CJ, Lee PH, Ramachandran B, Eschenberg M, et al. A interferência com a função da bomba de exportação de sal da bílis é um fator de suscetibilidade à lesão hepática humana no desenvolvimento de drogas. Toxicol Sci. (2010) 118:485-500. doi: 10.1093/toxsci/kfq269
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Kubitz R, Dröge C, Stindt J, Weissenberger K, Häussinger D. A bomba de exportação de sal biliar (BSEP) em saúde e doença. Clin Res Hepatol Gastroenterol. (2012) 36:536-53. doi: 10.1016/j.clinre.2012.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Alissa FT, Jaffe R, Shneider BL. Atualização sobre colestase intra-hepática familiar progressiva. J Pediatra Gastroenterol Nutr. (2008) 46:241-52.21. doi: 10.1097/MPG.0b013e3181596060
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Dixon PH, Williamson C. A genética molecular da colestase intra-hepática da gravidez. Obsteto Med. (2008) 1:65-71. doi: 10.1258/om.2008.080010
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Stieger B. O papel do polipeptídeo cotransportador de sódio-taurocolato (NTCP) e da bomba de exportação de sal biliar (BSEP) na fisiologia e fisiopatologia da formação da bílis. Handb Exp Pharmacol. (2011) 201:205-59. doi: 10.1007/978-3-642-14541-4_5
CrossRef Full Text | Google Scholar
26. Pauli-Magnus C, Kerb R, Fattinger K, Lang T, Anwald B, Kullak-Ublick GA, et al. BSEP e MDR3 haplotype structure in healthy Caucasians, primary biliary cirrhosis and primary sclerosing cholangitis. Hepatologia. (2004) 39:779-91. doi: 10.1002/hep.20159
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pan S, Li X, Jiang P, Jiang Y, Shuai L, He Y, et al. Variações dos genes ABCB4 e ABCB11 estão associadas com pedras intra-hepáticas primárias. Mol Med Rep. (2015) 11:434-46. doi: 10.3892/mmr.2014.2645
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dröge C, Bonus M, Baumann U, Klindt C, Lainka E, Kathemann S, et al. O sequenciamento de FIC1, BSEP e MDR3 numa grande coorte de pacientes com colestase revelou um elevado número de diferentes variantes genéticas. J Hepatol. (2017) 67:1253-64. doi: 10.1016/j.jhep.2017.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar