1. Permeabilidade
2. Fluidez
3. Heterogeneidade
– Interior
– Exterior
– Flexibilidade, espessura
As funções da membrana celular são determinadas pela sua composição molecular. O tipo e proporção dessas moléculas definirá as características físico-químicas da membrana: semipermeabilidade, assimetria, fluidez, reparação e reciclagem.
>
Permeabilidade
Semipermeabilidade da membrana é uma consequência do ambiente hidrofóbico interno das membranas, criado pelas cadeias de ácidos graxos lipídicos, que é difícil de ser atravessado por moléculas com cargas elétricas. Assim, ao impedir a livre difusão das moléculas, as membranas podem formar compartimentos que mantêm ambientes internos e externos distintos. No entanto, a permeabilidade é seletiva. A polaridade e o tamanho são as características moleculares mais importantes que influenciam a capacidade de atravessar as membranas. Pequenas moléculas sem cargas elétricas, como CO2, N2, O2 e moléculas com alta solubilidade em gordura, como o etanol, podem atravessar membranas quase que livremente por difusão passiva (Figura 1). A permeabilidade é menor para moléculas que têm cargas elétricas quando o número de cargas positivas é igual a cargas negativas, conhecidas como moléculas não carregadas, como água e glicerol. Pode-se pensar que a água pode atravessar as membranas livremente, mas existem algumas restrições, e é por isso que algumas membranas contêm aquaporinas, um tipo de proteína transmembrana com um canal que permite que a água atravesse livremente. A capacidade de grandes moléculas não carregadas, como a glicose, de atravessar membranas é baixa. As membranas são altamente impermeáveis aos íons e às moléculas carregadas. Alguns valores para o coeficiente de permeabilidade por difusão passiva são: O2: 2,3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, glicerol: 10 -6 cm/s, sódio e potássio: 10 -14 cm/s.
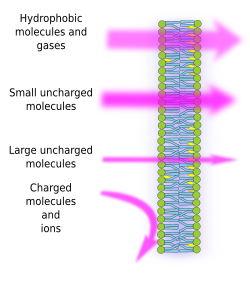
A distribuição desigual de íons e moléculas entre os dois lados de uma membrana torna possível gerar e manter gradientes eletroquímicos. A diferença entre a concentração interna e externa de cargas elétricas é conhecida como potencial de membrana. Este gradiente é utilizado para muitas funções celulares, tais como a síntese de ATP e a transmissão de informação ao longo dos nervos. A semipermeabilidade também é responsável por processos osmóticos, que são movimentos de água através das membranas, desde uma solução menos concentrada num lado até uma solução mais concentrada no outro lado, a fim de igualar ambas as concentrações. Desta forma, as células vegetais são capazes de aumentar de tamanho graças a uma maior concentração intracelular de alguns solutos que provocam a entrada de água na célula, que por sua vez produz uma pressão hidrostática interna (chamada pressão turgor) que empurra as paredes celulares para fora. As moléculas que não atravessam livremente as membranas são úteis para as células porque podem criar gradientes que podem funcionar como mecanismos de informação ou como armazéns de energia. As células têm proteínas transmembranas que permitem atravessar a membrana ou mover moléculas carregadas e íons entre os dois lados das membranas celulares, evitando o ambiente hidrofóbico da membrana interna. Por exemplo, a contração muscular é desencadeada pela abertura de canais que reduzem um gradiente iônico existente.
A semipermeabilidade é influenciada pela composição lipídica das membranas. Por exemplo, o conteúdo de colesterol é importante na membrana plasmática. Um aumento no teor de colesterol diminui a fluidez e aumenta a hidrofobicidade, ambas características que tornam a membrana mais impermeável. Assim, o aumento do colesterol acima de 30% (que é um valor alto) torna as membranas de mielina muito adequadas para isolar os axônios e otimizar a propagação do potencial de ação ao longo do axônio.
Fluidez e domínios laterais
Fluidez é uma propriedade das membranas. Está relacionada com a capacidade das moléculas de se moverem dentro das membranas. Uma maior fluidez significa que os movimentos são mais frequentes. As membranas celulares são na verdade uma folha de gordura, onde as moléculas estão em estado semi-líquido viscoso. Assim, pode-se adivinhar que as moléculas podem mover-se por difusão. Por exemplo, uma glicerofosfolipídeo localizado na monocamada externa da membrana plasmática pode ter dois tipos de movimentos: lateral, ou seja, na mesma monocamada, e flip-flop, ou seja, saltando de uma monocamada para a outra (Figura 2). Nas membranas artificiais, estes dois tipos de movimentos têm sido observados, sendo os movimentos laterais muito mais frequentes do que o flip-flop. Por difusão lateral, os lipídios podem percorrer 30 µm em 20 segundos; eles podem percorrer toda a circunferência de uma célula de tamanho médio em um minuto. Entretanto, os movimentos de flip-flop são realmente infrequentes porque a cabeça hidrofílica da molécula lipídica deve atravessar a camada interna das cadeias de ácidos graxos, e isto é termodinamicamente difícil. Para uma molécula lipídica, a probabilidade de um movimento de retorno é de cerca de uma vez por mês. No entanto, o colesterol se comporta de maneira diferente e pode ser alterado com bastante facilidade.

A fluidez da membrana pode mudar dependendo da composição química. Geralmente, cadeias mais curtas de ácidos graxos e maior quantidade de ligações insaturadas entre carbonos de ácidos graxos aumentam a fluidez da membrana. A quantidade de colesterol também influencia a fluidez da membrana, mas o efeito líquido depende da temperatura e do tipo de lipídios na membrana. O colesterol tem dois efeitos: inibe a transição para um estado sólido de gel (menos fluidez), mas também diminui a flexibilidade das cadeias de ácidos graxos insaturados. Em geral, pode-se dizer que um aumento na concentração de colesterol diminui a fluidez da membrana, embora a baixas temperaturas o efeito seja o oposto. As membranas internas da célula, como as do retículo endoplasmático, contêm muito pouco colesterol e, portanto, são mais fluidas. Além disso, o colesterol fornece às membranas outras propriedades conhecidas como hidrofobicidade, o que torna as membranas mais impermeáveis.
Diferente composição molecular entre as duas monocamadas de uma membrana, conhecida como assimetria de membrana, pode gerar uma fluidez distinta em cada monocamada. Dependendo da composição molecular, os lipídios podem estar em duas fases físicas: ordenados por líquido (menos fluidez) e ordenados por líquido (mais fluidez). A monocamada externa da membrana plasmática deve estar mais frequentemente na fase de ordenação líquida, enquanto que a monocamada interna é propensa a estar na fase de ordenação líquida.
As células podem modificar a fluidez das membranas, alterando a sua composição química. Por exemplo, as bactérias ajustam a saturação e o comprimento das cadeias de ácidos gordos para que a fluidez das membranas possa ser adaptada às condições ambientais. A variação na concentração de glicerofosfolípidos, como a fosfatidilolitanolamina, também pode modular a fluidez. Alguns insetos não conseguem sintetizar esteróis, como o colesterol, e os esteróis de suas membranas vêm dos alimentos. Eles alteram a fluidez de suas membranas celulares por diferentes concentrações de fosfatidilletanolamina.
A membrana interna da mitocôndria precisa ser uma forte barreira impermeável para criar e manter um gradiente de prótons. Isto pode ser feito por um aumento do teor de colesterol. Desta forma a hidrofobicidade é maior, mas por sua vez o colesterol diminui a fluidez, o que parece ser muito importante para o funcionamento das proteínas desta membrana. A mitocôndria resolve o problema com a cardiolipina, um fosfolipídeo insaturado que aumenta a hidrofobicidade, mas não reduz muito a fluidez da membrana.
3. Heterogeneidade
Por causa da fluidez, pode-se pensar que as proteínas estão distribuídas aleatoriamente e, portanto, as membranas são homogêneas quanto à composição molecular, ou seja, apresentam o mesmo conteúdo molecular e proporção independentemente da região da membrana. Isto não é verdade. Existem restrições à difusão lateral das moléculas que causam heterogeneidade na membrana, o que significa que existem regiões de uma membrana com composição molecular diferente. Em células não polarizadas, e em escalas maiores que 200 nm, a membrana plasmática parece homogênea, mas em escalas abaixo de 200 nm ela é heterogênea. Pensa-se que os microdomínios das membranas têm cerca de 60 µm de tamanho. Os lípidos e proteínas apresentam movimentos laterais na maioria restritos a áreas de 60-200 nm durante alguns milissegundos, e depois saltam para outra área adjacente, onde permanecem por mais um curto período de tempo. Este comportamento é chamado de difusão salina.
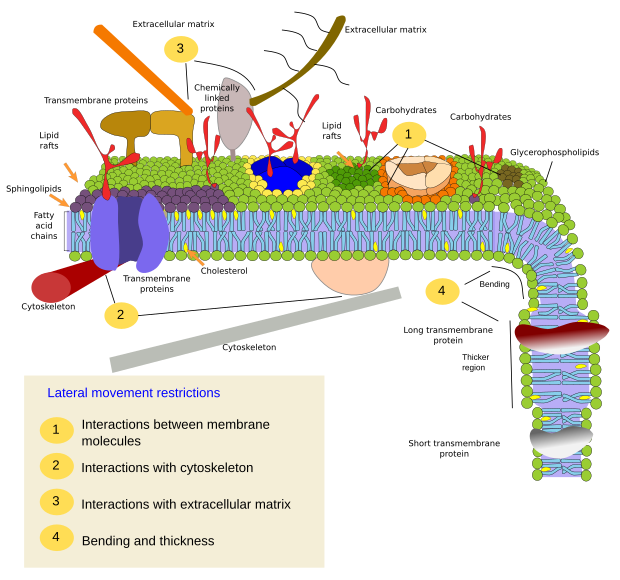
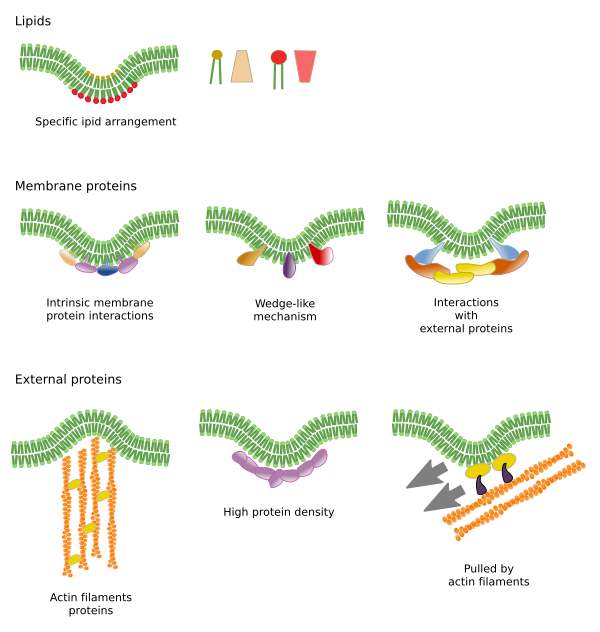
Restrições aos movimentos laterais das moléculas podem ser causadas por vários mecanismos: interações com o citoesqueleto ou matriz extracelular, interações de moléculas de membrana entre si, diferentes densidades de áreas locais de membrana (mudanças de fluidez), quantidade de cargas elétricas, curvatura da membrana e diferentes espessuras de domínios de membrana (Figura 3).
Interacções internas
Interacções das moléculas da membrana entre si que restringem o movimento lateral. Ambos, proteínas e movimentos lipídicos são influenciados por essas interações levando à formação de microdomínios com composição molecular diferencial (Figura 4). O resultado é a distribuição heterogênea lateral das moléculas nas membranas. Dependendo das proporções moleculares, os microdomínios lipídicos podem ter densidade diferente (isto é, fluidez): sólidos, líquidos ordenados e líquidos desordenados. A densidade mais comum é a desordenada líquida, que é a mais fluida.
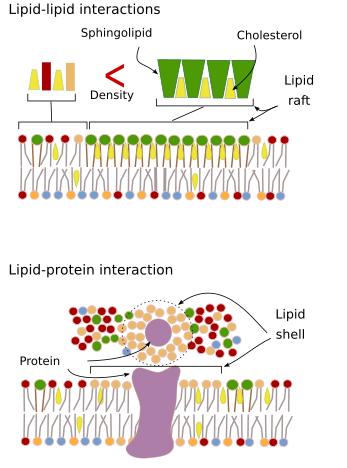
Esfingolipídios e colesterol podem se associar espontaneamente entre si, reduzindo sua motilidade e aumentando a densidade molecular quando comparados a áreas vizinhas. Um pequeno grupo distinto de moléculas é formado como uma jangada em um mar de lipídios. Na verdade, essas associações moleculares são conhecidas como jangadas de lipídios, e são consideradas muito abundantes e em membranas celulares. As jangadas lipídicas apresentam um comportamento altamente dinâmico, podem mover-se, crescer, diminuir, aparecer e desaparecer. De facto, as membranas são constituídas por muitos domínios densos que viajam lateralmente entre os glicerofosfolípidos, de modo que as membranas são bastante heterogéneas no que diz respeito à sua distribuição molecular. Alguns experimentos sugerem que certos tipos de proteínas “sentem-se” mais confortáveis dentro das jangadas lipídicas. Essas proteínas passam mais tempo dentro do que fora das jangadas lipídicas, assim elas viajam por algum tempo dentro dessas densidades. Isto causa uma segregação de moléculas ao longo da membrana, e aumenta a probabilidade das diferentes moléculas estarem mais próximas umas das outras do que apenas por acaso (difusão), aumentando desta forma a probabilidade de certas reacções moleculares. Além disso, sugere-se que uma alta concentração de certos tipos de lipídios nas jangadas lipídicas cria um ambiente químico distinto que facilita algumas reações químicas ou interações moleculares. As jangadas lipídicas têm sido propostas para estarem presentes na monocamada externa da membrana plasmática porque é neste lado que os esfingolipídios são abundantes. Os domínios de membrana têm sido sugeridos também nas membranas das organelas, e pensa-se que algumas de suas funções dependem destes domínios de membrana.
Na monocamada interna da membrana plasmática, os microdomínios são formados por interações eletrostáticas entre domínios citosólicos básicos ou domínios catiônicos divalentes de proteínas e as cabeças polares negativas de lipídios. Outro exemplo menos conhecido é a associação entre o bisfosfato fosfatidilinositol e o colesterol que forma microdomínios nesta monocamada. Estes microdomínios que enfrentam o citosol podem influenciar os andaimes proteicos intracelulares.
Tradicionalmente, pensa-se que não existem interacções entre ambas as monocamadas de membranas e que estas distribuem os seus microdomínios de forma independente. Entretanto, evidências sugerem que existem interações entre si. As proteínas transmembranas afetam simultaneamente as duas monoamantas, já que elas atravessam a membrana inteira. Outra forma de sincronização entre as duas monocamadas pode ser mediada pelas longas cadeias de ácidos graxos, como alguns esfingolipis que podem ter 24 carbonos de comprimento (o comprimento normal é 18). Essas cadeias longas podem ser inseridas entre as cadeias de ácidos graxos dos lipídios das outras monocamadas e influenciar a distribuição lipídica. Além disso, considera-se que os domínios lipídicos com cadeias longas de ácidos graxos são contrabalançados por microdomínios lipídicos de cadeias curtas de ácidos graxos na outra monocamada, mantendo constante a espessura da membrana.
Proteínas de membrana, tanto integrais como associadas, também podem interagir entre si e se montar em andaimes macromoleculares para facilitar a transmissão de informação, o reconhecimento de células, iniciar algumas atividades enzimáticas e o movimento celular. Existem também proteínas multiméricas activas apenas quando todas as subunidades se mantêm unidas. Por exemplo, o receptor de insulina é composto por quatro subunidades. Proteínas e lipídios também podem interagir para formar domínios de membrana. Por exemplo, na monocamada interna, o fosfatidilinositol se associa em torno das proteínas por interações elétricas, que podem ser reguladas modificando os fosfatos da cabeça polar dos lipídios.
Interacções com elementos exteriores
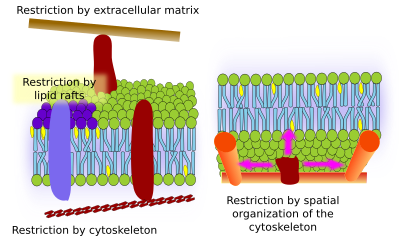
As proteínas da membrana íntegral também podem ter movimentos laterais, mas são mais restritas que os lipídios, principalmente devido às interações com a matriz extracelular e o citoesqueleto através de seus domínios extracelulares e intracelulares, respectivamente (Figura 5). Essas interações podem manter proteínas em pequenas áreas da membrana durante mais tempo do que apenas por difusão. O citoesqueleto pode formar cercas logo abaixo da membrana plasmática que mantêm as proteínas restritas em pequenas áreas. Filamentos de actina e microtubos podem envolver pequenas áreas que limitam a difusão de proteínas e lipídios. As interações com o citoesqueleto são importantes porque se o citoesqueleto estiver experimentalmente desorganizado, a membrana se torna muito mais homogênea. As células têm outros mecanismos para confinar as proteínas a domínios específicos. Por exemplo, as células epiteliais intestinais têm alguns transportadores e enzimas localizados na membrana plasmática apical, mas não no domínio baso-lateral devido a uma cinta de junções apertadas, um zíper molecular que impede a difusão entre os domínios apical e baso-lateral. Tal distribuição assimétrica é essencial para a fisiologia da célula epitelial.
Flexão da membrana é outra forma de criar microdomínios. Uma curvatura da membrana pode ser o ponto de partida para formar uma vesícula, uma extensão do citoplasma para a expansão celular, uma mudança de forma ou crescimento de uma organela, ou apenas para iniciar uma barreira para restringir o movimento lateral das moléculas. Esta é uma restrição física pela disposição 3D dos lipídios no menor ângulo da dobra da membrana.
As ferramentas moleculares necessárias para dobrar uma membrana são recrutadas para regiões específicas da membrana. Estes microdomínios podem ter composição lipídica específica ou um determinado ambiente de carga elétrica. Fosfinoinossitidos (PIPs), principalmente o PIP2 e PIP3, são lipídios que contribuem para o recrutamento de proteínas para dobrar a membrana. São moléculas úteis porque a carga elétrica e a estrutura molecular de suas cabeças polares podem ser facilmente modificadas por reações químicas. Desta forma, as propriedades de uma determinada região da membrana podem mudar quando necessário e recrutar proteínas específicas. A fosfatidilserina também é capaz de iniciar um microdomínio de flexão da membrana quando é translocada de uma monocamada para a outra por flipasases.
Bending and thicknes
Lipid microdomains recruta proteínas que efetivamente dobram a membrana. Existem proteínas especializadas neste papel (Figura 6). As proteínas de domínio BAR (Bin/amphyphysin/Rsv161) são uma delas. A dobra pode ser induzida por dois mecanismos: a montagem de um andaime curvo de proteínas que puxam ou empurram a membrana, e a inserção de sequências de aminoácidos entre os lípidos como uma cunha. Por exemplo, as caveolinas causam a curvatura da membrana para formar caveloae, as membranas tetraspain forçam a formação de túbulos, o ESCRT ajuda na formação de vesículas dentro dos endossomas para formar corpos multivesiculares. A actina é um forte agente de flexão da membrana através da polimerização do filamento de actina que empurra a membrana plasmática para fora levando a expansões celulares. Muitas proteínas que podem curvar a membrana plasmática também ativam a polimerização da actina.
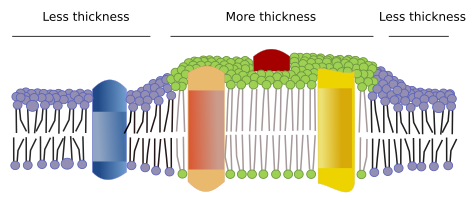
Existem outros domínios nas membranas, domínios físicos, formados por moléculas como as proteínas transmembranas. Estas áreas apresentam diferentes espessuras de membranas porque contêm proteínas com sequências mais longas de aminoácidos hidrofóbicos que ficam rodeadas por lípidos com cadeias mais longas de ácidos gordos (Figura 7). Estas proteínas e lipídios “sentem-se” mais confortáveis quando estão juntos, uma vez que encaixam adequadamente nas suas partes hidrofóbicas. Eles formam domínios de membrana que excluem outras moléculas, sejam proteínas ou lipídios, com regiões hidrofóbicas mais curtas.
Bibliografía
Honigmann A, Pralle A. (2016). Compartimentação da membrana da célula. Journal of mollecular biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Curvatura da membrana em biologia celular: uma integração de mecanismos moleculares. Diário de biologia celular. 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). Colesterol alto/colesterol baixo: efeitos nas membranas biológicas: uma revisão Bioquímica celular e biohísico. https://doi.org/10.1007/s12013-017-0792-7.