Óxido de lítio Propriedades Químicas,Usos,Produção
Propriedades Químicas
Óxido de lítio (Li2O) é um dos mais simples óxidos iônicos e é isoeletrônico a H2O. Dois átomos de lítio darão cada um um elétron ao átomo de oxigênio. forma a ligação iônica entre o lítio e o oxigênio. A fórmula para o óxido de lítio é Li2O.
O óxido de lítio é muito corrosivo. Ele reage com água para fazer o hidróxido de lítio. É tóxico devido à sua forte alcalinidade (sendo uma base).
É uma fonte de lítio altamente insolúvel e estável termicamente, adequada para aplicações em vidro, óptica e cerâmica. O óxido de lítio é um sólido branco também conhecido como lítio, é produzido quando o lítio metálico queima na presença de oxigênio. Os compostos de óxido não são condutores de eletricidade. No entanto, certos óxidos estruturados de perovskite são aplicados eletronicamente no cátodo das células combustíveis de óxido sólido e nos sistemas de geração de oxigênio. São compostos contendo pelo menos um ânion de oxigênio e um cátion metálico.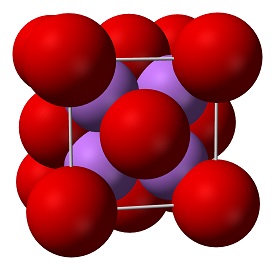
Oxido de lítio é usado como fluxo em esmaltes cerâmicos; e cria azuis com cobre e pinks com cobalto. O óxido de lítio reage com água e vapor, formando hidróxido de lítio e deve ser isolado dos mesmos. Seu uso também está sendo investigado para avaliação não destrutiva de espectroscopia de emissão e monitoramento da degradação dentro de sistemas de revestimento de barreira térmica. Pode ser adicionado como co-dopante com ítria na camada superior de cerâmica de zircônia, sem uma grande diminuição da vida útil esperada do revestimento.
Usos
Não há usos industriais atuais que consumam grandes quantidades de óxido de lítio.
O óxido de lítio é usado como fluxo em esmaltes cerâmicos; e cria azuis com cobre e pinks com cobalto. O óxido de lítio reage com água e vapor, formando hidróxido de lítio e deve ser isolado dos mesmos. Seu uso também está sendo investigado para avaliação não destrutiva de espectroscopia de emissão e monitoramento da degradação dentro de sistemas de revestimento de barreira térmica. Pode ser adicionado como co-dopante com ítria na camada superior de cerâmica de zircônia, sem uma grande diminuição na vida útil esperada do revestimento.
Reacções
Oxido de lítio reage com água ao dissolver-se para formar uma solução de hidróxido de lítio.
Oxido de lítio é uma base forte e reage tipicamente com gases ácidos e líquidos para formar sais de lítio. A temperaturas elevadas, o óxido de lítio também reage com muitos óxidos sólidos não metálicos (SiO2, B2O3, etc.) e óxidos metálicos (A12O3, Fe2O3, etc.). As reacções a altas temperaturas são a base para a acção de fluxo do óxido de lítio, hidróxido de lítio e carbonato de lítio. Deve-se ter cuidado para evitar a reacção do óxido de lítio com os vasos de reacção a altas temperaturas.
Preparação
Oxido de lítio é preparado aquecendo o lítio metálico em oxigênio seco acima de 100°C:
4Li + O2→2Li2O
Outro método de preparação que produz óxido de lítio puro envolve a decomposição térmica do peróxido de lítio:
2Li2O2→2Li2O + O2
Também, o óxido pode ser produzido aquecendo o hidróxido de lítio puro a 800°C em vácuo:
2LiOH→Li2O + H2O
Perigo para a saúde
O melhor do nosso conhecimento, as propriedades químicas, físicas e toxicológicas do óxido de lítio não foram investigadas e relatadas exaustivamente.
A toxicidade dos compostos de lítio é uma função da sua solubilidade na água. O íon de lítio tem toxicidade no sistema nervoso central. Os efeitos iniciais da exposição ao lítio são tremores das mãos, náuseas, mictuas, fala arrastada, lentidão, sonolência, vertigem, sede, e aumento do volume de urina. Os efeitos da exposição contínua são a apatia, anorexia, fadiga, letargia, fraqueza muscular e alterações no ecg. A exposição prolongada leva ao hipotiroidismo, leucocitose, edema, ganho de peso, polidipsia/polúria (aumento da ingestão de água levando a um aumento do débito urinário), diminuição da memória, convulsões, danos renais, choque, hipotensão, arritmias cardíacas, coma, morte.
Propriedades Químicas
pó(s) branco(s) finamente dividido(s) ou material crostoso; absorve prontamente CO2 e H2O da atmosfera; feito por aquecimento de LiOH a ~800°C em vácuo ou por decomposição térmica de peróxido de lítio; usado em cerâmicas e formulações especiais de vidro e em baterias térmicas de lítio
Usos
Óxido de lítio é um álcali forte que absorve dióxido de carbono e água da atmosfera. É utilizado na fabricação de cerâmicas e tipos especiais de vidro.
Usos
Cerâmica e formulações especiais de vidro, absorvente de dióxido de carbono
Preparação
Preparações industriais e laboratoriais. Apenas pequenos volumes de material são preparados industrialmente. Tanto as preparações industriais como laboratoriais requerem a decomposição térmica do peróxido de lítio ou do hidróxido de lítio.
Peróxido de lítio, Li202 , é convertido em óxido de lítio, Li20, e oxigênio por aquecimento a 450° em um fluxo de gás hélio.
Desidratação térmica do hidróxido de lítio é realizada a 675°C±10° sob vacuum, um recipiente de níquel revestido com folha de prata.
Carbonato de lítio pode ser convertido em óxido de lítio e dióxido de carbono através do aquecimento do material a 700°C sob vácuo em um barco de platina.
Usos industriais. Não existem usos industriais actuais que consumam grandes quantidades de óxido de lítio.
Oxido de lítio reage com água à medida que se dissolve para formar uma solução de hidróxido de lítio.O óxido de lítio é uma base forte e reage tipicamente com gases ácidos e líquidos para formar sais de lítio. A temperaturas elevadas, o óxido de lítio também reage com muitos nonmetalóxidos sólidos (Si02, B2O3, etc.) e óxidos metálicos (A1203 , Fe2C>3, etc.). As reacções a altas temperaturas são a base da acção de fluxo do óxido de lítio, do hidróxido de lítio e do carbonato de lítio. Deve-se ter o cuidado de evitar a reação do óxido de lítio com vasos de reação a altas temperaturas.