Generischer Name: Proparacainhydrochlorid
Darreichungsform: ophthalmische Lösung
Medizinisch geprüft von Drugs.com. Zuletzt aktualisiert am 1. Oktober 2020.
- Übersicht
- Nebenwirkungen
- Berufliche
- Interaktionen
- Mehr
Ophthalmische Lösung, USP
0.5% Steril
Nur Rx
BESCHREIBUNG:
Proparacainhydrochlorid-Augenlösung USP, 0,5% ist ein Lokalanästhetikum zur Instillation in die Augen. Jeder mL der sterilen, wässrigen Lösung enthält: Aktiv: Proparacainhydrochlorid 5 mg (0,5 %). Unwirksame Bestandteile: Glycerin als Stabilisator, Salzsäure und/oder Natriumhydroxid können zur Einstellung des pH-Werts (3,5 bis 6,0) zugesetzt werden, sowie Wasser für Injektionszwecke. Konservierungsmittel: Benzalkoniumchlorid 0,1 mg (0,01 %).
Proparacainhydrochlorid ist chemisch als 2-(Diethylamino)ethyl-3-amino-4-propoxybenzoat-Monohydrochlorid konzipiert. Der Wirkstoff hat die Strukturformel:
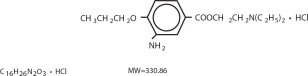
KLINISCHE PHARMAKOLOGIE:
Proparacainhydrochlorid-Augenlösung ist ein schnell wirkendes Lokalanästhetikum, das für die Anwendung in der Augenheilkunde geeignet ist. Mit einem einzigen Tropfen beginnt die Anästhesie innerhalb von 30 Sekunden und hält 15 Minuten oder länger an.
Der Hauptwirkungsort des Anästhetikums ist die Nervenzellmembran, wo Proparacain den großen vorübergehenden Anstieg der Membrandurchlässigkeit für Natriumionen stört, der normalerweise durch eine leichte Depolarisation der Membran hervorgerufen wird. Wenn sich die Wirkung des Anästhetikums in einem Nerv allmählich entfaltet, steigt die Schwelle für die elektrische Stimulation allmählich an und der Sicherheitsfaktor für die Reizleitung nimmt ab; wenn diese Wirkung hinreichend ausgeprägt ist, kommt es zu einer Blockade der Reizleitung.
Der genaue Mechanismus, durch den Proparacain und andere Lokalanästhetika die Permeabilität der Zellmembran beeinflussen, ist unbekannt; mehrere Studien deuten jedoch darauf hin, dass Lokalanästhetika die Permeabilität für Natriumionen einschränken können, indem sie die Poren, durch die die Ionen in der Lipidschicht der Nervenzellmembran wandern, schließen. Diese Einschränkung verhindert die grundlegende Veränderung, die für die Erzeugung des Aktionspotentials notwendig ist.
ANWENDUNGEN UND EINSATZBEREICHE:
Proparacainhydrochlorid-Augenlösung ist für die topische Anästhesie in der Augenheilkunde angezeigt. Zu den repräsentativen ophthalmologischen Verfahren, bei denen das Präparat eine gute lokale Anästhesie bietet, gehören die Messung des Augeninnendrucks (Tonometrie), die Entfernung von Fremdkörpern und Fäden aus der Hornhaut, das Ausschaben der Bindehaut bei der Diagnose und die gonioskopische Untersuchung; es ist auch für die Verwendung als topisches Anästhetikum vor chirurgischen Eingriffen wie der Kataraktextraktion angezeigt.
KONTRAINDIZIERUNGEN:
Dieses Präparat ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegen einen Bestandteil der Lösung.
Hinweise:
NICHT ZUR INJEKTION. NUR ZUR TOPISCHEN OPHTHALMISCHEN VERWENDUNG.
Bei längerer Anwendung eines topischen Augenanästhetikums kann es zu einer dauerhaften Hornhauttrübung mit einhergehendem Sehverlust kommen.
VORSICHTSMASSNAHMEN:
Allgemein
Proparacain sollte bei Patienten mit bekannten Allergien, Herzerkrankungen oder Schilddrüsenüberfunktion vorsichtig und sparsam verwendet werden. Die Langzeittoxizität von Proparacain ist nicht bekannt; bei längerer Anwendung kann sich die Wundheilung möglicherweise verzögern. Obwohl bei der ophthalmischen Anwendung von Lokalanästhetika äußerst selten, sollte bedacht werden, dass eine systemische Toxizität (die sich durch eine Stimulation des zentralen Nervensystems mit anschließender Depression äußert) auftreten kann.
Der Schutz des Auges vor reizenden Chemikalien, Fremdkörpern und Reibung während der Anästhesie ist sehr wichtig. Tonometer, die in sterilisierenden oder reinigenden Lösungen getränkt sind, sollten vor dem Gebrauch gründlich mit sterilem destilliertem Wasser gespült werden. Die Patienten sollten darauf hingewiesen werden, das Auge nicht zu berühren, bis die Anästhesie abgeklungen ist. Berühren Sie mit der Tropferspitze keine Oberfläche, da dies die Lösung verunreinigen kann.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Langzeitstudien an Tieren wurden nicht durchgeführt, um das karzinogene Potenzial, die Mutagenität oder eine mögliche Beeinträchtigung der Fruchtbarkeit bei männlichen oder weiblichen Tieren zu bewerten.
Schwangerschaft: Teratogene Wirkungen
Kategorie C
Fortpflanzungsstudien an Tieren wurden mit Proparacainhydrochlorid Augenlösung nicht durchgeführt. Es ist auch nicht bekannt, ob Proparacainhydrochlorid bei der Verabreichung an eine schwangere Frau den Fötus schädigen oder die Fortpflanzungsfähigkeit beeinträchtigen kann. Proparacainhydrochlorid sollte einer schwangeren Frau nur bei eindeutiger Notwendigkeit verabreicht werden.
Stillende Mütter
Es ist nicht bekannt, ob dieses Arzneimittel in die menschliche Milch ausgeschieden wird. Da viele Arzneimittel in die Muttermilch ausgeschieden werden, ist Vorsicht geboten, wenn Proparacainhydrochlorid einer stillenden Frau verabreicht wird.
Anwendung bei Kindern
Kontrollierte klinische Studien wurden mit Proparacainhydrochlorid-Augenlösung nicht durchgeführt, um die Sicherheit und Wirksamkeit bei pädiatrischen Patienten festzustellen; in der Literatur wird jedoch die Verwendung von Proparacainhydrochlorid als topisches Augenanästhetikum bei pädiatrischen Patienten erwähnt.
UNERWÜNSCHTE REAKTIONEN:
Eine Pupillenerweiterung oder zykloplegische Effekte wurden bei Proparacainhydrochlorid selten beobachtet. Das Arzneimittel scheint für die Anwendung bei Patienten, die empfindlich auf andere Lokalanästhetika reagieren, sicher zu sein, aber es kommt gelegentlich zu einer lokalen oder systemischen Empfindlichkeit. Die Instillation von Proparacain in das Auge in der empfohlenen Konzentration und Dosierung führt in der Regel zu keiner oder nur geringer anfänglicher Reizung, Stechen, Brennen, Bindehautrötung, Tränenfluss oder verstärktem Zwinkern. In seltenen Fällen kann eine schwere, sofortige, scheinbar hyperallergische Hornhautreaktion auftreten, die eine akute, intensive und diffuse Epithelkeratitis, ein graues, glasiges Erscheinungsbild, die Ablösung großer Bereiche des nekrotischen Epithels, Hornhautfäden und manchmal eine Iritis mit Descemetitis umfasst.
Eine allergische Kontaktdermatitis mit Austrocknung und Rissbildung der Fingerspitzen wurde berichtet.
Eine Erweichung und Erosion des Hornhautepithels sowie eine Stauung und Blutung der Bindehaut wurden berichtet.
DOSIERUNG UND ANWENDUNG:
Tiefgehende Anästhesie wie bei der Kataraktextraktion:
Alle 5 bis 10 Minuten 1 Tropfen in das Auge einträufeln, 5 bis 7 Dosen lang.
Entfernen von Fäden:
2 bis 3 Minuten vor dem Entfernen der Fäden 1 oder 2 Tropfen in das Auge geben.
Entfernen von Fremdkörpern:
Vor der Operation 1 oder 2 Tropfen in das Auge geben.
Tonometrie:
Unmittelbar vor der Messung 1 oder 2 Tropfen ins Auge träufeln.
VERSORGUNGSWEISE:
Proparacainhydrochlorid-Augenlösung USP, 0,5% wird als sterile Lösung in 15-mL-Kunststofftropfflaschen geliefert – NDC 13985-611-15
Lagerung:
Kühl lagern bei 2° bis 8°C (36° bis 46°F). Flasche fest verschlossen halten. Bis zur Entleerung im Karton aufbewahren, um sie vor Licht zu schützen. Wenn die Lösung mehr als eine schwache gelbe Farbe aufweist, sollte sie nicht verwendet werden.
WARNUNG – HALTEN SIE DIESES UND ALLE ANDEREN ARZNEIMITTEL AUS DER REICHWEITE VON KINDERN.
apexa™
Hergestellt von: Akorn Inc.
Lake Forest, IL 60045
Vertrieben durch: MWI
Boise, ID 83705
MWPR00N Rev. 08/14
Hauptanzeigetafeltext für Behälteretikett:
NDC 13985-611-15
Proparacainhydrochlorid
Ophthalmische Lösung, USP 0.5%
NUR ZUR TOPISCHEN
OPHTHALMISCHEN ANWENDUNG.
NICHT ZUR INJEKTION.
Apexa Logo STERILE
Nur Rx
AP 704013 15 mL

Hauptanzeigetafeltext für Kartonetikett:
NDC 13985-611-15
Proparacain
Hydrochlorid
Ophthalmic
Lösung
USP, 0.5%
NUR ZUR TOPISCHEN
OPHTHALMOLOGISCHEN ANWENDUNG.
NICHT ZUR INJEKTION.
STERILE
Nur Rx
Apexa-Logo
AP 704013 15 mL
| Proparacain HYDROCHLORID Proparacainhydrochlorid Lösung/Tropfen |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Labeler -. MWI (019926120)
Registrant – Akorn Operating Company LLC (117693100)
| Einrichtung | |||
| Name | Adresse | ID/FEI | Operations |
| Akorn, Inc | 117696790 | PACK(13985-611), LABEL(13985-611) | |
| Establishment | |||
| Name | Adresse | ID/FEI | Operations |
| Akorn, Inc. | 117696832 | HERSTELLUNG(13985-611), ANALYSE(13985-611), STERILISATION(13985-611) | |