Lithium oxide Chemische eigenschappen, toepassingen, productie
Chemische eigenschappen
Lithium oxide (Li2O) is een van de eenvoudigste ionische oxiden en het isoelectronisch aan H2O. Twee lithiumatomen geven elk een elektron aan het zuurstofatoom. vormt de ionische binding tussen lithium en zuurstof. De formule voor lithiumoxide is Li2O.
Lithiumoxide is zeer corrosief. Het reageert met water tot lithiumhydroxide. Het is giftig vanwege zijn sterke alkaliteit (het is een base).
Het is een zeer onoplosbare thermisch stabiele lithiumbron die geschikt is voor glas-, optische en keramische toepassingen. Lithiumoxide is een witte vaste stof die ook lithiumoxide wordt genoemd en ontstaat wanneer lithiummetaal in aanwezigheid van zuurstof verbrandt. Oxideverbindingen zijn niet geleidend voor elektriciteit. Bepaalde perovskiet gestructureerde oxiden zijn echter elektrisch geleidend en vinden toepassing in de kathode van vaste oxide brandstofcellen en systemen voor het opwekken van zuurstof. Het zijn verbindingen die ten minste één zuurstofanion en één metallisch kation bevatten.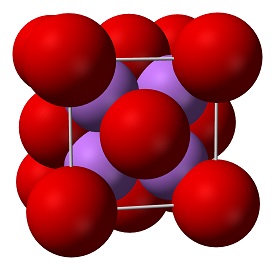
Lithiumoxide wordt gebruikt als vloeimiddel in keramisch glazuur; en creëert blauw met koper en roze met kobalt. Lithiumoxide reageert met water en stoom, waarbij lithiumhydroxide wordt gevormd, en moet daaruit worden geïsoleerd. Het gebruik ervan wordt ook onderzocht voor niet-destructieve emissiespectroscopie-evaluatie en degradatiebewaking binnen thermische barrière-coatingsystemen. Het kan worden toegevoegd als co-dopant met yttrium in de toplaag van zirkoniumkeramiek, zonder dat de verwachte levensduur van de coating sterk afneemt.
Toepassingen
Er zijn geen huidige industriële toepassingen waarbij grote hoeveelheden lithiumoxide worden verbruikt.
Lithiumoxide wordt gebruikt als vloeimiddel in keramische glazuren; en creëert blauw met koper en roze met kobalt. Lithiumoxide reageert met water en stoom, waarbij lithiumhydroxide wordt gevormd, en moet daaruit worden geïsoleerd.Het gebruik ervan wordt ook onderzocht voor niet-destructieve emissiespectroscopie-evaluatie en degradatiebewaking binnen thermische barrière-coatsystemen. Het kan worden toegevoegd als co-dopant met yttrium in de toplaag van zirkoniumkeramiek, zonder dat de verwachte levensduur van de coating sterk afneemt.
Reacties
Lithiumoxide reageert met water wanneer het oplost om een oplossing van lithiumhydroxide te vormen.
Lithiumoxide is een sterke base en reageert typisch met zure gassen en vloeistoffen om lithiumzouten te vormen. Bij hoge temperaturen reageert lithiumoxide ook met veel vaste niet-metaaloxiden (SiO2, B2O3, enz.) en metaaloxiden (A12O3, Fe2O3, enz.). Reacties bij hoge temperatuur liggen aan de basis van de fluxerende werking van lithiumoxide, lithiumhydroxide en lithiumcarbonaat. Voorzichtigheid is geboden bij het vermijden van de reactie van lithiumoxide met reactievaten bij hoge temperaturen.
Bereiding
Lithiumoxide wordt bereid door lithiummetaal in droge zuurstof boven 100°C te verhitten:
4Li + O2→2Li2O
Een andere bereidingswijze die zuiver lithiumoxide oplevert, is de thermische ontleding van lithiumperoxide:
2Li2O2→2Li2O + O2
Ook kan het oxide worden geproduceerd door zuiver lithiumhydroxide bij 800°C in vacuüm te verhitten:
2LiOH→Li2O + H2O
Gezondheidsrisico
Voor zover wij weten zijn de chemische, fysische en toxicologische eigenschappen van lithiumoxide niet grondig onderzocht en gerapporteerd.
De toxiciteit van lithiumverbindingen is een functie van hun oplosbaarheid in water. Lithiumion heeft een toxiciteit voor het centrale zenuwstelsel. De eerste effecten van blootstelling aan lithium zijn tremoren van de handen, misselijkheid, mictie, onduidelijke spraak, sloomheid, slaperigheid, duizeligheid, dorst, en verhoogd urinevolume. Effecten van voortgezette blootstelling zijn apathie, anorexia, vermoeidheid, lethargie, spierzwakte, en veranderingen in het ecg. Langdurige blootstelling leidt tot hypothyreoïdie, leukocytose, oedeem, gewichtstoename, polydipsie/polyurie (verhoogde wateropname leidt tot verhoogde urineproductie), geheugenstoornis, toevallen, nierbeschadiging, shock, hypotensie, hartritmestoornissen, coma, dood.
Chemische eigenschappen
fijn verdeeld wit poeder(tje) of korstig materiaal; absorbeert gemakkelijk CO2 en H2O uit de atmosfeer; gemaakt door LiOH te verhitten tot ~800°C in een vacuüm of door thermische ontleding van lithiumperoxide; gebruikt in keramiek en speciale glasformules en in lithiumthermische batterijen
Toepassingen
Lithiumoxide is een sterke alkali die koolstofdioxide en water uit de atmosfeer absorbeert. Het wordt gebruikt bij de fabricage van keramiek en speciale glassoorten.
Toepassingen
Keramiek en speciale glasformuleringen, kooldioxide-absorberend
Preparatie
Industriële en laboratoriumbereidingen. Slechts kleine hoeveelheden materiaal worden industrieel bereid. Zowel voor industriële als laboratoriumbereidingen is de thermische ontleding van lithiumperoxide of lithiumhydroxide nodig.
Lithiumperoxide, Li202 , wordt omgezet in lithiumoxide, Li20, en zuurstof door verhitting tot 450° in een stroom heliumgas.
Thermische dehydratie van lithiumhydroxide wordt uitgevoerd bij 675°C±10° onder vacuüm in een nikkel vat bekleed met zilverfolie.
Lithiumcarbonaat kan worden omgezet in lithiumoxide en koolstofdioxide door het materiaal te verhitten tot 700°C onder vacuüm in een platina boot.
Industriële toepassingen. Er zijn geen huidige industriële toepassingen die grote hoeveelheden lithiumoxide verbruiken.
Lithiumoxide reageert met water als het oplost om een oplossing van lithiumhydroxide te vormen.Lithiumoxide is een sterke base en reageert typisch met zure gassen en vloeistoffen om lithiumzouten te vormen. Bij hoge temperaturen reageert lithiumoxide ook met veel vaste niet-metaaloxiden (Si02, B2O3, enz.) en metaaloxiden (A1203 , Fe2C>3, enz.). Hoge-temperatuurreacties liggen aan de basis van de fluxerende werking van lithiumoxide, lithiumhydroxide en lithiumcarbonaat. Voorzichtigheid is geboden bij het vermijden van de reactie van lithiumoxide met reactievaten bij hoge temperaturen.