Background
Artemisia annua is een Chinees geneeskrachtig kruid (ook bekend als “qing hao” of “sweet wormwood”) met bewezen anti-malaria activiteit (1). Combinatietherapieën op basis van artemisinine-derivaten (ACT’s) worden door de Wereldgezondheidsorganisatie (WHO) aanbevolen voor de behandeling van ongecompliceerde malaria in combinatie met doeltreffende middelen tegen malaria (2). Chemoprofylaxe voor reizigers hangt af van de malaria-endemische reisbestemming en omvat een combinatie vanatovaquon/proguanil, chloroquine, doxycycline, mefloquine, of primaquine (3, 4). Er zijn gevallen beschreven van malaria-infectie onder artemisininederivatenchemoprofylaxe (5) en de WHO beveelt het gebruik van A. annua plantmateriaal, in welke vorm dan ook, inclusief thee, voor de behandeling of preventie van malaria niet aan (6).
Herbal- en voedingssupplementen (HDS) worden wereldwijd steeds meer gebruikt en HDS-geïnduceerde leverschade wordt een steeds groter probleem (7). Ondanks het uitgebreide gebruik van ACT’s in malaria-endemische gebieden, is leverschade door artemisinine-derivaten zeldzaam (8, 9). Kumar meldde een geval van een patiënt die een cholestatische leverschade ontwikkelde 6 weken na het oraal innemen van een artemisinine bevattend kruidensupplement voor algemeen gezondheidsonderhoud (10). Er zijn een paar andere publicaties over door Artemisia annua veroorzaakte leverschade (9, 11-14). Een klinische richtlijn voor het evalueren van de causaliteit en het stellen van de diagnose van door kruiden veroorzaakte leverschade is onlangs voorgesteld door de Chinese Vereniging voor Chinese Geneeskunde (15). Wij presenteren een geval van een acute cholestatische hepatitis als gevolg van de inname van Artemisia thee als chemoprofylaxe bij een patiënt die terugkeerde uit Ethiopië.
Case Report
Een 51-jarige man meldde zich bij de spoedeisende hulp van het Universitair Ziekenhuis van Bazel, Zwitserland met malaise, abdominaal ongemak, drijvende gele ontlasting, geelzucht en cholurie die 4 dagen aanhield en een gewichtsverlies van 6-8 kg gedurende de laatste 6 weken. Hij was 3 weken voordat hij medische hulp zocht teruggekeerd van een 4 weken durende reis naar Ethiopië. Tijdens zijn verblijf in Ethiopië nam hij dagelijks 1,25 g Artemisia annua-poeder-thee als chemoprofylaxe tegen malaria. In ongeveer 90% van de gevallen verdunde hij het poeder in kokend water, in de overige 10% werd het poeder gemengd met voedsel ingenomen. Het supplement was via internet gekocht. De patiënt gaf ons de container, die oorspronkelijk 50 g van een donkergroen poeder had bevat (figuur 1). Op het moment van de presentatie zat er nog 2 g in de verpakking, wat erop wijst dat hij in totaal 48 g had geconsumeerd. Voor zover wij weten, is er geen beschreven hepatotoxiciteit in verband met deze stoffen. Hij ontkende andere geneesmiddelen op recept, vrij verkrijgbare geneesmiddelen of kruidengeneesmiddelen te gebruiken. Hij had geen voorgeschiedenis of familiegeschiedenis van leverziekte, alcohol- of drugsmisbruik, of risicofactoren voor virale hepatitis. Hij meldde dat zijn vrouw, die hem vergezelde op zijn reis naar Ethiopië, ook Artemesia annua thee had gedronken voor malaria profylaxe. Zij bleef de hele tijd gezond.

Figuur 1. Artemisia annua poederthee.
Afgezien van duidelijke geelzucht, was zijn algemene toestand goed en had hij onopvallende vitale functies (afebrile met normale bloeddruk, hartslag en ademhalingsfrequentie).
Laboratoriumonderzoek toonde aan: alanine aminotransferase (ALAT) 91 U/L (normaal, 9-59); aspartaat aminotransferase (ASAT) 42 U/L (normaal, 9-34); alkalische fosfatase (ALP) 151 U/L (normaal, 40-130); gamma-glutamyl transferase (GGT) 416 U/L (normaal, 12-68); totaal bilirubine 186.6 μmol/L (normaal, 0-24) (geconjugeerde bilirubine 168,5 μmol/L); en internationale genormaliseerde ratio (INR) 0,9 (normaal, 0,9-1,3). De galzuurspiegel was verhoogd tot al niveau van 460,5 μmol/L (normaal, 0-8,0). Gedifferentieerd bloedbeeld en c-reactief proteïne waren normaal. Er was sprake van milde hyponatriëmie en hypochloremie, in overeenstemming met de toegenomen waterinname van de patiënt gedurende de voorgaande dagen. Serologische tests voor acute hepatitis A, B, C en E, Epstein-Barr virus en cytomegalovirus infectie waren negatief. Coeruloplasmine was normaal. Lever-specifieke auto-antilichamen (anti-nucleaire antistof, anti-neutrofiele antistof, anti-gladde spier antistof, anti-mitochondriale antistof, anti-proteinase 3 antistof en anti-myeloperoxidase antistof) waren negatief en IgA, IgM en IgG waren binnen het normale bereik. Abdominale ultrasonografie toonde een normaal leverparenchym, vaten en galwegen. De leverelastografie was verhoogd (FibroScan, 12,7 kPa, normaal bereik <5 kPa).
De patiënt werd ook geëvalueerd in het Zwitserse Instituut voor Tropische en Volksgezondheid voor verschillende mogelijke onderliggende infectieuze aandoeningen. Antilichamen tegen rickettsia spotted fever waren positief, maar dit werd niet in verband gebracht met de klinische presentatie en er werd geen antibiotische therapie gestart.
De eerste leverbiopsie toonde een portale hepatitis met lymfocytaire infiltratie van de galwegen en diffuse intra-canaliculaire en intra-cytoplasmatische bilirubinostase. Noch fibrose, noch parasitair materiaal werd gezien (Figuren 2A,B). Een next generation sequencing analyse op DNA van perifere bloed leukocyten voor genetische varianten in de genen die coderen voor de 3 belangrijkste lever transporters voor galzuur homeostase, namelijk BSEP, MDR3 en FIC1, vond geen varianten die typisch geassocieerd worden met erfelijke cholestatische leverziekten.
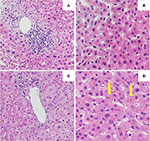
Figuur 2. Histologie van de eerste (A,B) en tweede (C,D) leverbiopsie. (A) Laag vermogen beeld van leverbiopsie toont een portaal lymfocytair infiltraat. (B) Leverparenchym met intracellulaire bilirubinostase (HE, 20x). (C) Laag vermogen beeld van leverbiopsie zonder significante portale ontsteking (HE, 10x). (D) Leverparenchym met significante intracellulaire en extracellulaire (pijl) bilirubinostase (HE, 20x).
De toxicologische analyse van de Artemisia-thee door vloeistofchromatografie-massaspectrometrie en gaschromatografie-massaspectrometrie bracht de volgende bestanddelen aan het licht: arteannuin b, deoxyartemisine, kamfer en scopoletine.
Behandeling met prednison 20mg tweemaal daags en ursodeoxycholzuur 500 mg tweemaal daags werd gestart. Wegens aanhoudende geelzucht en stijgend bilirubine gedurende 4 weken ondanks behandeling, werd een tweede leverbiopsie verricht. De tweede biopsie toonde een ernstige intracytoplasmatische en intracanaliculaire bilirubinostase, met slechts minimale ontsteking in vergelijking met de eerste biopsie (Figuren 2C,D). De behandeling met corticosteroïden werd gestaakt, ursodeoxycholzuur werd voortgezet tot oplossing van de geelzucht en normalisering van de bilirubine (15,3 μmol/l) (figuur 3) en relevante daling van de galzuren (19,5 μmol/l), die drie maanden na het begin van de ziekte optrad.
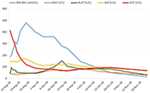
Figuur 3. Verloop van bilirubine en leverenzymen in de tijd.
Het geval werd gemeld aan de eenheid voor geneesmiddelenbewaking van de Zwitserse nationale autoriteit voor therapeutische producten (Swissmedic). Schriftelijke geïnformeerde toestemming werd verkregen van de deelnemer voor de publicatie van dit case report.
Discussie
Artemisinine-derivaten zijn een hoeksteen voor de behandeling maar niet voor de chemopreventie van malaria (2). Ondanks hun uitgebreide gebruik is leverschade door artemisinin-derivaten zelden beschreven (8, 10). Voor zover wij weten, is dit het eerste verslag van een acute cholestatische hepatitis als gevolg van de inname van Artemisia annua thee.
Voor kruiden en voedingssupplementen -geïnduceerde leverschade is een onderwerp van groeiende belangstelling sinds HDS wereldwijd steeds meer worden gebruikt (7). De inname van HDS wordt vaak als onschadelijk beschouwd, maar er is een toenemend aantal ongewenste voorvallen bij het gebruik ervan gerapporteerd (16). Bovendien worden de concentratie en samenstelling van HDS vaak niet vermeld op de etiketten van de producten, zodat de kwaliteit en de hoeveelheid van de ingrediënten van het product onbekend blijven. In ons geval was de diagnose van door HDS veroorzaakte leverschade als gevolg van de inname van Artemisia annua-thee gebaseerd op de sterke temporele relatie tussen blootstelling en de ontwikkeling van de bijwerking en de afwezigheid van andere mogelijke etiologieën. Wij berekenden de causaliteitsbeoordeling volgens de RUCAM (Roussel Uclaf Causality Assessment Method) (17) en behaalden een score van 6, wat overeenkomt met een “waarschijnlijke” causaliteit van het geneesmiddel in kwestie. De verschillende items werden als volgt gescoord: tijd tot begin (+2), beloop (+1), risicofactoren (+1), bijkomende geneesmiddelen (-1), uitsluiting van andere oorzaken van leverschade (+2), eerdere informatie over hepatotoxiciteit van het geneesmiddel (+1), reactie op herinstructie (0). Er waren geen andere aanwijsbare etiologieën van de leverziekte.
Het eerder door Kumar beschreven geval vertoonde een hepatocellulair patroon van leverschade, gevolgd door een langdurige cholestatische fase (10). Onze patiënt presenteerde zich met een overwegend cholestatisch patroon van leverschade 5 weken na de eerste inname van Artemisia annua thee. Wij veronderstellen dat de natuurlijke geschiedenis vergelijkbaar was met die van Kumar, maar dat onze patiënt zich in een later stadium van de evolutie van de leverschade presenteerde. In de toxicologische analyse van de ingenomen kruidenthee identificeerden we bovendien scopoletine en kamfer, die van nature voorkomen in Artemisia annua (18, 19) en mogelijk hebben bijgedragen aan het ontstaan van cholestatische leverschade.
Het mechanisme van door artemisinine-derivaten geïnduceerde leverschade blijft onduidelijk. Chemische bestanddelen van Artemisiae spp omvatten vluchtige oliën, flavonoïden, tanninen, triterpenen en polysacchariden. Vluchtige oliën van Artemisiae spp hebben sterke farmacologische activiteiten en toxiciteit, en een recente bioinformatica benadering identificeerde verschillende paden die betrokken kunnen zijn bij de ontwikkeling van leverschade (20). De aanleg voor medicijn-geïnduceerde cholestatische leverschade is in verband gebracht met galzout-export pomp polymorfismen (21, 22). Daarom zochten wij naar varianten in galzuurtransporters door middel van next generation sequencing. We detecteerden geen deletie, duplicatie of pathologische variant in de ABCB11, ATP8B1 en ABCB4 gensequenties (coderende en flankerende regio’s) die coderen voor BSEP, FIC1 en MDR3, respectievelijk (Figuur 4). Er werden echter een aantal gemeenschappelijke sequentievarianten geïdentificeerd. Onze patiënt had homozygoot een variant van het ABCB11 gen. Er is over gedebatteerd of dit polymorfisme geassocieerd is met benigne terugkerende en/of progressieve bekende intrahepatische cholestase en intrahepatische cholestase van de zwangerschap (23, 24). Bovendien werd een andere veel voorkomende variant in het ABCB11-gen gedetecteerd in heterozygote toestand . Deze variant is in verband gebracht met verminderde eiwitexpressie (25) en met primaire biliaire cirrose (26, 27). Echter, beide genetische varianten zijn veel te frequent in de algemene bevolking om causaal te zijn voor cholestatische leverziekten (28). Systematische sequenering van het transcriptoom in dergelijke gevallen kan varianten identificeren in andere regio’s van de gensequenties of in andere genen die coderen voor andere levertransporteurs of eiwitten die betrokken zijn bij de galproductie, zoals respectievelijk ABCC2, ABCC3, ABCC4, en tight junction protein 2 (TJP2) (21).
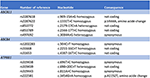
Figuur 4. Moleculaire genetische analyse van de genen ABCB11, ABCB4 en ATP8B1.
Concluderend beschrijven we een geval van een ernstige, door HDS veroorzaakte cholestatische leverbeschadiging die verenigbaar is met de inname van Artemisia annua-thee. Er moeten inspanningen worden geleverd om het gebruik van artemisinine-derivaten voor malariapreventie te ontmoedigen, omdat dit volgens de aanbevelingen van de WHO ondoeltreffend is en bovendien schade kan veroorzaken. Bovendien toont deze casus aan dat we nog onvoldoende inzicht hebben in de pathofysiologie en vatbaarheid voor HDS-geïnduceerde leverschade.
Data Availability Statement
Alle datasets voor deze studie zijn opgenomen in het manuscript/supplementary files.
Ethics Statement
Ethische toetsing en goedkeuring was niet vereist voor het verslag van een enkel klinisch geval hier in overeenstemming met de lokale wetgeving en institutionele vereisten. De patiënt/deelnemer gaf zijn schriftelijke geïnformeerde toestemming tot deelname.
Bijdragen van de auteur
FR-R schreef het eerste concept van het manuscript. SH, CB, AL-T, MZ, en AJ schreven delen van het manuscript. FR-R, SH, SR, MZ, KR, JB, AJ, MH, AL-T, LT, en CB droegen bij aan de klinische behandeling van de patiënt, revisie van het manuscript, lazen en keurden de ingediende versie goed.
Conflict of Interest
De auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
1. Klayman DL. Qinghaosu (artemisinine): een antimalaria geneesmiddel uit China. Science. (1985) 228:1049-55. doi: 10.1126/science.3887571
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Wereldgezondheidsorganisatie. WHO richtlijnen voor de behandeling van malaria, 2nd ed. (2010). Online beschikbaar op: http://www.who.int/malaria/publications/atoz/9789241547925/en/index.html (geraadpleegd op 23 november 2018).
Google Scholar
3. SafeTravel.ch. Reismedizinische Beratung. Malariavorbeugung (Chemoprophylaxe) (2016). Online beschikbaar op: http://www.safetravel.ch/safetravel2/servlet/ch.ofac.wv.wv204j.pages.Wv204ConseilsSanteListeCtrl?action=afficheDetail&elementCourant=1 (geraadpleegd op 23 november 2018).
Google Scholar
4. Centers for Disease Control and Prevention. Choosing a Drug to Prevent Malaria (2018). Online beschikbaar op: https://www.cdc.gov/malaria/travelers/drugs.html
Google Scholar
5. Shahinas D, Lau R, Khairnar K, Hancock D, Pillai DR. Artesunate misuse and Plasmodium falciparum malaria in traveler returning from Africa. Emerg Infect Dis. (2010) 16:1608-10. doi: 10.3201/eid1610.100427
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Wereldgezondheidsorganisatie. WHO, standpuntbepaling. Effectiveness of Non-Pharmaceutical Forms of Artemisia annua L. Against Malaria. Genève: World Health Organization (2012).
Google Scholar
7. Navarro VJ, Khan I, Björnsson E, Seeff LB, Serrano J, Hoofnagle JH. Liver injury from herbal and dietary supplements. Hepatologie. (2017) 65:363-73. doi: 10.1002/hep.28813
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Guevart E, Aguemon A. Twee gevallen van fulminante hepatitis tijdens een curatieve behandeling met een artesunaat-amodiaquine combinatie. Med Mal Infect. (2009) 39:57-60. doi: 10.1016/j.medmal.2008.09.024
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Centers for Disease Control and Prevention (CDC). Hepatitis tijdelijk geassocieerd met een kruidensupplement dat artemisinine bevat – Washington, 2008. Morb Mortal Wkly Rep. (2009) 58:854-6.
Google Scholar
10. Kumar S. Cholestatische leverschade secundair aan artemisinine. Hepatologie. (2015) 62:973-4. doi: 10.1002/hep.27900
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Stebbings S, Beattie E, McNamara D, Hunt S. A pilot randomized, placebo-controlled clinical trial to investigate the efficacy and safety of an extract of Artemisia annua administered over 12 weeks, for managing pain, stiffness, and functional limitation associated with osteoarthritis of the hip and knee. Clin Rheumatol. (2016) 35:1829-36. doi: 10.1007/s10067-015-3110-z
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Medsafe. Arthrem – Potentieel risico op schade aan de lever -Statement Under Section 98 of the Medicines Act 1981 (2018). Online beschikbaar op: http://www.medsafe.govt.nz/safety/EWS/2018/Arthrem.asp
Google Scholar
13. National Institutes of Health, LiverTox, Clinical and Research Information on Drug-Induced Liver Injury. Artemisinine Derivaten. (2019). Online beschikbaar op: https://livertox.nih.gov/ArtemisininDerivatives.htm
Google Scholar
14. Savage RL, Tatley MV, Barnes J. Hepatotoxicity with a Natural Dietary Supplement, Artemisia annua L. Extract in Grapeseed Oil. Nieuw-Zeeland Pharmacovigilance Centre Reports. Drug Safety (2018). In: 18e ISoP Annual Meeting “Pharmacovigilance without borders.” Genève (geraadpleegd 11-14 november 2018).
Google Scholar
15. Wang JB, Zhu Y, Bai ZF, Wang FS, Li XH, Xiao XH, et al. Guidelines for the Diagnosis and Management of Herb-Induced Liver Injury. Chin J Integr Med. (2018) 24:696-706. doi: 10.1007/s11655-018-3000-8
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Clarke TC, Black LI, Stussman BJ, Barnes PM, Nahin RL. Trends in het gebruik van complementaire gezondheidsbenaderingen onder volwassenen: Verenigde Staten, 2002-2012. Natl Health Stat Rep. (2015) 79:1-16.
Google Scholar
17. Danan G, Teschke R. RUCAM in drug and herb induced liver injury: the update. Int J Mol Sci. (2015) 17:E14. doi: 10.3390/ijms17010014
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Zhang X, Zhao Y, Guo L, Qiu Z, Huang L, Qu X. Differences in chemical constituents of Artemisia annua L from different geographical regions in China. PLoS ONE. (2017) 12:e0183047. doi: 10.1371/journal.pone.0183047
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Ogwang Engeu P, Omujal F, Agwaya M, Kyakulaga H, Obua C. Variaties in antimalariacomponenten van Artemisia annua Linn uit drie regio’s van Oeganda. Afr Health Sci. (2015) 15:828-34. doi: 10.4314/ahs.v15i3.17
CrossRef Full Text | Google Scholar
20. Liu H, Zhan S, Zhang Y, Ma Y, Chen L, Chen L, et al. Molecular network-based analysis of the mechanism of liver injury induced by volatile oils from Artemisiae argyi folium. BMC Complement Altern Med. (2017) 17:491. doi: 10.1186/s12906-017-1997-4
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Morgan RE, Trauner M, van Staden CJ, Lee PH, Ramachandran B, Eschenberg M, et al. Interference with bile salt export pump function is a susceptibility factor for human liver injury in drug development. Toxicol Sci. (2010) 118:485-500. doi: 10.1093/toxsci/kfq269
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Kubitz R, Dröge C, Stindt J, Weissenberger K, Häussinger D. The bile sal export pump (BSEP) in health and disease. Clin Res Hepatol Gastroenterol. (2012) 36:536-53. doi: 10.1016/j.clinre.2012.06.006
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Alissa FT, Jaffe R, Shneider BL. Update over progressieve familiale intrahepatische cholestase. J Pediatr Gastroenterol Nutr. (2008) 46:241-52.21. doi: 10.1097/MPG.0b013e3181596060
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Dixon PH, Williamson C. The molecular genetics of intrahepatic cholestasis of pregnancy. Obstet Med. (2008) 1:65-71. doi: 10.1258/om.2008.080010
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Stieger B. The role of the sodium-taurocholate cotransporting polypeptide (NTCP) and of the bile salt export pump (BSEP) in physiology and pathophysiology of bile formation. Handb Exp Pharmacol. (2011) 201:205-59. doi: 10.1007/978-3-642-14541-4_5
CrossRef Full Text | Google Scholar
26. Pauli-Magnus C, Kerb R, Fattinger K, Lang T, Anwald B, Kullak-Ublick GA, et al. BSEP and MDR3 haplotype structure in healthy Caucasians, primary biliary cirrhosis and primary sclerosing cholangitis. Hepatology. (2004) 39:779-91. doi: 10.1002/hep.20159
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pan S, Li X, Jiang P, Jiang Y, Shuai L, He Y, et al. Variaties van ABCB4- en ABCB11-genen zijn geassocieerd met primaire intrahepatische stenen. Mol Med Rep. (2015) 11:434-46. doi: 10.3892/mmr.2014.2645
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dröge C, Bonus M, Baumann U, Klindt C, Lainka E, Kathemann S, et al. Sequencing of FIC1, BSEP and MDR3 in a large cohort of patients with cholestasis revealed a high number of different genetic variants. J Hepatol. (2017) 67:1253-64. doi: 10.1016/j.jhep.2017.07.004
PubMed Abstract | CrossRef Full Text | Google Scholar