1. Permeabiliteit
2. Vloeibaarheid
3. Heterogeniteit
– Binnenste
-buitenste
– Buiging, dikte
De functies van celmembranen worden bepaald door hun moleculaire samenstelling. Het type en de verhouding van deze moleculen bepalen de fysisch-chemische kenmerken van het membraan: semipermeabiliteit, asymmetrie, vloeibaarheid, herstel en recycling.
Permeabiliteit
De semipermeabiliteit van het membraan is een gevolg van het interne hydrofobe milieu van membranen, dat wordt gecreëerd door de vetzuurketens van de lipiden en dat moeilijk kan worden gepasseerd door moleculen met elektrische ladingen. Door vrije diffusie van moleculen te voorkomen, kunnen membranen compartimenten vormen die een verschillende interne en externe omgeving behouden. De permeabiliteit is echter selectief. Polariteit en grootte zijn de belangrijkste moleculaire kenmerken die het vermogen om membranen te passeren beïnvloeden. Kleine moleculen zonder elektrische lading, zoals CO2, N2, O2, en moleculen met een hoge oplosbaarheid in vet, zoals ethanol, kunnen door passieve diffusie vrijwel vrij membranen passeren (figuur 1). De doordringbaarheid is kleiner voor moleculen die elektrische ladingen hebben wanneer het aantal positieve ladingen gelijk is aan de negatieve, de zogenaamde ongeladen moleculen, zoals water en glycerol. Men zou kunnen denken dat water membranen vrij kan oversteken, maar er zijn enkele beperkingen, en daarom bevatten sommige membranen aquaporines, een soort transmembraaneiwitten met een kanaaltje waardoor het water vrij kan oversteken. Het vermogen van grote niet-geladen moleculen, zoals glucose, om membranen te passeren is gering. Membranen zijn zeer ondoordringbaar voor ionen en geladen moleculen. Enkele waarden voor de permeabiliteitscoëfficiënt door passieve diffusie zijn: O2: 2,3 cm/s, CO2: 0,35 cm/s, H2O: 0,0034 cm/s, glycerol: 10 -6 cm/s, natrium en kalium: 10 -14 cm/s.
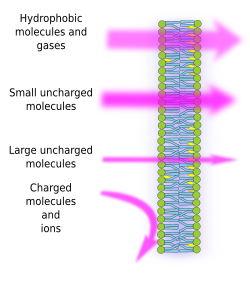
De ongelijke verdeling van ionen en moleculen tussen beide zijden van een membraan maakt het mogelijk om elektrochemische gradiënten te genereren en in stand te houden. Het verschil tussen de binnenste en de buitenste concentratie van elektrische ladingen wordt membraanpotentiaal genoemd. Deze gradiënt wordt gebruikt voor vele celfuncties, zoals de synthese van ATP en de overdracht van informatie langs de zenuwen. Semipermeabiliteit is ook verantwoordelijk voor osmotische processen, dat zijn waterbewegingen over membranen van een minder geconcentreerde oplossing aan de ene kant naar een meer geconcentreerde oplossing aan de andere kant, om beide concentraties gelijk te maken. Op deze manier kunnen plantencellen groter worden dankzij een hogere intracellulaire concentratie van bepaalde oplosmiddelen die ervoor zorgen dat water de cel binnendringt, wat op zijn beurt een inwendige hydrostatische druk (turgordruk genoemd) oplevert die de celwanden naar buiten duwt. Moleculen die de membranen niet vrij kunnen passeren, zijn nuttig voor cellen omdat zij gradiënten kunnen creëren die kunnen werken als informatiemechanismen of als energieopslagplaatsen. Cellen hebben transmembraanproteïnen die het mogelijk maken het membraan over te steken of geladen moleculen en ionen tussen beide zijden van de celmembranen te verplaatsen, waarbij de hydrofobe omgeving van het binnenste membraan wordt vermeden. Spiersamentrekking wordt bijvoorbeeld teweeggebracht door de opening van kanalen die een bestaande ionische gradiënt verminderen.
Semipermeabiliteit wordt beïnvloed door de lipidensamenstelling van membranen. Zo is bijvoorbeeld het cholesterolgehalte belangrijk in het plasmamembraan. Een toename van het cholesterolgehalte vermindert de vloeibaarheid en verhoogt de hydrofobiciteit, beide kenmerken maken het membraan ondoorlaatbaarder. Een verhoging van het cholesterolgehalte met meer dan 30% (wat een hoge waarde is) maakt myelinemembranen dus zeer geschikt voor het isoleren van de axonen en het optimaliseren van de voortplanting van de actiepotentiaal langs het axon.
Vochtigheid en laterale domeinen
Vochtigheid is een eigenschap van membranen. Zij houdt verband met het vermogen van moleculen om binnen de membranen te bewegen. Hogere vloeibaarheid betekent dat de bewegingen frequenter zijn. Celmembranen zijn in feite een vel vet, waarin moleculen zich in een halfvloeibare, viskeuze toestand bevinden. Het laat zich dus raden dat moleculen zich door diffusie kunnen verplaatsen. Een glycerofosfolipide bijvoorbeeld, die zich in de buitenste monolaag van het plasmamembraan bevindt, kan twee soorten bewegingen vertonen: lateraal, d.w.z. in dezelfde monolaag, en flip-flop, d.w.z. springend van de ene monolaag naar de andere (figuur 2). In kunstmatige membranen zijn deze twee soorten bewegingen waargenomen, waarbij de laterale bewegingen veel frequenter zijn dan de flip-flop. Door laterale diffusie kunnen lipiden zich in 20 seconden 30 µm verplaatsen; zij kunnen zich in een minuut over de gehele omtrek van een middelgrote cel verplaatsen. Flip-flop bewegingen komen echter zeer zelden voor omdat de hydrofiele kop van het lipidemolecuul de interne laag van vetzuurketens moet doorkruisen, en dit is thermodynamisch moeilijk. Voor één lipidemolecuul is de waarschijnlijkheid van een flip-flop verschuiving ongeveer één keer per maand. Cholesterol gedraagt zich echter anders en kan vrij gemakkelijk flip-flop doen.

De membraanfluïditeit kan veranderen afhankelijk van de chemische samenstelling. In het algemeen geldt dat kortere vetzuurketens en een hoger aantal onverzadigde bindingen tussen de koolstofatomen van vetzuren de vloeibaarheid van het membraan verhogen. Ook de hoeveelheid cholesterol beïnvloedt de vloeibaarheid van het membraan, maar het netto-effect hangt af van de temperatuur en het type lipiden in het membraan. Cholesterol heeft twee effecten: het remt de overgang naar een vaste gel-toestand (minder vloeibaarheid), maar vermindert ook de flexibiliteit van de onverzadigde vetzuurketens. In het algemeen kan worden gesteld dat een verhoging van de cholesterolconcentratie de vloeibaarheid van de membranen vermindert, hoewel bij lage temperaturen het effect omgekeerd is. Interne membranen van de cel, zoals die van het endoplasmatisch reticulum, bevatten zeer weinig cholesterol en zijn daarom vloeibaarder. Bovendien verschaft cholesterol membranen een andere eigenschap die bekend staat als hidrophobicity, die membranen meer ondoordringbaar maakt.
Verschil in moleculaire samenstelling tussen de twee monolagen van een membraan, bekend als membraanasymmetrie, kan een verschillende vloeibaarheid in elke monolaag genereren. Afhankelijk van de moleculaire samenstelling kunnen lipiden zich in twee fysische fasen bevinden: vloeistofgeordend (minder vloeibaar) en vloeistofgedisorderd (meer vloeibaar). De buitenste monolaag van het plasmamembraan wordt verondersteld zich vaker in de vloeistofgeordende fase te bevinden, terwijl de binnenste monolaag zich eerder in de vloeistofgedisorderde fase bevindt.
Cellen kunnen de vloeibaarheid van de membranen wijzigen door hun chemische samenstelling te veranderen. Bacteriën passen bijvoorbeeld de verzadiging en lengte van vetzuurketens aan, zodat de vloeibaarheid van het membraan kan worden aangepast aan de omgevingsomstandigheden. Variatie in de glycerofosfolipidenconcentratie, zoals fosfatidylethanolamine, kan de vloeibaarheid ook moduleren. Sommige insecten kunnen geen sterolen, zoals cholesterol, synthetiseren en de sterolen van hun membranen zijn afkomstig van voedsel. Zij veranderen de vloeibaarheid van hun celmembranen door verschillende concentraties van fosfatidylethanolamine.
Het binnenmembraan van mitochondria moet een sterke ondoordringbare barrière zijn om een proton gradiënt te creëren en te handhaven. Dit zou kunnen gebeuren door een verhoging van het cholesterolgehalte. Op deze manier wordt de hidrophobicity verhoogd, maar op zijn beurt vermindert cholesterol de fluïditeit, die zeer belangrijk blijkt te zijn voor de functie van de proteïnen in dit membraan. Mitochondria lossen het probleem op met cardiolipine, een onverzadigde fosfolipide die de hidrofobiciteit verhoogt, maar de vloeibaarheid van het membraan niet veel vermindert.
3. Heterogeniteit
Vanwege de vloeibaarheid kan men denken dat eiwitten willekeurig verdeeld zijn en dat membranen daarom homogeen zijn wat betreft de moleculaire samenstelling, d.w.z. dat zij dezelfde moleculaire inhoud en verhouding vertonen, onafhankelijk van het membraangebied. Dit is niet waar. Er zijn beperkingen voor de laterale diffusie van moleculen die membraanheterogeniteit veroorzaken, hetgeen betekent dat er regio’s van een membraan zijn met een verschillende moleculaire samenstelling. In niet-gepolariseerde cellen, en op schalen groter dan 200 nm, ziet het plasmamembraan er homogeen uit, maar op schalen kleiner dan 200 nm is het heterogeen. De microdomeinen van membranen worden verondersteld ongeveer 60 µm groot te zijn. Lipiden en eiwitten vertonen zijwaartse bewegingen die meestal beperkt blijven tot gebieden van 60-200 nm gedurende een paar milliseconden, en springen dan naar een ander aangrenzend gebied waar zij nog een korte tijd blijven. Dit gedrag wordt saltatoire diffusie genoemd.
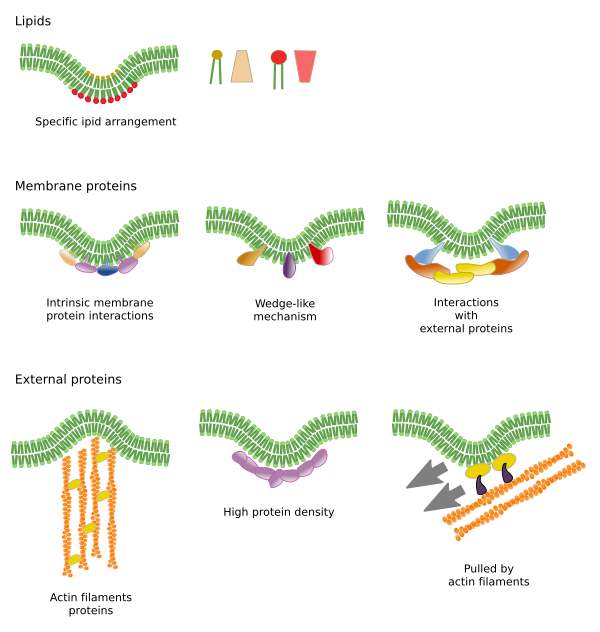
Beperkingen in de laterale bewegingen van moleculen kunnen door verschillende mechanismen worden veroorzaakt: interacties met het cytoskelet of de extracellulaire matrix, interacties van membraanmoleculen onderling, verschillende dichtheden van lokale membraangebieden (veranderingen in vloeibaarheid), hoeveelheid elektrische ladingen, kromming van het membraan, en verschillende dikte van membraandomeinen (figuur 3).
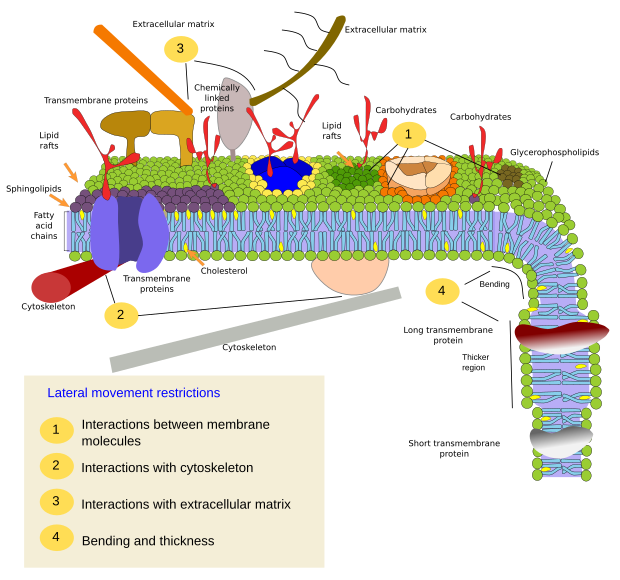
interne interacties
interacties van membraanmoleculen onderling beperken de laterale beweging. De bewegingen van zowel eiwitten als lipiden worden beïnvloed door deze interacties, die leiden tot de vorming van microdomeinen met een verschillende moleculaire samenstelling (figuur 4). Het resultaat is een laterale heterogene verdeling van moleculen in membranen. Afhankelijk van de moleculaire verhoudingen kunnen lipidemicrodomeinen verschillende dichtheden (d.w.z. vloeibaarheid) hebben: vast, vloeibaar geordend en vloeibaar ongeordend. De meest voorkomende dichtheid is vloeibaar ongeordend, dat is het meest vloeibaar.
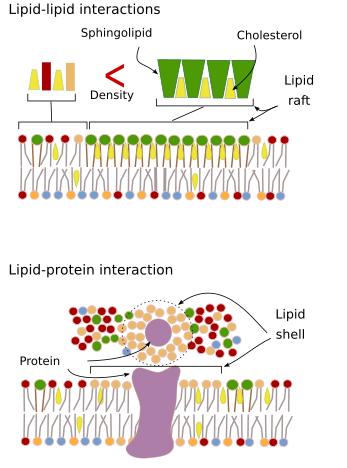
Sphingolipiden en cholesterol kunnen spontaan met elkaar geassocieerd raken, waardoor hun beweeglijkheid afneemt en de moleculaire dichtheid toeneemt in vergelijking met naburige gebieden. Een kleine afzonderlijke groep moleculen wordt gevormd als een vlot in een zee van lipiden. Deze moleculaire associaties staan bekend als lipid rafts, en worden zeer talrijk geacht in celmembranen. Lipidevlotten vertonen een zeer dynamisch gedrag: ze kunnen bewegen, groeien, afnemen, verschijnen en verdwijnen. Immers, membranen bestaan uit vele dichte domeinen die zich zijdelings tussen de glycerofosfolipiden bewegen, zodat membranen tamelijk heterogeen zijn wat hun moleculaire verdeling betreft. Sommige experimenten suggereren dat bepaalde soorten eiwitten zich meer op hun gemak voelen binnen lipide rafts. Deze eiwitten brengen meer tijd door binnen dan buiten de lipid rafts en reizen dus enige tijd binnen deze dichtheden. Dit veroorzaakt een segregatie van moleculen langs het membraan, en verhoogt de waarschijnlijkheid dat verschillende moleculen meer tijd dan toevallig dicht bij elkaar zijn (diffusie), waardoor de waarschijnlijkheid van bepaalde moleculaire reacties toeneemt. Bovendien wordt gesuggereerd dat een hoge concentratie van bepaalde soorten lipiden in de lipide rafts een aparte chemische omgeving creëert die bepaalde chemische reacties of moleculaire interacties vergemakkelijkt. Er is voorgesteld dat lipidenvlotten aanwezig zijn in de buitenste monolaag van het plasmamembraan omdat sfingolipiden aan deze zijde in overvloed aanwezig zijn. Membraandomeinen zouden ook bestaan in de membranen van organellen, en men denkt dat sommige van hun functies afhankelijk zijn van deze membraandomeinen.
In de binnenste monolaag van het plasmamembraan worden microdomeinen gevormd door elektrostatische interacties tussen basische cytosol-domeinen of tweewaardige kation-domeinen van eiwitten en de negatieve polaire koppen van lipiden. Een ander minder bekend voorbeeld is de associatie tussen fosfatidylinositolbisfosfaat en cholesterol die microdomeinen in deze monolaag vormt. Deze naar het cytosol gerichte microdomeinen kunnen van invloed zijn op intracellulaire eiwitscaffolds.
Traditioneel heeft men gedacht dat er geen interacties zijn tussen beide monolagen van membranen en dat zij hun microdomeinen onafhankelijk van elkaar verdelen. Er zijn echter aanwijzingen dat er wel degelijk interacties tussen beide zijn. Transmembraanproteïnen beïnvloeden gelijktijdig beide monoloyers aangezien zij het gehele membraan doorkruisen. Een andere manier van synchronisatie tussen beide monolagen kan bemiddeld worden door de lange vetzuurketens, zoals sommige sfingolipiden die 24 carbons lang kunnen zijn (de normale lengte is 18). Deze lange ketens kunnen tussen de vetzuurketens van de lipiden van de andere monolaag worden ingevoegd en de lipidendistributie beïnvloeden. Verder wordt gedacht dat lipidengebieden met lange vetzuurketens worden gecompenseerd door lipidenmicrodomeinen met korte vetzuurketens in de andere monolaag, waardoor de dikte van het membraan constant blijft.
Membraaneiwitten, zowel integrale als geassocieerde, kunnen ook onderling interageren en zich samenvoegen tot macromoleculaire steigers om de overdracht van informatie, cel-cel herkenning, het starten van sommige enzymatische activiteiten, en cellulaire beweging te vergemakkelijken. Er zijn ook multimere eiwitten die alleen actief zijn wanneer alle subeenheden bij elkaar worden gehouden. De insulinereceptor bijvoorbeeld bestaat uit vier subeenheden. Eiwitten en lipiden kunnen ook samenwerken om membraandomeinen te vormen. In de binnenste monolaag bijvoorbeeld associëren fosfatidylinositol zich rond eiwitten door elektrische interacties, die kunnen worden geregeld door de fosfaten van de polaire kop van de lipiden te wijzigen.
Interacties met buitenste elementen
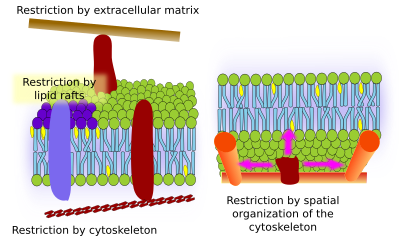
Integrale membraaneiwitten kunnen ook zijwaartse bewegingen maken, maar zij zijn beperkter dan lipiden, vooral door interacties met de extracellulaire matrix en het cytoskelet via hun respectievelijk extracellulaire en intracellulaire domeinen (figuur 5). Deze interacties kunnen eiwitten langer in kleine gebieden van het membraan houden dan alleen door diffusie. Het cytoskelet kan net onder het plasmamembraan hekken vormen die eiwitten in kleine gebieden beperkt houden. Actinefilamenten en microtubuli kunnen kleine gebieden omsluiten die de diffusie van eiwitten en lipiden beperken. Interacties met het cytoskelet zijn belangrijk, want als het cytoskelet experimenteel wordt gedesorganiseerd, wordt het membraan veel homogener. Cellen hebben andere mechanismen om eiwitten tot specifieke domeinen te beperken. Bij darmepitheelcellen bijvoorbeeld bevinden sommige transporters en enzymen zich in de apicale plasmamembraan, maar niet in het baso-laterale domein vanwege een gordel van tight junctions, een moleculaire rits die de diffusie tussen de apicale en baso-laterale domeinen verhindert. Een dergelijke asymmetrische verdeling is essentieel voor de fysiologie van de epitheliale cel.
Membraanbuiging is een andere manier om microdomeinen te creëren. Een membraankromming kan het beginpunt zijn om een blaasje te vormen, een cytoplasma-uitbreiding voor cellulaire uitbreiding, een vormverandering of groei van een organel, of gewoon om een barrière te beginnen om de laterale beweging van moleculen te beperken. Dit is een fysieke beperking door de 3D dispositie van de lipiden in de kleinere hoek van de membraanplooi.
De moleculaire hulpmiddelen die nodig zijn voor het buigen van een membraan worden gerekruteerd in specifieke gebieden van het membraan. Deze microdomeinen kunnen een specifieke lipidensamenstelling of een bepaalde elektrische ladingsomgeving hebben. Fosfoinositiden (PIP’s), vooral de PIP2 en PIP3, zijn lipiden die bijdragen tot het rekruteren van eiwitten voor het buigen van het membraan. Het zijn nuttige moleculen omdat de elektrische lading en de moleculaire structuur van hun polaire koppen gemakkelijk kunnen worden gewijzigd door chemische reacties. Op deze wijze kunnen de eigenschappen van een bepaald membraangebied veranderen wanneer dat nodig is en specifieke eiwitten rekruteren. Fosfatidylserine is ook in staat een microdomein voor membraanbuiging te initiëren wanneer het door flipasases van de ene monolaag naar de andere wordt getranslokeerd.
Buiging en diktes
Lipidemicrodomeinen rekruteren eiwitten die het membraan effectief buigen. Er zijn gespecialiseerde eiwitten in deze rol (figuur 6). BAR-domain-eiwitten (Bin/amphyphysin/Rsv161) zijn er een van. Het buigen kan door twee mechanismen worden geïnduceerd: door de assemblage van een gebogen scaffold van eiwitten die aan het membraan trekken of duwen, en door aminozuursequenties als een wig tussen de lipiden in te brengen. Zo veroorzaken caveolines de kromming van het membraan om caveloae te vormen, tetraspine dwingt membranen om tubules te vormen, ESCRT helpt bij de vorming van blaasjes binnen endosomen om multivesiculaire lichamen te vormen. Actine zorgt voor een sterke buiging van het membraan door polymerisatie van actinefilamenten, waardoor het plasmamembraan naar buiten wordt geduwd, wat leidt tot celexpansie. Veel eiwitten die het plasmamembraan kunnen buigen, activeren ook actinepolymerisatie.
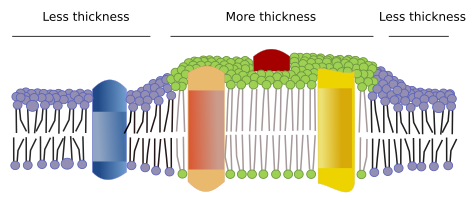
Er zijn nog andere domeinen in membranen, fysische domeinen, gevormd door moleculen zoals transmembraaneiwitten. Deze gebieden vertonen een verschillende membraandikte omdat zij eiwitten bevatten met langere hydrofobe aminozuurreeksen die worden omgeven door lipiden met langere vetzuurketens (figuur 7). Deze eiwitten en lipiden “voelen” zich prettiger wanneer zij samen zijn omdat hun hydrofobe delen goed op elkaar aansluiten. Zij vormen membraandomeinen die andere moleculen, hetzij eiwitten, hetzij lipiden, met kortere hydrofobe gebieden buitensluiten.
Bibliografía
Honigmann A, Pralle A. (2016). Compartimentalisatie van het celmembraan. Journal of mollecular biology. 428: 4739-4748.
Jarsch IK, Daste F, Gallop JL (2014). Membraankromming in de celbiologie: een integratie van moleculaire mechanismen. Tijdschrift voor celbiologie. 214: 275-387.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M (2017). Hoog cholesterol/laag cholesterol: effecten in biologische membranen: een review Cell biochemstry and biohysic. https://doi.org/10.1007/s12013-017-0792-7.