一般名:エリスロマイシン エチルサクシネート
剤形:錠剤、経口懸濁用顆粒
Drugs.com で医学的に検討されているもの。 最終更新日:2020年2月1日
- 概要
- 副作用
- 用法用量
- 専門家
- 相互作用
- その他
Rx only
E.E.S. と他の抗菌薬の薬剤耐性を発現を抑え効果を維持するには E.E.S. と他の抗菌薬で十分な効果が得られます。E.E.S.は、細菌が原因であることが証明されているか、強く疑われている感染症の治療または予防にのみ使用されるべきです。
EES 説明
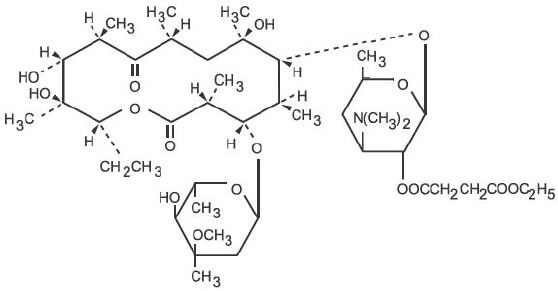
エリスロマイシンはSaccharopolyspora erythraea(旧 Streptomyces erythraeus)の株によって生産されており、マクロライド系の抗生物質に属します。 塩基性であり、酸と容易に塩を形成する。 塩基、ステアリン酸塩およびエステルは水に難溶である。 エリスロマイシンエチルサクシネートは、経口投与に適したエリスロマイシンのエステルである。 エリスロマイシンエチルサクシネートは、化学的にはエリスロマイシン2′-(エチルサクシネート)として知られています。 分子式はC43H75NO16であり、分子量は862.06である。 構造式は、
E.E.S. 顆粒は、水と再構成するために意図されています。
E.E.S. 200液:小さじ5杯のフルーツ味の懸濁液には、エリスロマイシン200mgに相当するエリスロマイシンエチルサクシネートが含まれています。
E.E.S. 400液:オレンジ風味の懸濁液5mL当たり、エリスロマイシン400mg相当のエリスロマイシンエチルサクシネートを含む。
グラニュールと既製の懸濁液は主に小児用であるが成人にも使用できる。
E.E.S. 400フィルムコート錠。 各錠剤は、エリスロマイシン400mg相当のエリスロマイシンエチルサクシネートを含む。
フィルムコーティング錠は、主に成人または高齢の子供向けである。
Inactive Ingredients
E.E.S. Granules: クエン酸、FD&C Red No.3、ケイ酸アルミニウムマグネシウム、カルボキシメチルセルロースナトリウム、クエン酸ナトリウム、ショ糖、人工香料
E.E.S. 400 film-coated tablets: セルロース系ポリマー、コンフェクショナーズシュガー(トウモロコシデンプンを含む)、トウモロコシデンプン、D&C赤色30号、D&C黄色10号、FD&C赤色40号、マグネシウムステアレート、ポラクリンカリウム、ポリエチレングリコール、プロピレングリコール、クエン酸ナトリウム、ソルビン酸、二酸化チタン
E.E.S.200 Liquid.の略。 FD&C Red No.40、メチルパラベン、ポリソルベート60、プロピルパラベン、クエン酸ナトリウム、スクロース、水、キサンタンガム、天然および人工フレーバー
E.E.S.400 Liquid: D&C黄色10号、FD&C黄色6号、メチルパラベン、ポリソルベート60、プロピルパラベン、クエン酸ナトリウム、スクロース、水、キサンタンガムおよび天然・人工香料。
EES – Clinical Pharmacology
経口投与したエリスロマイシンエチルスクシン懸濁液とフィルムコート錠は容易にそして確実に吸収されています。 エリスロマイシンは、空腹時および非空腹時に同等の血清濃度を達成する。 髄液では通常、低濃度しか得られないが、髄膜炎では血液脳関門を通過する薬剤が増加する。 正常な肝機能がある場合、エリスロマイシンは肝臓で濃縮され、胆汁中に排泄される;肝臓によるエリスロマイシンの胆汁中への排泄に対する肝機能障害の影響は不明である。 経口投与されたエリスロマイシンの量の5%未満が尿中に活性型として排泄される。
エリスロマイシンは胎盤関門を通過するが、胎児の血漿濃度は低い。
微生物学
作用機序
エリスロマイシンは、感受性生物の50Sリボソームサブユニットに結合して、タンパク質合成を阻害することにより作用する。
耐性
耐性の主要な経路は、50Sリボソームサブユニットの23S rRNAが不感受性に変化することであるが、流出も重要であることがある。
他の抗菌薬との相互作用
エリスロマイシンは、クリンダマイシン、リンコマイシン、クロラムフェニコールとの間にin vitroで拮抗作用が存在する。
抗菌活性
エリスロマイシンは、以下の微生物のほとんどの分離株に対してin vitroおよび臨床感染で有効であると示された。
好気性細菌
グラム陽性菌:
Corynebacterium diphtheriae
Corynebacterium minutissimum
Listeria monocytogenes
Staphylococcus aureus (resistant organism may emerge during treatment)
Streptococcus pneumoniae
Streptococcus pyogenes
グラム陰性菌.N:
Bordetella pertussis
Haemophilus influenzae
Legionella pneumophila
Neisseria gonorrhoeae
Other microorganisms.comでは、以下のようになります。
Chlamydia trachomatis
Entamoeba histolytica
Mycoplasma pneumoniae
Treponema pallidum
Ureaplasma urealyticum
以下のin vitroデータはあるが、臨床的意義は不明である。 以下の細菌の少なくとも90%は、類似の属または生物群の分離株に対して、in vitro最小発育阻止濃度(MIC)がエリスロマイシンの感受性ブレイクポイント以下となることを示す。 しかし、これらの細菌によって引き起こされる臨床感染症に対するエリスロマイシンの有効性は、十分な対照臨床試験で確立されていません。
好気性細菌
グラム陽性菌:
ビリダンス群連鎖球菌
グラム陰性菌:
Moraxella catarrhalis
感受性試験
本剤の感受性試験解釈基準及び関連試験方法、FDAが認める品質管理基準に関する特定の情報については、以下をご参照ください。 https://www.fda.gov/STIC.
EESの効能・効果
薬剤耐性菌の発生を抑え、E.E.S.や他の抗菌薬の効果を維持するために、E.E.S.は感受性細菌によることが証明または強く疑われている感染の治療・予防のみに使用すべきとされます。 培養および感受性に関する情報が入手可能な場合は、抗菌薬療法の選択または変更においてそれらを考慮する必要があります。 そのようなデータがない場合、地域の疫学や感受性のパターンが経験的な治療法の選択に寄与する可能性があります
E.E.S. は、以下に示す疾患における指定微生物の感受性株に起因する感染症の治療に適応されます:
Streptococcus pyogenes、Streptococcus pneumoniaeまたはHaemophilus influenzaeによる軽度から中程度の上気道感染症(H. influenzaeの多くの株が通常到達するエリスロマイシン濃度に感受性がないため、十分量のスルホンアミドと併用した場合)。 (
Streptococcus pneumoniae又はStreptococcus pyogenesによる軽度から中等度の重症度の下気道感染症
Listeria monocytogenesによるリステリア症
Bordetella pertussisによる百日咳(thopging cough)。 エリスロマイシンは、感染者の鼻咽頭からこの細菌を除去し、非感染性にするのに有効である。 一部の臨床研究では、エリスロマイシンは曝露された感受性が高い人の百日咳の予防に有用であることが示唆されています。
Mycoplasma pneumoniaeによる呼吸器感染症。
Streptococcus pyogenesまたはStaphylococcus aureusによる軽度から中程度の重症度の皮膚および皮膚構造感染症(耐性ブドウ球菌は治療中に出現する場合があります)
Diphtheria…Therapy in Japan(ジフテリア)。 コリネバクテリウム・ジフテリアによる感染症(抗毒素の補助として、保菌者の定着防止及び保菌者の根絶を目的とする)。 2966><9997>淋菌による急性骨盤内炎症性疾患:淋菌による急性骨盤内炎症性疾患の治療における代替薬として、ペニシリン感受性の既往歴のある女性患者を対象に、淋菌による急性骨盤内炎症性疾患の治療を行う。 淋菌の治療としてエリスロマイシンを投与する前に梅毒の血清学的検査を受け、3ヵ月後に梅毒の血清学的検査をフォローアップすること。
Treponema pallidumによる梅毒:ペニシリン系薬剤にアレルギーのある患者における初発梅毒の治療薬としてエリスロマイシンが選択肢としてあげられる。
エリスロマイシンは、クラミジア・トラコマティスによる次の感染症の治療に適応がある:新生児の結膜炎、乳児期の肺炎、妊娠中の尿路性器感染症。 テトラサイクリン系薬剤が禁忌または忍容性のない場合、エリスロマイシンはクラミジア・トラコマティスによる成人の合併症のない尿道、子宮頸部または直腸感染症の治療に適応されます。
テトラサイクリン系薬剤が禁忌または忍容性のない場合、エリスロマイシンは尿素プラズマ・ウレアリティカムによる非淋菌性の尿道炎に適応されます。
Legionella pneumophilaによるレジオネラ症:臨床効果の対照試験は実施されていないが、in vitroおよび限られた予備臨床データから、エリスロマイシンはレジオネラ症に有効である可能性が示唆されている。
予防
リウマチ熱の初発予防
ペニシリンは、米国心臓協会により、リウマチ熱の初発予防における選択薬とされている(上気道のレンサ球菌感染症の治療、e.g…, 扁桃炎や咽頭炎などの上気道感染症の治療)。 ペニシリンアレルギー患者にはエリスロマイシンが適応となる。
リウマチ熱の再発予防
米国心臓協会では、リウマチ熱の再発予防にはペニシリンまたはスルホンアミドが選択薬とされている。 ペニシリンやスルホンアミドにアレルギーのある患者には、連鎖球菌性咽頭炎の長期予防にエリスロマイシンの経口投与が米国心臓協会により推奨されている(リウマチ熱の再発予防のために)。1
禁忌
エリスロマイシンは、この抗生物質に対する既知の過敏症のある患者には禁忌です。
エリスロマイシンは、テルフェナジン、アステミゾール、ピモジド、またはシサプリド(「注意事項-薬物相互作用」参照)を服用中の患者には禁忌とされています。
横紋筋融解症などの筋障害のリスクが高まるため、CYP 3A4で広範に代謝されるHMG CoA還元酵素阻害剤(スタチン)(ロバスタチンまたはシンバスタチン)とエリスロマイシンを併用しないでください。
警告
肝毒性
エリスロマイシン製剤の経口投与により、肝酵素増加などの肝機能障害、黄疸を伴うまたは伴わない肝細胞炎および/または胆汁性肝炎が発生したとの報告がある。
QT 延長
エリスロマイシンは QT 間隔の延長とまれな不整脈の事例と関連しています。 Torsades de Pointesの症例は、エリスロマイシンを投与された患者における市販後調査中に自発的に報告されている。 致死的な事例も報告されています。 エリスロマイシンは、QT間隔の延長が知られている患者、未補正の低カリウム血症や低マグネシウム血症などの催不整脈状態が続いている患者、臨床的に重大な徐脈の患者、クラスIA(キニジン、プロカインアミド)またはクラスIII(ドフェチリド、アミオダロン、ソタロール)の抗不整脈薬を受けている患者では避けるべきでしょう。 高齢の患者は、QT間隔に対する薬物関連の影響を受けやすいかもしれない。
妊娠中の梅毒
エリスロマイシンが先天性梅毒を防ぐために十分な濃度で胎児に到達しないことを示唆する報告がある。
Clostridium difficile associated Diarrhea
Clostridium difficile associated diarrhea(CDAD)は、E.E.Sを含むほぼすべての抗菌剤の使用で報告されており、軽い下痢から致命的な大腸炎まで重症度の幅がある可能性があります。 抗菌薬による治療は、結腸の正常な細菌叢を変化させ、C. difficileの過剰増殖を引き起こします。
C. difficileは毒素AおよびBを生成し、CDADの発症に寄与しています。 C. difficileの高毒素産生株は、これらの感染症が抗菌療法に抵抗性を示し、大腸切除を必要とすることがあるため、病的状態や死亡率の上昇を引き起こします。 CDAD は、抗生物質の使用後に下痢を呈するすべての患者において考慮する必要があります。 CDADは抗菌薬投与後2か月以上経過してから発症すると報告されているため、慎重な病歴聴取が必要です。
CDADが疑われるか確認された場合、C. difficileに対するものではない抗生物質の使用を継続するには、中止が必要な場合があります。
薬物相互作用
CYP3A4基質とエリスロマイシンを併用している患者において、重篤な有害反応が報告されています。 これらには、コルヒチンによるコルヒチン毒性;シンバスタチン、ロバスタチン、アトルバスタチンによる横紋筋融解;およびCYP3A4によって代謝されるカルシウムチャンネル遮断薬による低血圧(例えば。 エリスロマイシンとコルヒチンの併用によるコルヒチン中毒の市販後報告がある。 この相互作用は生命を脅かす可能性があり、推奨用量で両方の薬剤を使用している間に発生する可能性があります(注意-薬物相互作用の項を参照)。
エリスロマイシンとロバスタチンの併用投与を受けた重症患者において、腎機能障害を伴う、または伴わない横紋筋融解が報告されています。 したがって、ロバスタチンとエリスロマイシンを併用している患者は、クレアチンキナーゼ(CK)および血清トランスアミナーゼ値を注意深く監視する必要があります。 (ロバスタチンの添付文書参照)
使用上の注意
一般
細菌感染が証明または強く疑われていない場合や予防的適応がない場合にエリスマを処方することは、患者にとって有益であるとは考えにくく、薬剤耐性菌の発生のリスクを高めることになります。
エリスロマイシンは主に肝臓で排泄されるため、肝機能が低下している患者に投与する場合は注意が必要です(臨床薬理学および警告の項を参照)。
エリスロマイシン療法を受けた患者において、重症筋無力症の症状の悪化および筋無力症候群の症状の新規発症が報告されている。
エリスロマイシン療法後の乳児に乳児肥大性幽門狭窄症(IHPS)が発生したとの報告がある。 百日咳予防のためにエリスロマイシンを投与された新生児157人のコホートでは、新生児7人(5%)が非胆汁性嘔吐または摂食時の過敏症状を発症し、その後、外科的幽門拡張術を要するIHPSであると診断された。 エリスロマイシンは、重大な死亡率や病的状態(百日咳や新生児クラミジア・トラコマティス感染症など)に関連する乳幼児の疾患の治療に用いられることがあるため、エリスロマイシン治療の有益性とIHPS発症の潜在的危険性を比較検討することが必要である。
エリスロマイシンの長期使用または反復使用により、非感受性細菌または真菌が過剰増殖することがある。
適応がある場合には、切開排膿やその他の外科的処置は抗生物質治療と同時に行う必要があります。
患者への情報
患者には、エリスロンを含む抗菌薬は細菌感染症の治療にのみ使用されるべきであることを説明する必要があります。 ウイルス感染症(例:風邪)の治療には使用できません。 E.E.S.が細菌感染症の治療のために処方された場合、治療の初期には気分が良くなるのが普通ですが、薬は指示通りに正確に服用する必要があることを患者さんに伝える必要があります。 服用を省略したり、治療の全コースを完了しなかったりすると、(1)当面の治療効果が低下し、(2)細菌が耐性を獲得して、将来的にE.E.S.や他の抗菌薬で治療できなくなる可能性が高くなる場合があります。 抗生物質による治療を開始した後、最後に抗生物質を服用してから2カ月以上たっても、水様便や血便(腹痛や発熱の有無は問わない)を起こすことがあります。
薬物相互作用
テオフィリン
テオフィリン大量投与中の患者におけるエリスロマイシン使用は、血清テオフィリン濃度の上昇およびテオフィリン毒性の可能性に関連する可能性がある。 テオフィリン毒性および/または血清テオフィリンレベルの上昇の場合、患者がエリスロマイシン治療を併用している間、テオフィリンの投与量を減らすべきである
エリスロマイシン経口投与がテオフィリンと同時に行われた場合、エリスロマイシン血清濃度の約35%の減少があることを示唆する発表済みの報告が存在する。 この相互作用が起こるメカニズムは不明である。 テオフィリンの併用によるエリスロマイシン濃度の低下により、エリスロマイシンの治療中濃度が低下する可能性がある。
ベラパミル
カルシウム拮抗薬に属するベラパミルを同時に投与した患者で、血圧低下、徐脈、乳酸中毒が観察されたことがある。
ジゴキシン
エリスロマイシンとジゴキシンの併用により、ジゴキシン血清濃度の上昇が報告されている。
抗凝固剤
エリスロマイシンと経口抗凝固剤の併用により抗凝固作用が増強されたとの報告がある。 エリスロマイシンと各種経口抗凝固薬の相互作用による抗凝固作用の増強は、高齢者でより顕著になる可能性があります。
エリスロマイシンはチトクロームp450酵素系(CYP3A)アイソフォーム3Aサブファミリーの基質・阻害剤です。 エリスロマイシンと主にCYP3Aで代謝される薬剤の併用は、薬物濃度の上昇を伴い、併用薬剤の治療効果と副作用の両方を増加または延長させる可能性がある。 用量の調節を考慮することができ、可能であれば、エリスロマイシンを同時投与している患者において、主にCYP3Aによって代謝される薬剤の血清濃度を注意深く監視すべきである。
以下に、CYP3Aベースの臨床的に重要な薬物相互作用のいくつかの例を挙げる。 CYP3Aアイソフォームによって代謝される他の薬物との相互作用も可能である。 市販後の経験では、以下のCYP3Aベースの薬物相互作用がエリスロマイシン製品で観察されている:
エルゴタミン/ジヒドロエルゴタミン
市販後の報告では、エリスロマイシンとエルゴタミンまたはジヒドロエルゴタミンの同時投与は、四肢および中枢神経を含む他の組織の血管痙攣および虚血を特徴とする急性セルゴ中毒に関連していたことが報告されている。 エリスロマイシンとエルゴタミンまたはジヒドロエルゴタミンの併用投与は禁忌です(禁忌の項参照)。
トリアゾロベンゾジアゼピン(トリアゾラム、アルプラゾラムなど)および関連ベンゾジアゼピン
エリスロマイシンはトリアゾラムおよびミダゾラムのクリアランスを低下させると報告しており、したがってこれらのベンゾジアゼピンの薬理作用を高める可能性があります。
HMG-CoA 還元酵素阻害剤
エリスロマイシンは、HMG-CoA 還元酵素阻害剤(e…, ロバスタチンおよびシンバスタチン)。
シルデナフィル(バイアグラ)
エリスロマイシンはシルデナフィルの全身曝露量(AUC)を増加させることが報告されている。 シルデナフィルの投与量の減量を検討する必要があります。 (バイアグラの添付文書参照)
エリスロマイシンとシクロスポリン、カルバマゼピン、タクロリムス、アルフェンタニル、ジソピラミド、リファブチン、キニジン、メチルプレドニゾロン、シロスタゾール、ビンブラスチンおよびブロモクリプチンはCYP3Aベースの相互作用を示す自発報告または公表報告がある。
エリスロマイシンとシサプリド、ピモジド、アステミゾール、テルフェナジンとの併用は禁忌である(禁忌の項参照)。
さらに、ヘキソバルビタール、フェニトイン、バルプロ酸など、CYP3Aで代謝されると考えられていない薬剤とエリスロマイシンの相互作用の報告があります。
エリスロマイシンは併用した場合、非鎮痛抗ヒスタミン薬のテルフェナジンおよびアステミゾールの代謝に大きな変化を与えると報告されています。 まれに心電図上のQT/QTc間隔延長、心停止、Torsades de Pointes、その他の心室性不整脈などの重篤な心血管系有害事象が認められています(併用禁忌の項をご参照ください)。 また、テルフェナジンとエリスロマイシンの併用により、まれに死亡例が報告されています。
エリスロマイシンとシサプリドの併用により、QT延長、心不整脈、心室頻拍、心室細動、Torsades de Pointesが発生し、エリスロマイシンによるシサプリドの肝代謝阻害が原因と考えられる薬剤相互作用を市販後報告されています。 コルヒチンは、CYP3A4および排出トランスポーターであるP-糖蛋白(P-gp)の両方の基質であることが報告されている(禁忌を参照)。 エリスロマイシンはCYP3A4の中程度の阻害剤と考えられている。 エリスロマイシン等の中等度CYP3A4阻害剤と併用した場合、コルヒチンの血漿中濃度の著しい上昇が予想されるため、エリスロマイシン等の中等度CYP3A4阻害剤と併用した場合、コルヒチンの血漿中濃度の著しい上昇が予想されます。 コルヒチンとエリスロマイシンの併用が必要な場合、コルヒチンの開始用量を減らし、コルヒチンの最大投与量を下げる必要があります。 コルヒチン中毒の臨床症状について患者をモニターすること(警告を参照)<2966><1259>薬剤/臨床検査相互作用<9684><9997>エリスロマイシンは尿中カテコールアミンの蛍光測定に干渉する。
発がん性、変異原性、生殖能力障害
ステアリン酸エリスロマイシンを用いたラットでは400mg/kg/日まで、マウスでは約500mg/kg/日(体表面積基準でヒト最大用量の約1~2倍)までの長期経口食試験で、腫瘍原性の証拠を得ることはできなかった。 ステアリン酸エリスロマイシンは,エームス試験,マウスリンパ腫試験で遺伝毒性を示さず,CHO細胞で染色体異常を誘発しなかった. 700mg/kg/日(体表面積ベースでヒトの最大用量の約3倍)のエリスロマイシン塩基を経口投与したラットでは、雄または雌の生殖能力に明らかな影響は見られませんでした。
妊娠
催奇形性
交配前および交配中、妊娠中、離乳までの間、エリスロマイシンベースを350mg/kg/日(体表面積ベースでヒトの最大推奨量の約2倍)経口投与した雌ラットの催奇形性や生殖に対するその他の悪影響は認められませんでした。
妊娠中のラット及びマウスにエリスロマイシン塩基を700mg/kg/日及び妊娠中のウサギに125mg/kg/日(ヒトの最大推奨用量の約1~3倍)を経口投与しても催奇形性及び胚毒性は認められなかった。
陣痛と出産
エリスロマイシンの陣痛と出産に対する効果は不明である。
授乳婦
エリスロマイシンはヒト乳汁中に排泄される。 エリスロマイシンを授乳婦に投与する場合は注意すること。
小児用
用法・用量および用法・用量の項を参照すること。
高齢者使用
高齢者、特に腎臓または肝臓の機能が低下している患者は、エリスロマイシンによる難聴を発症するリスクが高い場合があります(有害反応および用法・用量の項を参照)。
高齢の患者は、若い患者よりもtorsades de pointes不整脈の発生を受けやすい場合があります(警告を参照)。
高齢の患者は、エリスロマイシンによる治療を受けている間に経口抗凝固療法の効果が高まる場合があります(注意事項 – 薬物相互作用の項を参照)。
E.E.S.® Granules are 25.9 mg (1.1 mEq) of sodium per individual dose.
the geriatric population may respond with a blunted natriuresis to salt loading.
The geriatric population may be blunted natriuresis to the blunted salt loading.
The general features with a single usage.
E.E.S. 400 film-coated は、1錠あたりナトリウム47mg(2mEq)およびカリウム10.0mg(0.3mEq)を含む。
副作用
エリスロマイシンの経口製剤の最も頻繁な副作用は胃腸で、用量関連である。 吐き気、嘔吐、腹痛、下痢、食欲不振などである。 肝炎の症状、肝機能障害および/または肝機能検査結果の異常が起こることがあります(警告のセクションを参照)。
偽膜性大腸炎の症状の発現は、抗菌薬治療中または治療後に起こることがあります(警告のセクションを参照)。
エリスロマイシンは、QT延長および心室性頻拍やTorsades de Pointesなどの心室性不整脈と関連しています(警告の項参照)
蕁麻疹からアナフィラキシーまでのアレルギー反応が発現しています。 軽度の発疹から多形紅斑、スティーブンス-ジョンソン症候群、中毒性表皮壊死症までの皮膚反応がまれに報告されています。
エリスロマイシンの使用と同時に間質性腎炎の報告があります。
膵炎と痙攣のまれな報告があります。
可逆性難聴は、主に腎不全の患者とエリスロマイシンの高用量を投与されている患者で発生した孤立した報告があります。
過量投与
過量投与の場合、エリスロマイシンは中止されるべきです。 過量投与時には、吸収されなかった薬剤を速やかに除去するなど、適切な処置を行うこと。
エリスロマイシンは、腹膜透析や血液透析では除去されない。
EESの用法・用量
エリスロマイシンエチルサクシネート懸濁液およびフィルムコート錠は食事を気にせず投与できる。
小児
年齢、体重および感染の重症度は、適正投与量を決定するうえで重要な要因である。 軽度から中等度の感染症では、小児に対するエリスロマイシンエチルサクシネートの通常用量は30~50mg/kg/日、6時間ごとに等分して投与する。 より重症の感染症には、この投与量を2倍にすることができる。 1日2回の投与が必要な場合は、1日の総投与量の半分を12時間ごとに投与することができる。 また、1日3回投与する場合は、1日量の3分の1を8時間おきに投与することができる。
軽度から中等度の感染症には、次の投与スケジュールが提案されています。
| 体重 | 1日総量 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 10ポンド以下 | 30から 50mg/kg/日 15~25mg/lb/日 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10~15 lbs | 200 mg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 16~25 lbs | 400 mg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 26 から 50 lbs | 800 mg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 51 から 100 lbs | 1200 mg | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 100 を超える重量 エリスロマイシンエチルサクシネート400mgを6時間おきに投与するのが通常である。 なお、感染の程度に応じて1日4gまで増量することができる。 なお、1日2回の投与を希望する場合は、1日の総用量の2分の1を12時間おきに投与することができる。 また、1日用量の3分の1を8時間ごとに投与することにより、1日3回投与することもできる。
成人の投与量計算には、エチルサクシネートとしてエリスロマイシン活性400mg、ステアレート、ベースまたはエストレートとしてエリスロマイシン活性250mgの比率を用いてください。 なお、リウマチ性心疾患の既往のある患者における溶連菌感染症の再発予防のための継続投与では、通常、1回400mgを1日2回投与する<2966><1259>C. trachomatis又はU. urealyticumによるUrethritisの治療<9684><9997>800mg 1回3回、7日間。 原発性梅毒の治療成人 48~64gを10~15日間かけて分割投与 腸管アメーバ症の治療成人 400mg/日4回、10~14日間。 小児 30~50mg/kg/日、10~14日間に分けて分割投与する。 百日咳に用いる場合至適投与量及び期間は確立されていないが、報告されている臨床試験におけるエリスロマイシンの投与量は40~50mg/kg/日で、5~14日間分割投与されている。 レジオネラ症の治療至適投与量は確立されていないが、報告されている臨床データでは、上記の推奨量(1日1.6~4g、分割投与)であった エイズ顆粒100mL 77mLの水を加え、激しく振り混ぜる。 200 mL 水154 mLを加え、よく振り混ぜる。 How is EES SuppliedE.E.S. Granules 200mg per 5 mL(erythromycin ethylsuccinate for oral suspension, USP)は、チェリーの香りのするピンク色の顆粒で、100 mL (NDC 24338-134-02) および 200 mL (NDC 24338-136-10) の瓶で提供されます。 E.E.S.顆粒は、再構成後、チェリーの香りのするピンク色の不透明な懸濁液となります。 400フィルムコート錠(エリスロマイシン エチルサクシネート錠、USP)400mgは、EEと刻印されたピンク色の楕円形の錠剤で、 30瓶(NDC 24338-100-03) 100瓶(NDC 24338-100-13) 推奨保管条件20°~25°C (68°~77°F) で保管すること。 混合前の顆粒は、20°~25°C で保存してください。
Revised: 2018年4月 アーバー・ファーマシューティカルズ LLC (No. 5729, 6369) PRINCIPAL DISPLAY PANEL – 400 mg TabletボトルラベルNDC 24338-100-03 E.E.S.? 400® ERYTHROMYCIN 400 mg Rx only arbor  PRINCIPAL DISPLAY PANEL – 100 mL Bottle LabelNDC 24338-134-02 E.E.S.®顆粒 ERYTHROMYCIN Erythromycin activity Rx only arbor®  PRINCIPAL DISPLAY PANEL – 5 mL Bottle LabelNDC 24338-136-10 E.L. ERYTHROMYCIN Erythromycin activity Rx only arbor® 
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||