Introduction
Nach Angaben der Weltgesundheitsorganisation sind weltweit schätzungsweise 350 Millionen Menschen von Depressionen betroffen (Organisation, 2017). Patienten mit Depressionen zeigen Symptome von Angststörungen und gehen mit der Unfähigkeit, Freude und Interesse zu empfinden, Konzentrationsverlust, Selbstzweifeln, sozialen Ängsten, Schlaf- und Appetitstörungen einher (Namola et al., 2015). Die Hauptfaktoren, die Depressionen verursachen, sind ein Ungleichgewicht von Chemikalien oder Hormonen im Gehirn. Das wichtigste Hormon, das mit Depressionen in Verbindung gebracht wird, ist Serotonin. Andere Hormone sind Norepinephrin und Dopamin (Yi et al., 2008). Diese Hormone sind für eine normale Gehirnfunktion und die Steuerung von Gefühlen notwendig. Die Zerstörung dieser Hormone kann ein chemisches Ungleichgewicht im Gehirn verursachen, das zu einer Depression führt.
Depressionen können je nach Schweregrad durch Psychotherapie oder Medikamente behandelt werden. Antidepressiva sind die wichtigsten Medikamente, die zur Behandlung von Depressionen eingesetzt werden. Es gibt viele verschiedene Arten von Antidepressiva, die sich nur in der Art ihrer Wirkung auf das Gehirn, ihren Kosten und ihrem Nebenwirkungsprofil unterscheiden. In der Erstbehandlung wird den meisten Patienten entweder ein trizyklisches Antidepressivum (TCA) oder ein selektiver Serotonin-Wiederaufnahmehemmer (SSRI; McCarthy et al., 2016) verschrieben. Die Medikamente, die üblicherweise zur Behandlung von Angstzuständen eingesetzt werden, sind Benzodiazepine. Obwohl es viele Antidepressiva auf dem Markt gibt, die zur Behandlung von Depressionen eingesetzt werden, sind die Nachwirkungen der Einnahme dieser Medikamente sehr bedenklich (Binfaré et al., 2009). Eine alternative Therapie der Depression ist die Verwendung von pflanzlichen Arzneimitteln (Fajemiroye et al., 2016). Die Verwendung von Kräuterextrakten findet in der Ärzteschaft und bei den Patienten immer mehr Akzeptanz. Bei den meisten pflanzlichen Heilmitteln, die zur Behandlung von Depressionen eingesetzt werden, handelt es sich um Rohextrakte oder halbvergorene Extrakte (Calixto et al., 2000; Carlini, 2003; Guan und Liu, 2016).
Es gibt nur wenige Forschungsberichte über den Wirkstoff, der eine Wirkung auf das zentrale Nervensystem (ZNS) ausüben kann. Eine Übersichtsarbeit von Carlini (2003) enthält nur Informationen über psychoanaleptische, psycholeptische und psychodysleptische Wirkungen. In einer neueren Übersichtsarbeit von Guan und Liu (2016) wurde die Struktur-Aktivitäts-Beziehung der antidepressiven Wirkungen von Flavonoiden aus natürlichen und synthetischen Quellen erörtert. Synthetische Indolalkaloide, ihre Aktivität und potenzielle Verwendung in der Medizin wurden bereits in mehreren Artikeln untersucht (de Sa et al., 2009). Es wurde jedoch noch keine Übersichtsarbeit veröffentlicht, die isolierte pflanzliche Indolalkaloide mit antidepressiver Aktivität in Verbindung bringt. Die vorliegende Übersichtsarbeit liefert Informationen über das Potenzial natürlicher Indolalkaloide für die Behandlung neurologischer Störungen, Studien zur Struktur-Wirkungs-Beziehung sowie über deren Vergleich mit anderen bioaktiven Metaboliten als potenzielle antidepressive Wirkstoffkandidaten aus der Perspektive der chemischen Struktur. Der Artikel wurde durch eine bibliografische Untersuchung wissenschaftlicher Zeitschriften und einschlägiger Literatur zusammengestellt, die in den elektronischen Datenbanken des Web of Science gefunden wurde.
Antidepressive Pflanzen
Dieser Übersichtsartikel befasst sich mit Pflanzen, die eine Wirkung auf das ZNS haben. Obwohl viele Pflanzenarten in diese Kategorie fallen, werden hier nur Pflanzen mit antidepressiven Eigenschaften vorgestellt. Zwei Pflanzen, die Indolalkaloide enthalten, sind Passiflora incarnata L. (Passionsblume) und Mitragyna speciosa (Korth.) Havil (Kratom), während die beiden anderen Pflanzen, bei denen keine Indolalkaloide nachgewiesen wurden, Piper methysticum G. Forst (Kava) und Valeriana officinalis L., besondere Aufmerksamkeit verdienen. Die chemische Struktur der isolierten Verbindungen aus diesen Pflanzen kann als Grundlage für die Entwicklung neuer Medikamente dienen.
Passiflora incarnata und andere Arten wie P. alata Curtis, P. coerulea L. und P. edulis Sims werden in den meisten europäischen Ländern und in Amerika als Beruhigungsmittel in der traditionellen Medizin verwendet (Houghton und Seth, 2003). Die Struktur der Benzodiazepine besteht aus einem Benzolring, der mit einem Diazepin-System verschmolzen ist, das eine siebengliedrige heterozyklische Einheit mit zwei Stickstoffatomen in den Positionen 1 und 2 des Rings umfasst. Die aus P. incarnata isolierten Indolalkaloide Harman, Harmol, Harmin, Harmalol und Harmalin bestehen aus einem Benzolring, der an einen fünfgliedrigen Heterozyklus mit einem Stickstoffatom kondensiert ist.
Verschiedene Studien haben gezeigt, dass P. incarnata ein ähnliches pharmakologisches Profil wie Benzodiazepine aufweist und über Gamma-Aminobuttersäure (GABA)-Rezeptoren wirkt (Jawna-Zboiñska et al., 2016). Die Blätter von M. speciosa werden in der traditionellen Medizin zur Behandlung von Durchfall, Diabetes und zur Verbesserung der Durchblutung verwendet (Vicknasingam et al., 2010). Mitragynin ist das wichtigste Indolalkaloid in M. speciosa mit seinen Analoga Speciogynin, Paynanthein und Speciociliatin (León et al., 2009). Zwei Studien, die mit dem wässrigen Extrakt und dem Alkaloidextrakt von M. speciosa durchgeführt wurden, haben eine antidepressive Wirkung bei Mäusen mit verzweifeltem Verhalten gezeigt (Kumarnsit et al., 2007). Eine von Idayu et al. (2011) durchgeführte Studie über Mitragynin zeigt die Wirkung von Antidepressiva in Tierverhaltensmodellen der Depression durch die Interaktion mit der Hypothalamus-Hypophysen-Nebennieren-Achse (HPA) im neuroendokrinen System (Idayu et al., 2011).
Piper methysticum G. Forst wird als Getränk namens Kava konsumiert, das einen angenehmen mentalen Zustand in Richtung eines Gefühls der Fröhlichkeit induziert und gleichzeitig Müdigkeit und Angst reduziert (Bilia et al., 2002). Die Studie zeigt, dass der fettlösliche Extrakt im Vergleich zum wässrigen Extrakt den größten Teil der pharmakologischen Aktivitäten beibehält. Der fettlösliche Extrakt enthält mindestens sieben Pyrane, die als Kavalactone bekannt sind. Kavalactone interagieren im Allgemeinen mit den dopaminergen, serotonergen, gamma-Aminobuttersäure (GABA) und glutamatergen Neurotransmissionen, verhindern die Monoaminoxidase B (MOB) und haben auch eine Reihe von Auswirkungen auf Ionenkanäle (Grunze et al., 2001). Dihydromethysticin ist eines der sechs wichtigsten Kavalactone, die in der Kava-Pflanze vorkommen. Die Struktur von Dihydromethysticin besteht aus einem Arylethylen-α-Pyron, das an eine indolartige Einheit gebunden ist, die zwei Sauerstoffatome anstelle von Stickstoffatomen enthält. Es trägt zu einer anxiolytischen Wirkung bei und wirkt als Antidepressivum. In doppelblinden, placebokontrollierten Studien wurde nachgewiesen, dass Kavalactone anxiolytisch wirken, ohne die mentalen und motorischen Funktionen zu beeinträchtigen, und die Schlafqualität verbessern. Kavalactone sind eine Alternative, um die Verwendung von Benzodiazepinen in der Depressionstherapie zu ersetzen (Malsch und Kieser, 2001).
Valeriana officinalis L., auch bekannt als Baldrian, wird in vielen Ländern als Sedativum, Antikonvulsivum, für hypnotische Effekte und anxiolytische Aktivität verwendet (Ghaderi und Jafari, 2014). Valerensäure und Valepotriate sind als Wirkstoffe in pharmazeutischen Präparaten bekannt, und kommerzielle Rohextrakte aus Baldrian werden in vielen Ländern verwendet (Bos et al., 2002). Valepotriate, die aus Triestern von Polyhydroxycyclopenta-(c)-pyranen mit den Carbonsäuren Essigsäure, Valerensäure, Isovalerensäure, α-Isovaleroxy-Isovalerensäure, β-Methylvalerensäure, β-Acetoxy-Isovalerensäure, β-Hydroxyisovalerensäure und β-Acetoxy-β-Methylvalerensäure bestehen, werden als Beruhigungsmittel verwendet. Valepotriate sind instabil, thermolabil und zersetzen sich schnell unter sauren oder alkalischen Bedingungen in Wasser sowie in alkoholischen Lösungen (Bos et al., 2002). Valepotriate sind nützlich bei der Verbesserung des Zustands von Tieren und Menschen während des Entzugs von Benzodiazepinen (Poyares et al., 2002).
Obwohl es eine Vielzahl verschiedener chemischer Bestandteile gibt, wird der Wirkungsmechanismus als Interaktion von Baldrian mit dem GABA-System im Gehirn durch Hemmung der GABA-Transaminase, die Interaktion mit dem GABA-Rezeptor/Benzodiazepin und die Störung der Aufnahme und Aufnahme-Rekrutierung von GABA in Synaptosomen beschrieben (Sichardt et al., 2007). Zur Untersuchung der antidepressiven Wirkung von Pflanzen wurden verschiedene Modelle verwendet. Die pharmakodynamischen Modelle umfassen In-vitro-, In-vivo- und klinische Modelle, die zur Bewertung der Wirkungen eingesetzt wurden (Tabelle 1). Die meisten der untersuchten Pflanzenarten wurden in vivo untersucht, einige wenige in vitro und nur Kava wurde in klinischen Studien untersucht. In allen Fällen müssen weitere Untersuchungen durchgeführt werden, um die Wirkstoffe und die wirksamste Dosis zu ermitteln und um festzustellen, ob diese zwischen den verschiedenen Arten von Depressionen variiert.

TABELLE 1. Informationen zu pharmakologischen Studien der untersuchten Pflanzen.
Indolalkaloide
Indolalkaloide haben eine bicyclische Struktur, die aus einem sechsgliedrigen Benzolring besteht, der an einen fünfgliedrigen, stickstoffhaltigen Pyrrolring kondensiert ist. Dieser Pyrrolring mit Stickstoffatom verleiht den Indolalkaloiden ihre grundlegenden Eigenschaften, die sie pharmakologisch besonders wirksam machen (El-Sayed und Verpoorte, 2007). Indolalkaloide sind weit verbreitet in Pflanzen, die zu den Familien Apocynaceae, Loganiaceae, Rubiaceae und Nyssaceae gehören. Zu den wichtigen Indolalkaloiden, die aus Pflanzen isoliert wurden, gehören das blutdrucksenkende Mittel Reserpin aus Rauvolfia serpentina (Sagi et al., 2016) und die starken Antitumormittel Vinblastin und Vincristin aus Catharanthus roseus (El-Sayed und Verpoorte, 2007). Studien über die Wirksamkeit von Indolalkaloiden bei der Behandlung von Depressionen sind nicht neu und werden bereits seit 1952 durchgeführt, aber bisher hat die wissenschaftliche Gemeinschaft den Vorteilen des therapeutischen Nutzens von Pflanzen mit antidepressiven Eigenschaften nur wenig Aufmerksamkeit geschenkt.
Indolalkaloide werden häufig mit der Funktion von G-Protein-Rezeptoren in Verbindung gebracht, insbesondere für die neuronale Signalübertragung durch Rezeptoren für Serotonin (5-HT/Hydroxytryptamin). Neben dem Wasserstoffdonator über freies N-H trägt die Anwesenheit der π-Elektronendichte zur Energie des höchstbesetzten Molekülorbitals (HOMO) des planaren Indolskeletts bei. Dies ermöglicht eine Wechselwirkung mit Nukleobasen, insbesondere protonierten Atomen, sowie mit Zielproteinen (de Sa et al., 2009). Die chemische Struktur des Neurotransmitters Serotonin basiert auf einem elektronenreichen aromatischen Indolring. Das Vorhandensein eines Stickstoffatoms im Indolring dient dazu, das aromatische System aufrechtzuerhalten und macht die N-H-Bindung eher sauer als den Stickstoff basisch. Der Indolring ist in der Lage, über den N-H-Teil Wasserstoffbrückenbindungen und über den aromatischen Teil π-π-Stapelungen oder Kationen-π-Wechselwirkungen zu bilden (Shimazaki et al., 2009). Die Hydrophobie der Indolringe ist fast die gleiche wie die der Phenyluntereinheit und weniger hydrophob als die der klassischen isosterischen Benzothiophen- und Benzofuranringe. Die N-H-Indolgruppe spielt eine entscheidende Rolle bei der Interaktion mit dem Ziel-Biorezeptor, während synthetisierte Benzothiophen- und Benzofuran-Derivate eine mäßige bis begrenzte Affinität für den Ziel-Biorezeptor aufweisen (de Sa et al., 2009). Reserpin ist eines der Beispiele für Indolalkaloide, die in den letzten 60 Jahren isoliert wurden und eine sedierende Wirkung auf das ZNS haben. Übrigens sind zwei im Gehirn vorkommende Chemikalien, nämlich Tryptamin und Serotonin, ebenfalls Indolalkaloid-Derivate.
Zurzeit ist noch unklar, welche aktiven Bestandteile von Pflanzenextrakten für die antidepressive Wirkung verantwortlich sind. Daher versuchen wir, einige wichtige chemische Strukturen zu identifizieren, die aus Pflanzenextrakten mit antidepressiver Wirkung isoliert wurden, und die Ähnlichkeit der Skelettmuster zu ermitteln, die zur antidepressiven Wirkung beitragen könnten. Es wurden bereits früh Versuche unternommen, strukturelle Ähnlichkeiten zwischen Serotonin und Indolalkaloiden zu identifizieren. Die deutlichste Ähnlichkeit besteht in sechsgliedrigen heterozyklischen Ringen, die mit fünfgliedrigen Ringen verschmolzen sind. Der Unterschied besteht im Vorhandensein eines Stickstoffatoms oder der Verteilung der π-Elektronen (Abbildung 1). In einer Studie zur Struktur-Aktivitäts-Beziehung berichtete Nichols (2012), dass die unterschiedliche Aktivität der verschiedenen Molekülarten darauf schließen lässt, dass der Rezeptor sehr empfindlich auf die Art des Tryptamins reagiert. Andere chemische Verbindungen, die erfolgreich aus antidepressiven Pflanzen isoliert wurden, werden in dieser Übersichtsarbeit erwähnt, weil sie möglicherweise spezifische Agonisten mit bestimmten Substitutionsmustern sind, die in der Lage sind, eine Untergruppe von Effektoren selektiv zu aktivieren. Dieses Phänomen ist heute als funktionelle Selektivität bekannt.
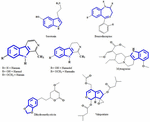
Abbildung 1. Chemische Strukturen von Serotonin, Benzodiazepin und isolierten Verbindungen aus antidepressiven Pflanzen. Ähnlichkeit im Skelettmuster, das aus sechsgliedrigen heterozyklischen Ringen besteht, die mit fünfgliedrigen Ringen verbunden sind.
Serotonin ist als endogener Rezeptoragonist für die Gehirnfunktion und Kognition weit verbreitet (Fink und Göthert, 2007). Serotonin übt seine Funktionen über sieben Rezeptorfamilien aus (5-HT1-5-HT7), die zur Familie der G-Protein-gekoppelten Rezeptoren gehören. Eine Reihe von Verbindungen, die den Indol-Anteil tragen, wurden mit einer Affinität zu verschiedenen Serotoninrezeptoren beschrieben (Kochanowska-Karamyan und Hamann, 2010). Die strukturelle Ähnlichkeit der Indolalkaloide (exogene Agonisten) mit endogenen Neurotransmittern wie Serotonin hat Forscher dazu veranlasst, die potenzielle neurologische Aktivität dieser Moleküle vorherzusagen. Ein Schema der mit der Neurotransmission exogener Agonisten verbundenen Prozesse ist in Abbildung 2 dargestellt.
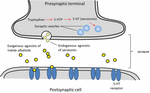
ABBILD 2. Schematische Darstellung der mit der Neurotransmission verbundenen Prozesse. Exogene Agonisten von Indolalkaloiden aus Pflanzen, die strukturelle Ähnlichkeiten mit Serotonin aufweisen, so dass sie an Serotoninrezeptoren (5-HT-Rezeptoren) binden können.
Der Indolring ist auch als Bioisosteres bekannt und hat ähnliche chemische und physikalische Eigenschaften wie biologische Moleküle. Diese Ähnlichkeit wird bei der Entwicklung des Prototyps eines Medikaments genutzt, um die pharmakologische Aktivität zu verbessern und das pharmakokinetische Profil zu optimieren. In einer anderen Studie zur pharmakologischen Bewertung von Benzofuranen und Thienopyrrolen wurden bioisostere Moleküle gefunden, die eine Dimethyltryptamin-ähnliche Aktivität besitzen. Frühe Arbeiten mit Benzothiophenen und 3-Indenalkylaminen zeigten, dass die Fähigkeit von Verbindungen ohne Ringsubstituenten, im Rattenfundus als Agonisten zu wirken, in etwa der von Tryptaminen entsprach. Die Ergebnisse zeigten, dass der Indol-NH für die Aktivierung des 5-HT2-Rezeptors im Rattenfundus nicht wesentlich ist (Nichols, 2012). Eine Reihe von 2-Aryl-Indol-NK1-Rezeptorantagonisten und ihre Derivate sind gute Liganden, haben aber eine geringe orale Bioverfügbarkeit bei Ratten. Um die Löslichkeit und Absorption zu erhöhen, wurde der basische Stickstoff eingeführt, was zu dem analogen Azaindol und verwandten Verbindungen führte, die die gleiche NK1-Bindungsaffinität wie die Reihe der 2-Aryl-Indol-NK1-Rezeptor-Antagonisten aufweisen (Cooper et al., 2001). Das molekulare Docking von zwei von Phenyl-Indol abgeleiteten Liganden mit Serotonin-5-HT6- und Melanocortin-4-Rezeptoren deutet darauf hin, dass das privilegierte Gerüst je nach Art der konservierten Subtasche und der nicht konservierten Bindungstasche angepasst werden kann. Interaktionen von nicht konservierten Teilen der Bindungstasche sind für wichtige Unterschiede in der molekularen Erkennung durch den entsprechenden Zielrezeptor verantwortlich (Bondensgaard et al, 2004).
Nach de Sa et al. (2009) sind häufige Indolalkaloide, die in natürlichen Quellen gefunden werden, Tryptophan-Aminosäuren in der menschlichen Ernährung und die Entdeckung von Pflanzenhormonen, die therapeutische Wirkungen haben, wie z. B. entzündungshemmend, ein Phosphodiesterase-Hemmer, 5-HT-Rezeptor-Agonisten und -Antagonisten, Cannabinoid-Rezeptor-Agonisten und HMG-CoA-Reduktase-Hemmer. Das Indolgerüst hat Bindungstaschen und besitzt eine gemeinsame komplementäre Bindungsdomäne zum Zielrezeptor, der zu einer Klasse von GPCRs (G-Protein-gekoppelte wichtige Membranrezeptoren) gehört. Die meisten auf dem Markt befindlichen Arzneimittel enthalten die Indol-Substruktur. Dazu gehören Indomethacin, Ergotamin, Frovatriptan, Ondansetron und Tadalafil.
Schlussfolgerung
Diese Überprüfung ergab, dass die meisten pflanzlichen Heilmittel, die für die Behandlung psychiatrischer Beschwerden angegeben werden, roh oder halbveredelt sind. Die Ergebnisse für in vivo und in vitro variieren und waren nicht reproduzierbar, da der Gehalt an Sekundärmetaboliten der Pflanzen in verschiedenen biogeografischen Regionen mit der Verfügbarkeit von Nährstoffen, dem Klima und den ökologischen Bedingungen korreliert. Außerdem kann die Bioaktivität von Pflanzen auf eine einzelne Verbindung oder eine Mischung von Verbindungen zurückzuführen sein. Die Autoren schlagen vor, dass die Bemühungen um die Gewinnung von Wirkstoffen, die Identifizierung von Phytochemikalien und Metabolomics-Studien mit In-vitro- und In-vivo-Inspektionen durchgeführt werden sollten, um eine bessere Charakterisierung von Medikamenten auf Pflanzenbasis zu ermöglichen. In den meisten Fällen wurde die Synthese von Indolalkaloiden durch die natürlich vorkommenden Moleküle und ihre Ähnlichkeit mit Serotonin inspiriert.
Die Indolalkaloide aus pflanzlichen Quellen sind im Vergleich zu synthetischen recht komplex. Die Bedeutung der synthetischen Indolalkaloide ist bereits bekannt, da die Struktur in verschiedenen Ligandenrezeptoren, Enzyminhibitoren und Modulatoren von Biorezeptoren vorhanden ist. Einige der natürlich vorkommenden Indolalkaloide können mit den derzeit bekannten Methoden nicht synthetisiert werden. Darüber hinaus wurden die meisten Informationen über die Wirksamkeit von Indolalkaloiden aus synthetischen Indolalkaloiden gewonnen. Infolgedessen ist das Potenzial vieler natürlich vorkommender Indolalkaloide als neue Arzneimittel für verschiedene psychiatrische Erkrankungen noch nicht ausgeschöpft. In der Vergangenheit waren pflanzliche Verbindungen die Quelle für einige der erfolgreichsten Wirkstoffkandidaten oder Medikamente, die in der Medizin eingesetzt werden. Dies deutet darauf hin, dass es noch mehr zu entdecken gibt.
Zusammenfassend lässt sich sagen, dass mehrere Indolalkaloide als Antidepressiva eingesetzt wurden oder Leitstrukturen für ihre Entwicklung liefern. Nach unseren Erkenntnissen enthalten Pflanzen ein Reservoir an Indolalkaloiden, die wertvolle Ansatzpunkte für die Entwicklung künftiger Antidepressiva darstellen.
Beiträge der Autoren
HH: Vorbereitung des Manuskripts. MY: Editieren der englischen Sprache und Vorschlagen wichtiger Informationen zur Verbesserung des Manuskripts. AR: Beitrag zum Verständnis des Schemas der mit der Neurotransmission verbundenen Prozesse.
Finanzierung
Diese Arbeit wurde von der Universiti Malaysia Pahang durch das Forschungsstipendium UMP RDU170302 für HH unterstützt.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Bilia, A. R., Gallori, S., und Vincieri, F. F. (2002). Kava-Kava und Angstzustände: wachsende Erkenntnisse über die Wirksamkeit und Sicherheit. Life Sci. 70, 2581-2597. doi: 10.1016/S0024-3205(02)01555-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Binfaré, R. W., Rosa, A. O., Lobato, K. R., Santos, A. R., und Rodrigues, A. L. S. (2009). Die Verabreichung von Ascorbinsäure erzeugt eine antidepressiv-ähnliche Wirkung: Hinweise auf die Beteiligung der monoaminergen Neurotransmission. Prog. Neuropsychopharmacol. Biol. Psychiatry 33, 530-540. doi: 10.1016/j.pnpbp.2009.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Bondensgaard, K., Ankersen, M., Thøgersen, H., Hansen, B. S., Wulff, B. S., and Bywater, R. P. (2004). Erkennung von privilegierten Strukturen durch G-Protein-gekoppelte Rezeptoren. J. Med. Chem. 47, 888-899. doi: 10.1021/jm0309452
PubMed Abstract | CrossRef Full Text | Google Scholar
Bos, R., Woerdenbag, H. J., and Pras, N. (2002). Determination of valepotriates. J. Chromatogr. A 967, 131-146. doi: 10.1016/S0021-9673(02)00036-5
CrossRef Full Text | Google Scholar
Calixto, J. B., Beirith, A., Ferreira, J., Santos, A. R., and Yunes, R. A. (2000). Natürlich vorkommende antinozizeptive Substanzen aus Pflanzen. Phytother. Res. 14, 401-418. doi: 10.1002/1099-1573(200009)14:6<401::AID-PTR762>3.0.CO;2-H
PubMed Abstract | CrossRef Full Text | Google Scholar
Carlini, E. (2003). Pflanzen und das zentrale Nervensystem. Pharmacol. Biochem. Behav. 75, 501-512. doi: 10.1016/S0091-3057(03)00112-6
CrossRef Full Text | Google Scholar
Cooper, L. C., Chicchi, G. G., Dinnell, K., Elliott, J. M., Hollingworth, G. J., Kurtz, M. M., et al. (2001). 2-Aryl-Indol-NK-1-Rezeptor-Antagonisten: Optimierung der Indol-Substitution. Bioorg. Med. Chem. Lett. 11, 1233-1236. doi: 10.1016/S0960-894X(01)00182-2
CrossRef Full Text | Google Scholar
de Sa, A., Fernando, R., Barreiro, E. J., Fraga, M., and Alberto, C. (2009). Von der Natur zur Arzneimittelentdeckung: das Indolgerüst als „privilegierte Struktur“. Mini Rev. Med. Chem. 9, 782-793. doi: 10.2174/138955709788452649
CrossRef Full Text | Google Scholar
El-Sayed, M., and Verpoorte, R. (2007). Catharanthus terpenoid indole alkaloids: biosynthesis and regulation. Phytochem. Rev. 6, 277-305. doi: 10.1007/s11101-006-9047-8
CrossRef Full Text | Google Scholar
Fajemiroye, J. O., Silva, D. M., Oliveira, D. R., and Costa, E. A. (2016). Behandlung von Angstzuständen und Depressionen: Heilpflanzen im Rückblick. Fundam. Clin. Pharmacol. 30, 198-215. doi: 10.1111/fcp.12186
PubMed Abstract | CrossRef Full Text | Google Scholar
Fiebich, B. L., Knörle, R., Appel, K., Kammler, T., and Weiss, G. (2011). Pharmakologische Studien zu einer pflanzlichen Arzneimittelkombination aus Johanniskraut (Hypericum perforatum) und Passionsblume (Passiflora incarnata): in vitro und in vivo Belege für Synergie zwischen Hypericum und Passiflora in antidepressiven pharmakologischen Modellen. Fitoterapia 82, 474-480. doi: 10.1016/j.fitote.2010.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Fink, K. B., und Göthert, M. (2007). 5-HT-Rezeptorregulation der Neurotransmitterfreisetzung. Pharmacol. Rev. 59, 360-417. doi: 10.1124/pr.59.07103
CrossRef Full Text | Google Scholar
Ghaderi, N., and Jafari, M. (2014). Effiziente Pflanzenregeneration, genetische Treue und hochgradige Akkumulation von zwei pharmazeutischen Verbindungen in regenerierten Pflanzen von Valeriana officinalis L. S. Afr. J. Bot. 92, 19-27. doi: 10.1016/j.sajb.2014.01.010
CrossRef Full Text | Google Scholar
Grunze, H., Langosch, J., Schirrmacher, K., Bingmann, D., Von Wegerer, J., and Walden, J. (2001). Kava-Pyrone üben ähnliche Wirkungen auf die neuronale Übertragung und die transmembranösen Kationenströme aus wie etablierte Stimmungsstabilisatoren – ein Überblick. Prog. Neuropsychopharmacol. Biol. Psychiatry 25, 1555-1570.
Google Scholar
Guan, L.-P., and Liu, B.-Y. (2016). Antidepressiva-ähnliche Wirkungen und Mechanismen von Flavonoiden und verwandten Analoga. Eur. J. Med. Chem. 121, 47-57. doi: 10.1016/j.ejmech.2016.05.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hattesohl, M., Feistel, B., Sievers, H., Lehnfeld, R., Hegger, M., and Winterhoff, H. (2008). Extrakte aus Valeriana officinalis L. sl zeigen anxiolytische und antidepressive Effekte, aber weder sedierende noch myorelaxierende Eigenschaften. Phytomedicine 15, 2-15. doi: 10.1016/j.phymed.2007.11.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Houghton, P. J., and Seth, P. (2003). Pflanzen und das zentrale Nervensystem. Pharmacol. Biochem. Behav. 75, 497-499. doi: 10.1016/S0091-3057(03)00161-8
CrossRef Full Text | Google Scholar
Idayu, N. F., Hidayat, M. T., Moklas, M., Sharida, F., Raudzah, A. N., Shamima, A., et al. (2011). Antidepressivum-ähnliche Wirkung von Mitragynin, isoliert aus Mitragyna speciosa Korth, im Mäusemodell der Depression. Phytomedicine 18, 402-407. doi: 10.1016/j.phymed.2010.08.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Jawna-Zboiñska, K., Blecharz-Klin, K., Joniec-Maciejak, I., Wawer, A., Pyrzanowska, J., Piechal, A., et al. (2016). Passiflora incarnata L. Verbessert das räumliche Gedächtnis, reduziert Stress und beeinflusst die Neurotransmission bei Ratten. Phytother. Res. 30, 781-789. doi: 10.1002/ptr.5578
PubMed Abstract | CrossRef Full Text | Google Scholar
Kochanowska-Karamyan, A. J., and Hamann, M. T. (2010). Marine Indolalkaloide: potenzielle neue Wirkstoffe zur Bekämpfung von Depressionen und Angstzuständen. Chem. Rev. 110, 4489-4497. doi: 10.1021/cr900211p
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumarnsit, E., Vongvatcharanon, U., Keawpradub, N., und Intasaro, P. (2007). Fos-ähnliche Immunreaktivität in den dorsalen Raphe-Kernen der Ratte, ausgelöst durch einen Alkaloidextrakt von Mitragyna speciosa. Neurosci. Lett. 416, 128-132. doi: 10.1016/j.neulet.2007.01.061
PubMed Abstract | CrossRef Full Text | Google Scholar
León, F., Habib, E., Adkins, J. E., Furr, E. B., McCurdy, C. R., and Cutler, S. J. (2009). Phytochemische Charakterisierung der Blätter von Mitragyna speciosa, die in den USA angebaut werden. Nat. Prod. Commun. 4, 907-910.
PubMed Abstract | Google Scholar
Malsch, U., and Kieser, M. (2001). Wirksamkeit von Kava-Kava bei der Behandlung von nicht-psychotischen Angstzuständen nach Vorbehandlung mit Benzodiazepinen. Psychopharmacology 157, 277-283. doi: 10.1007/s002130100792
PubMed Abstract | CrossRef Full Text
McCarthy, A., Wafford, K., Shanks, E., Ligocki, M., Edgar, D. M., and Dijk, D.-J. (2016). REM-Schlaf-Homöostase in Abwesenheit von REM-Schlaf: Effects of antidepressants. Neuropharmacology 108, 415-425. doi: 10.1016/j.neuropharm.2016.04.047
PubMed Abstract | CrossRef Full Text | Google Scholar
Namola, V., Ratan, P., and Kothiyal, P. (2015). Depression und Rolle von marinen Biomaterialien: ein Überblick. Eur. J. Biomed. Pharm. Sci. 2, 137-148.
Nichols, D. E. (2012). Struktur-Wirkungs-Beziehungen von Serotonin 5-HT 2A Agonisten. WIREs Membr. Transp. Signaling 1, 559-579. doi: 10.1002/wmts.42
CrossRef Full Text | Google Scholar
Organization, W. H. (2017). Depression Fact Sheet 2016. Available at: http://www.who.int/mediacentre/factsheets/fs369/en/
Google Scholar
Poyares, D. R., Guilleminault, C., Ohayon, M. M., and Tufik, S. (2002). Kann Baldrian den Schlaf von Schlaflosen nach Benzodiazepin-Entzug verbessern? Prog. Neuropsychopharmacol. Biol. Psychiatry 26, 539-545.
PubMed Abstract | Google Scholar
Sagi, S., Avula, B., Wang, Y.-H., and Khan, I. A. (2016). Quantifizierung und Charakterisierung von Alkaloiden aus Wurzeln von Rauwolfia serpentina mittels Ultra-Hochleistungs-Flüssigkeitschromatographie-Photodiodenarray-Massenspektrometrie. Anal. Bioanal. Chem. 408, 177-190. doi: 10.1007/s00216-015-9093-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Sarris, J., Kavanagh, D., Byrne, G., Bone, K., Adams, J., and Deed, G. (2009). Die Kava Anxiety Depression Spectrum Study (KADSS): eine randomisierte, placebokontrollierte Crossover-Studie mit einem wässrigen Extrakt aus Piper methysticum. Psychopharmacology 205, 399-407. doi: 10.1007/s00213-009-1549-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Shimazaki, Y., Yajima, T., Takani, M., and Yamauchi, O. (2009). Metallkomplexe mit Indolringen: Strukturen und Auswirkungen von Metall-Indol-Wechselwirkungen. Coord. Chem. Rev. 253, 479-492. doi: 10.1016/j.ccr.2008.04.012
CrossRef Full Text | Google Scholar
Sichardt, K., Vissiennon, Z., Koetter, U., Brattström, A., and Nieber, K. (2007). Modulation postsynaptischer Potentiale in kortikalen Neuronen der Ratte durch mit verschiedenen Alkoholen mazerierte Baldrianextrakte: Beteiligung von Adenosin A1- und GABAA-Rezeptoren. Phytother. Res. 21, 932-937. doi: 10.1002/ptr.2197
PubMed Abstract | CrossRef Full Text | Google Scholar
Vicknasingam, B., Narayanan, S., Beng, G. T., and Mansor, S. M. (2010). Der informelle Gebrauch von Ketum (Mitragyna speciosa) für den Opioid-Entzug in den nördlichen Staaten der malaysischen Halbinsel und Auswirkungen auf die Drogensubstitutionstherapie. Int. J. Drug Policy 21, 283-288. doi: 10.1016/j.drugpo.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Vijeepallam, K., Pandy, V., Kunasegaran, T., Murugan, D. D., and Naidu, M. (2016). Mitragyna speciosa leaf extract exhibits antipsychotic-like effect with the potential to alleviate positive and negative symptoms of psychosis in mice. Front. Pharmacol. 7:464. doi: 10.3389/fphar.2016.00464
PubMed Abstract | CrossRef Full Text | Google Scholar
Yi, L.-T., Li, J.-M., Li, Y.-C., Pan, Y., Xu, Q., and Kong, L.-D. (2008). Antidepressivum-ähnliche verhaltensbezogene und neurochemische Wirkungen der mit Zitrusfrüchten assoziierten Chemikalie Apigenin. Life Sci. 82, 741-751. doi: 10.1016/j.lfs.2008.01.007
PubMed Abstract | CrossRef Full Text | Google Scholar